GC-MS测定大鼠血浆中反式氧化樟脑含量及其体内药动学研究*
2020-04-29张婷婷徐然江丽高湘旻叶明灯童宁郑枫
张婷婷,徐然,江丽,高湘旻,叶明灯,童宁,郑枫
(1.南京中医药大学附属南京医院药学部,南京市第二医院药学部,南京 210003;2.南京市食品药品监督检验院,南京 211100;3.中国医学科学院皮肤病医院药剂科,南京 210042;4.中国药科大学药物分析系,南京 210009)
反式氧化樟脑(trans-π-oxocamphor,TOC)系樟脑的活性代谢产物,可由其半合成衍生而来[1]。以TOC为主要成分的氧化樟脑注射液(Vitacamphorae injection)是一种中枢兴奋剂,可兴奋延脑呼吸中枢和血管运动中枢,因其能有效改善心肌代谢,改善心肌收缩力,清除氧自由基,改善缺氧后再给氧所致的心肌损伤[2],被广泛用于治疗中枢性呼吸困难及循环衰竭,也可用于各种疾病所致的心力衰竭(心衰)和呼吸循环衰竭[3]。TOC通过收缩内脏血管和舒张皮肤血管,使血压上升;通过加强心脏收缩,恢复心脏节律,增加每分钟心输出量,从而起到刺激心脏功能和帮助恢复正常循环的作用[4]。据临床使用回顾性分析,心血管内科主要用于冠状动脉粥样硬化性心脏病;肾病内科、神经内科、呼吸内科等其他内科科室用于慢性阻塞性肺疾病、心衰、高血压心脏病等疾病导致的呼吸困难及胸闷症状[5]。另有临床研究表明氧化樟脑注射液与环磷酰苷葡胺联用可以使血清NT-proBNP、cTnT、β-EP、IL-1β 水平均显著降低,而VEGF、IGF-1 水平显著升高,治疗心力衰竭效果比单用环磷酰苷葡胺更明显[6]。当TOC大量作用于大脑皮质运动区及脑干时易引起癫样惊厥[7-8]。
尽管TOC已经在临床应用了几十年,但国内外药典均未收载该品种,且关于它体内药物分析的研究也十分有限,氧化樟脑注射液的药品说明书中“药动学”项下为“本品未进行该项实验且无可靠参考文献”。主要原因是TOC含醛基,具有化学不稳定性和代谢不稳定性[9],长时间暴露在空气中易被氧化成羧酸,人体经皮下注射后在体内代谢为醇和酸,并和葡萄糖醛酸结合经尿排泄[10]。加之TOC具有低极性和易挥发性,加大了分析难度。目前已有文献中使用HPLC-UV测定氧化樟脑注射液的有关物质[11],但并未应用于生物样品分析。气相色谱联用质谱(gas chromatography-Mass spectrometry,GC-MS)非常适用于分析小分子、低极性和易挥发的物质[12-15]。TOC属于双环单萜类小分子活性药物,沸点较低,且临床上给药剂量小,故本文选择灵敏度高特异性强的GC-MS法测定大鼠血浆中TOC含量,并研究TOC在大鼠体内的药动学参数,从而为其在人体内研究提供参考。
1 仪器与试药
1.1仪器 电子天平(BT25S,赛多利斯科学仪器有限公司,感量:0.01 mg);涡旋混合器(XW-80A,上海医大仪器有限公司);高速冷冻离心机(ST-16R,Thermo Fisher公司);气质联用仪(GCMS-QP2020,岛津公司)。
1.2药品、试剂与动物 反式氧化樟脑对照品(含量99.87%,长春大政药业科技公司);氧化樟脑注射液(2 mL:10 mg,批号:170501,长春大政药业科技公司);甲苯(内标,色谱纯,批号:610585,Thermo Fisher公司);无水乙醇、乙酸乙酯均为分析纯;6只Sprague Dawley大鼠(雄性)购自北京维通利华实验动物技术有限公司南京分公司[许可证号:SCXK(京)2012-0001],8~11周龄,体质量范围(270±20)g,常规条件饲养。
2 方法与结果
2.1色谱条件与质谱条件 色谱柱为安捷伦HP-5MS 色谱柱(30 m×0.25 mm,0.25 μm);载气为氦气(纯度为99.99%);载气流速为1.11 mL·min-1;进样口温度:275 ℃;进样模式为分流进样,进样量1 μL,分流比为3:1。升温程序:起始温度70 ℃保持1.3 min,以20 ℃·min-1的速度升温至170 ℃并保持2.5 min。质谱接口温度300 ℃,离子源EI温度为280 ℃,电子轰击能量70 eV。选择单离子监测(SIM)模式扫描,正离子方式检测,选择监测的离子m/z95(TOC)和m/z91(内标)。
2.2溶液的配制 ①系列对照品溶液的配制。精密称取反式氧化樟脑对照品10 mg,置于棕色量瓶中,用无水乙醇溶解稀释制备成1000 μg·mL-1溶液作为TOC储备液,用无水乙醇依次稀释储备液,可得到浓度为0.5~50 μg·mL-1TOC系列对照品溶液,密封并避光,于4 ℃冰箱中保存。②内标溶液的配制。精密量取甲苯115 μL置于棕色量瓶中,用无水乙醇定容,得到1000 μg·mL-1内标储备液。取内标储备液用无水乙醇定量稀释成10 μg·mL-1内标溶液。
2.3校正标准样品与质控样品的制备 精密吸取空白大鼠血浆40 μL,加入对照品系列溶液10 μL,得到0.1~10 μg·mL-1系列校正标准样品。同法制备得0.2,1.0,8.0 μg·mL-1的低浓度、中浓度和高浓度的质控(QC)样品。
2.4血浆样品处理 取含药大鼠血浆(或“2.3”项下各血浆样品)50 μL于EP管中,加入乙酸乙酯150 μL和内标工作液10 μL,涡旋30 s,在4 ℃半径为4 cm的离心机上以转速13 300 r·min-1离心5 min,取上清液1 μL进样,进行GC-MS定量分析。由于TOC的化学性质不稳定,大鼠血浆一经分取或校正标准样品及QC样品一经制备则应立即进行血浆样品处理,并封闭避光冷藏。
2.5专属性考察 取大鼠空白血浆,除不加内标溶液(改加同体积乙酸乙酯)外,其余按“2.4”项下操作,进行GC-MS分析,即得空白血浆色谱图。通过比较大鼠空白血浆与最低定量下限(LLOQ)样品和给药后大鼠血浆样品的典型色谱图,考察方法的特异性与进样残留情况。典型色谱图见图1(A,B,C)。由图可见TOC保留时间约为5.80 min,内标甲苯保留时间约为1.05 min。为考察进样残留情况,标准曲线最高浓度进样后,分析空白大鼠血浆样品,结果显示干扰组分的响应低于当批次LLOQ待测物响应的20%及内标响应的5%,表明大鼠血浆中的内源性物质对待测物及内标的定量测定无干扰。本方法具有较高的特异性。
2.6线性范围及定量下限 按“2.4”项下操作处理系列校正标准样品,进行GC-MS分析,以TOC与内标峰面积比(Y)对待测物浓度(X,μg·mL-1)用加权最小二乘法(权重为1/χ2)进行线性回归,计算线性回归方程及其相关系数r,并绘制标准曲线。以血浆标准曲线的最低浓度点进行倍比稀释,进样测定,按S/N=10计,确定LLOQ。结果表明,TOC在0.1~10.0 μg·mL-1范围内浓度线性关系良好,典型回归方程为:Y=0.864X+0.09(r=0.999 6)。以标准曲线的最低浓度点作为LLOQ,其代表性色谱图见图1B。在该浓度下,TOC色谱峰的信噪比(S/N)>10,准确度用相对误差(RE)表示,平均为-4.82%,批内精密度为9.95%,批间精密度为10.33%,表明本方法测定大鼠血浆中的TOC最低定量限可以达到0.1 μg·mL-1。

A.空白血浆;B.LLOQ样品;C.静脉注射氧化樟脑注射液3.75 mg·kg-1后大鼠血样
图1 血浆样品测定TOC典型色谱图
A.blank plasma;B.LLOQ sample;C.blood sample after intravenous injection of vitacamphorae injection at 3.75 mg·kg-1in rats
Fig.1RepresentativechromatogramsofTOCinbloodsample
2.5.3回收率试验与基质效应 配制低浓度、中浓度和高浓度的QC样品,按“2.4”项操作,进样测得峰面积(A1),每一个浓度平行测定6份。将空白血浆样品按“2.4”项下操作后,加入等体积相应浓度工作液进样测得峰面积(A2),每一个浓度平行测定6份。将浓度为0.2,1.0,8.0 μg·mL-1的溶液样品加入相应内标溶液后直接进样,得峰面积(A3),每一个浓度平行测定6份。计算公式为:TOC回收率=A1/A2×100%,TOC基质效应=A2/A3×100%。大鼠血浆中TOC的低、中、高3个质量浓度的绝对回收率平均在76.94%~85.31%。其基质效应平均值在94.42%~98.05%,详见表1,同时测定内标回收率为(96.56±0.56)%,基质效应为(98.77±5.32)%,提取率为95.37%,表明各质量浓度回收率较高,且无明显基质效应,不会对样品的分析产生影响。
表1 大鼠血浆中反式氧化樟脑的绝对回收率、基质效应及提取率
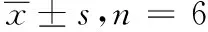
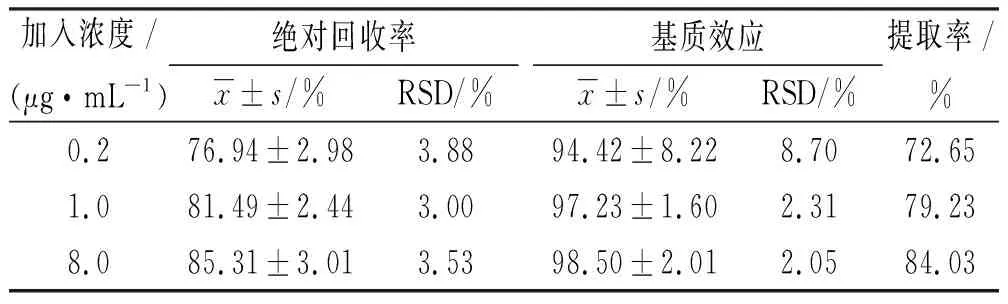
加入浓度/(μg·mL-1)绝对回收率x±s/%RSD/%基质效应x±s/%RSD/%提取率/%0.276.94±2.983.8894.42±8.228.7072.651.081.49±2.443.0097.23±1.602.3179.238.085.31±3.013.5398.50±2.012.0584.03
2.7准确度与精密度 配制LLOQ样品及低、中、高浓度的QC样品,按“2.4”项操作,进行GC-MS分析。连续考察3个分析批,每批、每个浓度平行操作6份,随行标准曲线计算各样品测得浓度,并计算批内批间精密度。大鼠血浆中TOC的LLOQ样品及低、中、高3个质量浓度的QC样品的准确度用相对误差(RE)表示,范围是-6.68%~2.02%,对应的批内、批间精密度RSD为1.45%~10.36%,结果详见表2。均符合有关生物样品分析方法验证的要求。
2.8稳定性考察 配制低、中、高浓度的QC样品,分别考察血浆样品处理后室温条件下放置2 h、处理后4 ℃自动进样器里放置8 h、-20 ℃冷冻放置3 d的稳定性,各浓度样品平行操作6份。计算质控样品血浆实测值之间的相对差异。结果显示稳定性良好,准确度RE在-5.58%~1.74%之间,具体见表3。
2.9大鼠药动学研究的应用 6只SD大鼠给药前禁食不禁水12 h,根据不同种属之间剂量换算以及预实验结果,给予大鼠氧化樟脑注射液的剂量为3.75 mg·kg-1,经尾静脉注射给药,于给药前及给药后1,2,3,4,5,6,7,8,9,10,12,15 min由左股静脉留置导管取血约0.3 mL置于含肝素钠抗凝管中轻摇混匀,随即在4 ℃下,半径为4 cm的离心机上以转速3500 r·min-1,离心10 min,分取血浆,处理测定,根据测定的浓度-时间关系采用DAS 2.1.1版软件进行房室模型拟合,同一权重下,选择AIC最小的进行模型拟合,并依照统计矩理论估算药动学参数。平均血浆药物浓度-时间曲线及拟合对数浓度-时间曲线见图2,经计算机拟合,TOC的体内过程属于二房室模型。按统计矩方法指导的非房室模型估算的主要药动学参数如下:Cmax为(5.604±0.641)mg·L-1,AUC(0-t)为(20.459±2.034)mg·L-1·min,AUC(0-∞)为(21.683±2.029)mg·L-1·min,MRT(0-t)为(2.4±0.103)min,t1/2z为(6.938±3.093)min,清除速率CLz为(0.175±0.017)L·min-1·kg-1,表观分布容积Vz为(1.744±0.847)L·kg-1。可见,TOC在大鼠体内经血消除速较快,并且AUC(0-t)和AUC(0-∞)相当,表明TOC在15 min内基本消除殆尽。
表2 大鼠血浆中反式氧化樟脑的准确度和精密度试验结果
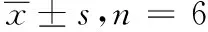

加入浓度/(μg·mL-1)测定浓度/(μg·mL-1)准确度(RE,%)精密度(RSD,%)批内批间0.10.093±0.009-6.6810.140.10.093±0.009-6.639.9510.330.10.098±0.010-1.1510.360.20.204±0.0092.024.610.20.201±0.0040.632.175.080.20.198±0.007-0.933.641.01.016±0.0391.583.801.01.004±0.0380.443.762.041.01.007±0.0260.732.588.07.981±0.115-0.241.458.08.008±0.1680.372.092.968.07.879±0.315-1.553.99
表3 各种条件下TOC含药血浆样品的稳定性试验结果
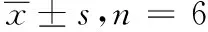
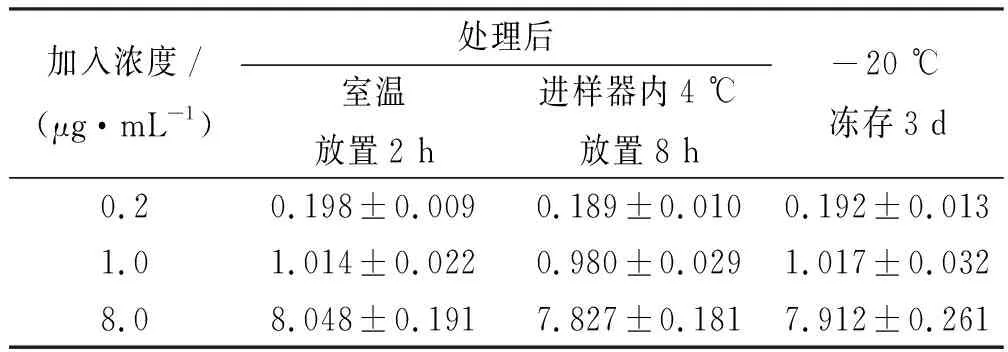
加入浓度/(μg·mL-1)处理后室温放置2 h进样器内4 ℃放置8 h-20 ℃冻存3 d0.20.198±0.0090.189±0.0100.192±0.0131.01.014±0.0220.980±0.0291.017±0.0328.08.048±0.1917.827±0.1817.912±0.261
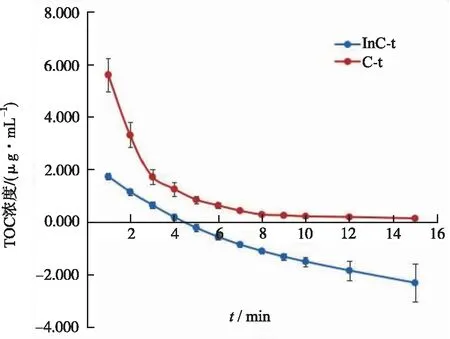
图2 大鼠单次静脉注射氧化樟脑注射液3.57 mg·kg-1后的药时曲线图(n=6)
Fig.2Concentration-timecurveofTOCinratsaftersingleintravenousadministrationofvitacamphoraeinjectionat3.57mg·kg-1(n=6)
3 讨论
3.1内标的选择 以TOC沸点和其双环单萜类结构为依据,选取水杨酸甲酯、环己酮和甲苯为内标进行考察,发现以水杨酸甲酯峰形不理想,且分析时间更长;环己酮则易受血浆中杂质干扰,影响生物样品的测定;以甲苯作为内标,性质稳定,提取率高,峰形对称,无干扰。
3.2色谱优化 虽然应用“2.1”项的程序升温方法已获得了满意的分离效果,曾尝试缩短分析时间,在其他参数保持不变的情况下,降低初始柱温、提高升温速率、缩短维持时间,运行总时间约为7.70 min。但是,控制系统会在该温度下提示检测器饱和报警。另外,在参数优化中选择一个合适的分流比非常重要。尽管较小的分流比率在一定程度上提高了灵敏度,但杂质进入色谱柱的量相比TOC 也会增加,这导致了高温平台清理时间的延长。
3.3提取方法的选择 前文述及笔者查阅多方资料,均未发现有关TOC的生物样品测定的可靠参考文献。由于TOC属于双环单帖(莰烯类)含氧化合物,有较强的亲脂性,而血浆中大多数内源性杂质是水溶性的,所以可利用待测物与内源性干扰物在有机溶剂中的分配系数不同而实现分离。本实验的样品处理方法使用乙酸乙酯作为萃取剂,样品经萃取后直接进样,可除去血浆中大部分内源性干扰物质。但在样品提取过程中,虽然待测组成分得到了净化,但该提取液直接注入仪器时,可能达不到检测器的灵敏度要求。在实际的体内样品分析中,若体内样品中待测成分的含量较小则样品提取完成后可先通入氮气流挥干萃取剂,残渣再复溶浓集后进行分析。但在本实验中由于TOC的易被氧化的特性,尝试吹干浓集的过程中易引起醛基氧化,影响提取率,且步骤繁琐,不太适合临床快速准确的分析,因此本实验选择了乙酸乙酯萃取后直接进样的方法,检测限亦能达到分析要求。
3.4药动学参数的临床启示 大鼠体内药动学过程拟合结果为二室模型,其表观分布容积约1.744 L·kg-1,清除速率为0.175 L·min-1·kg-1,可见TOC进入体内后迅速分布全身,并且迅速清除,同时少量可能进入血流较缓慢的静态肌肉组或脂肪组织,致完整药物分子吸收、分布和消除的体内平均滞留时间仅为约2.4 min。这和很多呼吸兴奋剂及抗心衰药物的作用维持时长类似,如呼吸兴奋药尼克刹米静脉注射一次只维持5~10 min,进入体内后迅速代谢为烟酰胺再经甲基化成N-甲基烟酰胺而排出;如速效和短时作用的血管扩张药硝普钠,静脉滴注后立即达到Cmax,因其代谢产物无扩张血管活性,停止给药后药效仅维持1~10 min。再如用于器质性心力衰竭的多巴酚丁胺,清除率高达244 L·h-1,半衰期约2 min,作为β1受体激动剂直接作用于心脏,在肝脏代谢为无活性化合物。值得注意的是静脉滴注给药方式可以延长其药效至10 min,这一点可以给我们启发。氧化樟脑注射液的说明书中推荐的给药方式是“静脉注射,肌内注射和皮下注射”,临床上用于治疗慢性心力衰竭、肺心病、稳定性心绞痛等疾病时多用氯化钠注射液稀释后静脉滴注方式给药[13-14]。这样确实延长了药效持续时间,因为按照统计矩理论恒速静滴时MRT静滴=MRT静注+T/2(式中T为输液时间)[15]。
3.5TOC的分子机制探讨 TOC给心肌细胞带来的益处毋庸置疑,虽然目前关于其作用分子机制研究较少。有研究表明TOC可以抑制磷酸二酯酶4(PDE4)的活性[16-17]。由于PDE4参与细胞环磷酸腺苷(cAMP)的调节过程,因此PDE4与血小板聚集活化、免疫性炎症反应、血管平滑肌细胞增殖、血管舒张及心肌收缩调节等过程有关。又有研究表明[2]氧化樟脑注射液能升高大鼠心肌组织中一氧化氮(NO)含量和一氧化氮合酶(iNOS)活性,对内皮功能具有较明显保护作用,这可能是其改善心肌缺血症状、避免心肌纤维化发生的又一机制。硝酸甘油治疗充血性心衰的机制就是通过释放NO,激活鸟苷酸环化酶,使平滑肌和其他组织内的环鸟甘酸(cGMP)增多,导致肌球蛋白去磷酸化,调节平滑肌收缩状态,而引起血管扩张的。另外,硝酸甘油舌下给药后,t1/2为1~4 min,作用持续时间却达10~30 min。至于TOC是否像硝酸甘油一样能够产生活性较弱但半衰期更长的活性代谢产物,仍需要进一步研究。
综上,对本文建立的GC-MS测定大鼠血浆中的反式氧化樟脑分析方法进行了系统的方法学验证,结果表明本分析方法可靠,能够快速、准确地测定大鼠血浆中TOC的浓度,可为TOC的人体内药代动力学研究提供参考,进而指导临床合理用药。
