绒毛诃子对小鼠毒性的影响
2020-04-29王晨晓马贝贝梁耀月左泽平王志斌
王晨晓,马贝贝,天 宇,梁耀月,高 阳,左泽平,王志斌
(1.北京中医药大学中药学院,北京 100102;2.北京市药品检验所,北京 100035;3.北京中医药大学北京中医药研究院,北京 100029)
诃子为使君子科植物诃子Terminalia chebulaRetz.或绒毛诃子Terminalia chebulaRetz.var.tomentellaKurt.的干燥成熟果实[1],是蒙药、藏药等民族药的常用药,原产于印度、斯里兰卡、缅甸,在国内岭南也有分布,云南为诃子的道地产地,有8 个变种:绒毛柯子、恒河诃子、柠檬色诃子、马来亚诃子、斯里兰卡诃子、粗毛叶诃子、矮诃子、银叶诃子[2]。诃子性平和,酸苦涩三味并具,归肺经、大肠经,能止咳止泻、敛肺涩肠、利咽降火等,常用于治疗长咳不止、脱肛便血、喉痛音哑、长痢久泻、肺虚咳喘等多种病症,更是临床治疗失音的良药,与余甘子、毛诃子组成三果汤散,可单独使用,或配伍其他藏药组成复方[3]。在蒙医藏医中,诃子用于治疗“龙”病、“赤巴”病、“培根”病[4],广泛用于调和药性、消除病邪、解毒、生肌长骨等方面[5]。现代药理学研究[6]表明,诃子有抗金黄色葡萄球菌、福氏痢疾杆菌,抗真菌,抗氧化,抗诱变作用,还有一定的解痉镇咳作用,其所含诃黎勒酸、诃子酸等有抗肿瘤和降糖作用,也对治疗阿尔茨海默病有一定疗效。
诃子的药理作用多有研究,但对毒性方面少有报道。Prabal Ghosh 等[7]研究了不同溶剂的诃子提取液对雄激素关键酶(D5、3β-HSD、17β-HSD)与血清睾酮水平的影响,结果表明,诃子水提液显著上调睾丸Bax基因和下调Bcl-2 基因,导致睾丸活性成分较低,流式细胞检测发现精子活力明显降低,表明诃子通过减少睾丸基因组传感器并提升可能导致男性避孕的精子凋亡传感器发挥避孕作用。研究[8]表明,在重复剂量28 d 的口服毒性研究中,给予1 000 mg/kg 80%乙醇诃子提取物后,小大鼠食物摄入量和饮水量明显减少,葡萄糖和AST 水平显著变化,表明肝肾功能紊乱;在组织病理学筛查中,口服给药组在肝脏中显示出轻微的肉芽肿性炎症,所有其他器官正常,在28 d后,诃子提取物会导致肝脏和肾脏功能轻度紊乱。本课题组前期通过小鼠急性毒性实验和大鼠亚急毒性实验,发现诃子靶器官是肝脏,整体动物实验与高内涵筛选分析技术技术在毒性结果判断上有一致性[9]。由于国外并没有指出诃子具有明显的肝毒性和受试动物死亡的现象,故相关是不可或缺的。
1 材料
1.1 动物 ICR 小鼠70 只,SPF 级,雌雄各半,购自北京市维通利华实验动物技术有限公司,饲养于北京市药检所药理毒理室,实验动物生产许可证号SCXK(京)2016-0011,实验动物使用许可证号SYXK(京)2015-0033。
1.2 药材与试剂 诃子 [北京同仁堂总店(大栅栏店)],经北京市药检所中药室主任陈友根老师经鉴定为绒毛诃子,产地为云南。苦味酸(批号20180527,天津华特化研科技有限公司);灭菌注射用水(批号1809013205,石家庄四药有限公司);甲醛(批号20180606,北京益利精细化学品有限公司);丙氨酸氨基转移酶检测试剂盒(ALT,批号180841)、天门冬氨酸氨基转移酶检测试剂盒(AST,批号180791)、总蛋白检测定试剂盒(TP,批号180771)、总胆固醇检测试剂盒(CHO,批号181611)、总胆红素检测试剂盒(TBIL,批号180891)、尿素检测试剂盒(Urea,批号180901)、肌酸激酶检测试剂盒(CK,批号180851)、碱性磷酸酶检测试剂盒(ALP,批号180951)、γ-谷氨酰基转移酶检测试剂盒(GGT,批号181001)、肌酐检测试剂盒(Crea,批号180671)、白蛋白检测试剂盒(ALB,批号180831)、甘油三醋检测试剂盒(TG,批号180811)、葡萄糖检测试剂盒(GLU,批号180831)均购自中生北控生物科技股份有限公司。
1.3 仪器 TE2101-L、BS224S 电子天平[赛多利斯科学仪器(北京)有限公司];AU400 生化仪(日本Olympus 光学株式会社);DM3000 光学显微镜、EG1150H 组织包埋机、RM2245 半自动切片机、Auto Stainer×1 染色、HI1210烤片机、ASP-200 组织脱水机、HI1210 摊片机(德国Lecia公司);Multifuge X3 R 高速冷冻离心机[赛默飞世尔科技(中国)有限公司]。
2 方法
2.1 诃子水煎液制备 把绒毛诃子去除杂质和核,加8 倍量蒸馏水浸泡60 min,用煮药砂锅煎煮2 次,合并药液,浓缩,得2 g/mL 水煎液。使用前,用灭菌注射用水将其配制成组间剂量系数为0.85 的不同质量浓度药液,T2~T7 组给药剂量分别为35.7、30.34、25.79、21.92、18.63、15.83 g 生药/kg,相当于人用最大剂量的278、237、201、181、145、123 倍。
2.2 绒毛诃子水煎液半数致死量测定 根据随机数表将70 只ICR 小鼠(雌雄各半)分为7 组,依次为T1~T7 组,T1 组为对照组,T2~T7 组为“2.1”项下给药剂量,每组10 只,雌雄各半。所有动物均处于SPF 级屏障系统,温度控制在(24±2)℃,每天12 h 光照/12 h 暗室,并给予充足的饮用水和标准的颗粒饲料喂养。给药前禁食12 h,各给药组小鼠分别一次性灌胃不同浓度的药液,给药量为0.1 785 mL/10 g;对照组小鼠灌胃等体积的灭菌注射用水,给药后,禁食4 h。
在灌胃给药后6 h 内,认真观察小鼠的生理状况[饮水情况及其对外反应情况(如瞳孔反应)]。在其后6~12 h,每隔2 h 观察记录1 次。从给药后的第2 天开始,每天观察记录1 次动物的基本状况,着重于运动行为(背部是否出现弓起或强直、怪叫、竖尾、腹部抽搐、俯卧还有其自主神经活动,如竖毛等)及其异常情况(如大小便异常或其他分泌物)。小鼠分别在第0、1、3、5、7、9、11、13、14 天上午9:00 称定质量,仔细记录出现异常症状小鼠的数量、症状开始时间、结束时间、死亡时间等。观察结束后,所有存活小鼠麻醉,打开腹腔,腹主静脉取血,全血4 ℃、2 500 r/min 离心15 min,分离血清,测定生化指标,肉眼观察体内脏器病变情况。观察结束后,迅速取出肝脏与肾脏,于预冷的生理盐水中漂洗数次,称定质量,取肝脏大叶中部、肾脏,10%中性福尔马林溶液固定。
2.3 绒毛诃子蓄积毒性实验 采用20 d 定期递增剂量法评价绒毛诃子水煎液的蓄积毒性作用。取ICR 小鼠60 只(雌雄各半),对照组20 只,给药组40 只。对照组以灌服灭菌注射用水组为阴性对照;给药组小鼠每天灌胃绒毛诃子水煎液,第一阶段的的剂量为0.1LD50,第二阶段的剂量为0.15 LD50,4 d 为一阶段,以此类推。连续灌胃20 d 后终止实验,计算蓄积系数,实验期间观察给药小鼠的一般状况并记录体质量(“2.2”项下观察一样),灌胃剂量如表1 所示。

表1 蓄积毒性递增剂量法染毒方案(g/kg)
2.4 小鼠生化指标检测 急性毒性观察14 d,蓄积毒性在20 d 末次给药后,禁食不禁水12 h,处死存活小鼠,进行腹主静脉取血,全血4 ℃、2 500 r/min 离心15 min,分离血清,进行相关生化检测。反映胆汁淤积的主要指标有ALP、GGT,反映肝脏受损的主要指标有AST、ALT,反映肝脏胆排泄、分泌及解毒功能的主要指标有TBIL。
2.5 小鼠体质量、肝脏指数计算 在急性毒性实验中,每日观察存活小鼠情况,并隔日称定体质量。观察期结束时并取血结束后,摘取小鼠肝、肾精密称定质量,计算其脏器指数。在蓄积毒性实验中,每日同样时间对小鼠称定体质量并观察现象,20 d 实验结束后禁食12 h,取其心、肝、脾、肾、肺等重要脏器,计算各脏器指数。
2.6 病理切片观察 实验结束时,肉眼观察体内脏器病变情况。观察结束后迅速摘取小鼠心、肝、脾、肺、肾,于预冷的生理盐水中漂洗数次,并称定质量,将主要脏器用10%中性福尔马林溶液固定,制作病理切片,而后常规修整蜡块、脱水至透明、浸蜡、包埋、切片并进行HE 染色,在显微镜下观察病理组织变化。
2.7 统计学分析 使用SASS9.4 软件进行统计分析,数据以(±s)表示,组间比较采用单因素方差分析。以P<0.05 表示差异具有统计学意义。
3 结果
3.1 急性毒性实验
3.1.1 急性毒性症状和体质量变化 口服给药后6 h 内,高剂量组(T2、T3 组)小鼠活动减少、安静、背毛凌乱、扎堆抱团,至给药后12 h,出现呆卧少动,腹泻、水样下痢,未出现死亡现象。小鼠初步出现死亡现象的时间在12~24 h 内,集中死亡现象的时间在24~72 h 内,3 d 后无死亡。死亡前,小鼠会出现走路不稳、昏睡、呼吸衰竭、正向反射消失、嘴角有明显分泌物,死象挣扎,未见其他异常症状。对其及时剖检,观察其脏器的颜色、外形、质地等情况,发现死亡小鼠肝脏与正常小鼠肝脏比较,颜色有明显变化,其他脏器未见异常。
存活实验小鼠与对照组相比,体质量增长缓慢。给药组小鼠在灌胃24 h 后,体质量减轻,T2、T3、T4、T5、T6、T7 组的小鼠出现了负增长。见图1。

图1 绒毛诃子水煎液对小鼠体质量的影响
3.1.2 LD50各剂量组小鼠出现死亡的时间随剂量减少而后移,见表2、图2。绒毛诃子按生药量计算,其LD100为30.34 g/kg,相当于人常用剂量的237 倍(《中国药典》 规定诃子临床剂量是3~9 g,对于70 kg 成人,临床上每日可用的最大剂量是0.128 g 生药),其LD50为18.926 g 生药/kg,LD50(Feiller 校正)95%的可信限为17.026~20.62 g生药/kg,为人最大日用量的147.8 倍。
3.1.3 血清生化指标 如表3 所示,与对照组比较,给药组小鼠血清ALT、AST、TP、ALB、GLO、A/G、TBIL、TG、GLU、ALP 水平上升(P<0.05,P<0.01),Crea、CK 水平下降(P<0.01)。
3.1.4 肝肾脏器指数 各组小鼠主要脏器心、脾、肺和肾均未见病变等异常,而肝脏有明显颜色变化。与对照组对比,T6 组肝、肾脏器指数有差异(P<0.01),T7 组肝、肾脏器指数无差异(P>0.05),见表4。
3.1.5 肝肾脏器病理切片 在光镜下,对照组小鼠肝细胞完整、排列规则、肝窦未见明显淤血扩张;实验组小鼠出现了明显的肝细胞肿胀,细胞核增大,胞浆疏松淡染,吞噬了色素的枯否氏细胞,多见于中央静脉周围,有1 例出现了肝细胞坏死现象。与对照组相比,给药组小鼠有3 只肾脏病变严重,表现为肾小管的局灶性病变、肾小管上皮细胞数量增加、细胞核大小不等、淡然胞浆较少嗜碱性,病灶内还可见颗粒管型,透明管型和肾小管囊性扩张等病变。见图3。

表2 小鼠灌胃绒毛诃子水煎液后不同时间的死亡数
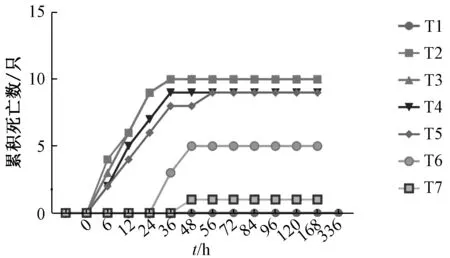
图2 绒毛诃子不同剂量组小鼠累积死亡数—时间曲线
3.2 蓄积毒性
3.2.1 临床表现 小鼠在给药后第1 阶段,饮食、进水、小大便皮毛状况、日常活动表现、体质量增长正常。在给药后的第2、3 阶段,小鼠背毛凌乱,腹泻,呆卧少动,体质量增长缓慢,未出现死亡。在给药后第4 阶段,小鼠出现死亡,腹部出现轻微鼓胀现象,进食量减少,活动减少,给药组雄性小鼠体质量出现了负增长。在给药后第5 阶段,小鼠腹胀情况加重,进食量减少,精神萎靡,反应迟钝,给药组小鼠体质量与第2 阶段相比无差异。见图4。
表3 绒毛诃子水煎液处理14 d 后对小鼠血清生化指标的影响(±s)
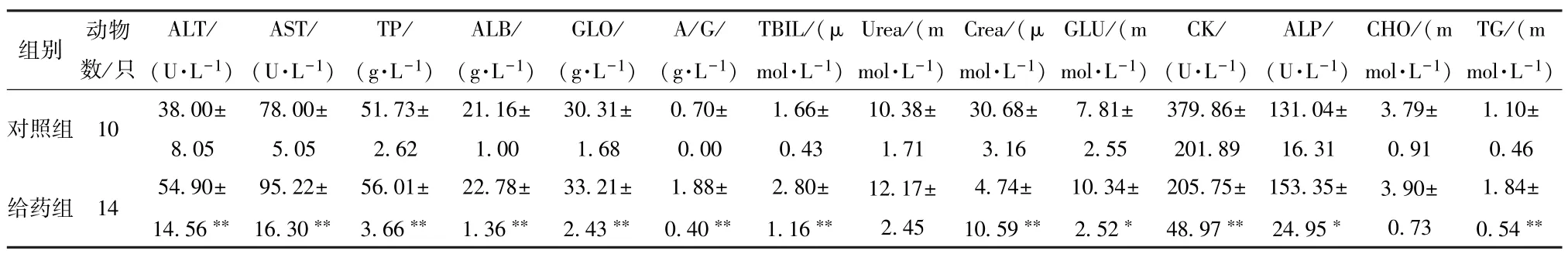
表3 绒毛诃子水煎液处理14 d 后对小鼠血清生化指标的影响(±s)
注:与对照组比较,∗P<0.05,∗∗P <0.01。
表4 绒毛诃子水煎液对小鼠肝肾脏器指数的影响(±s)

表4 绒毛诃子水煎液对小鼠肝肾脏器指数的影响(±s)
注:与对照组比较,∗P<0.05,∗∗P <0.01。

图3 小鼠肝肾器官组织学形态

图4 绒毛诃子水煎液对大鼠蓄积毒性体质量的影响
蓄积毒性死亡情况见表5,总计死亡10 只,K=LD50(n)/LD50(1),LD50(n)为每只动物共摄入受试物相当的LD50数,LD50(1)为受试物的经口LD50。20 d 连续给药后,给药剂量已达到5.26 LD50,死亡数未过半,此时蓄积系数K>5,按蓄积毒性分级标准[10],K<1,高度蓄积;1≤K<3,明显蓄积;3≤K<5,中等蓄积;K≥5,轻度蓄积。由此可知,绒毛诃子为轻度蓄积。
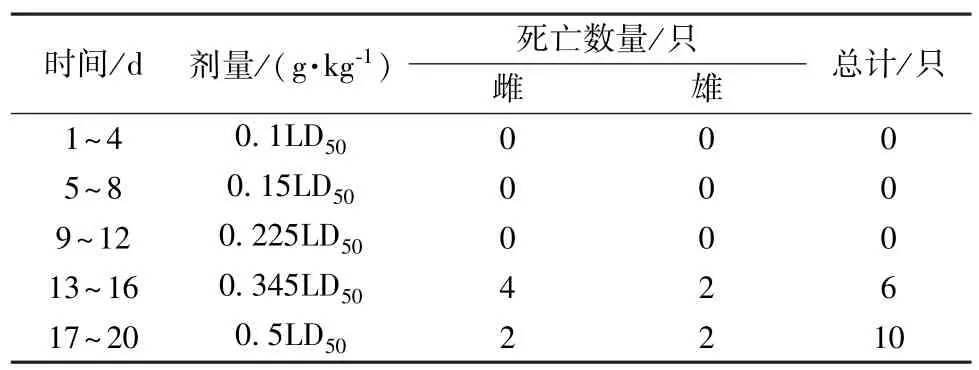
表5 蓄积毒性实验大鼠死亡情况
3.2.2 脏器指数 各组小鼠主要脏器心、脾、肺和肾均未见病变等异常,肝脏呈现灰黄色,表面不光滑,有明显的颜色变化。腹胀小鼠经解剖后发现,肠道和胃里有大量气体。与对照组比较,雄性给药组心、肝、肺脏器指数增加(P<0.05,P<0.01),雌性给药组肝脏指数增加(P<0.01)。见表6。
3.2.3 血清生化指标 与对照组比较,给药组小鼠血清ALT、AST、TP、ALB、GLO、A/G、CK 水平升高,TBIL、Urea 水平降低(P<0.05,P<0.01)。见表7。
3.2.4 肝肾脏器病理切片 在16 只雄性小鼠中,2 只出现肝坏死,表现为肝细胞肿胀,胞浆稀薄、淡然,细胞核仁大,染色质聚集;1 例有小坏死灶;4 例出现肾小管局灶性病变,表现为肾小管上皮细胞数量增加、细胞核大小不等、淡然胞浆较少嗜碱性。对照组肺细胞结构完整;给药组肺泡结构破坏,被炎细胞浸润,有肉芽肿性炎症;2 组心、脾均未见明显异常。
表6 绒毛诃子蓄积毒性实验大鼠脏器指数(±s)

表6 绒毛诃子蓄积毒性实验大鼠脏器指数(±s)
注:与对照组比较,∗P<0.05,∗∗P<0.01。
表7 绒毛诃子蓄积毒性生化指标(±s)

表7 绒毛诃子蓄积毒性生化指标(±s)
注:与对照组比较,∗P<0.05,∗∗P<0.01。
4 讨论
诃子在《中国药典》 中有2 个基源,一个是使君子科植物诃子,另一个是绒毛诃子,经过河北安国实地调查和在北京各药房采购调研发现,有些药商卖出药材标明为使君子科诃子,但经专家鉴定后为诃子的其他变种,例如恒河诃子和大诃子。课题组前期已经对使君子科诃子做了毒性靶器官的探讨,但查询国内外相关文献发现,鲜有对绒毛诃子的相关研究。
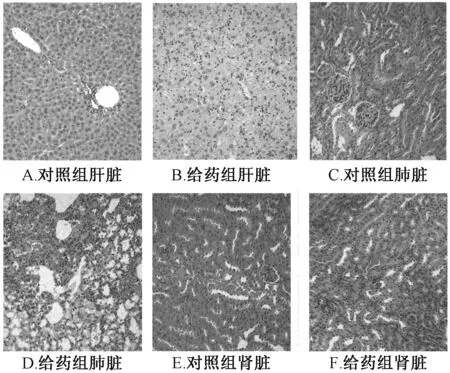
图5 蓄积毒性小鼠器官组织学形态
本实验用14 d 急性毒性和20 d 蓄积毒性实验相结合的方法来探讨绒毛诃子的毒性,为合理用药提供参考。通过急性毒性实验,确定绒毛诃子LD50为18.926 g 生药/kg,是70 kg 人最大日用量的147.8 倍;给药剂量为人常用剂量的145 倍时,其肝脏、肾脏指数与对照组相比差异具有统计学意义,结合血清生化指标,ALT、AST、TP、ALB、GLO、A/G、TBIL、Crea、CK、TG 水平与对照组相比也有显著差异,表明小鼠肝脏和肾小管都出现了不同程度的损伤,推测绒毛诃子的急性毒性靶器官可能是肝脏和肾脏。
20 d 蓄积毒性实验是在一定期限内,以低于致死剂量的标准确定给药剂量后每日染毒,以此判断药物毒性在代谢过程中是否有蓄积现象。绒毛诃子在蓄积毒性中,其蓄积系数为K>5,为轻度蓄积,同时小鼠体质量增长缓慢。在前3 个阶段时,给药组小鼠与正常组相比,日常表现都正常;在第4、5 阶段,给药组小鼠活动迟缓、背毛凌乱、腹泻、腹涨、呆卧不动现象明显。通过观察蓄积毒性靶器官,雄性给药小鼠与对照组小鼠相比心肺、肝脏指数有统计学差异,推测给药过程中小鼠有胀气、进食不顺、心肺供应消耗不足,造成萎缩;雌性给药小鼠与对照组比较,肝脏指数差异有统计学意义。结合生化指标和病理切片的结果来推测,绒毛诃子蓄积毒性的靶器官不如急性毒性明确,蓄积毒性不高,可能与小鼠的日常代谢有关,由于多次反复给药过程中毒性物质可能在体内有一定的降解,故一次性给药和多次反复给药的主要毒性靶器官可能有所不同。
诃子中的主要成分为鞣质类及酚酸类,包括没食子酸、没食子酰葡萄糖等。研究[11]发现,何首乌中没食子酸对肝细胞具有损伤作用,可能为何首乌致肝损伤的主要成分;吴宇等[12]采用细胞毒性筛选、高内涵技术探索没食子酸对HepaRG 肝细胞损伤的机理,它可有剂量依赖性地诱导细胞凋亡,并通过分子生物学技术筛选出11 个差异蛋白,集中在内质网的功能蛋白折叠加工方面。但诃子致肝毒性的物质基础及其作用机制尚不明确,需要作进一步的研究。
