隐丹参酮纳米结构脂质载体的制备及药动学研究
2020-04-29郝海军屈战果范明松
郝海军,屈战果,范明松
(上海雷允上药业有限公司技术中心,上海 201401)
隐丹参酮是从唇形科植物丹参Salvia miltiorrhizaBge.根及根茎中提取得到的一种脂溶性成分,属于二萜醌类化合物,具有抗炎、抗氧化、抗菌、抗肿瘤等活性[1-2],对神经系统疾病也有很好的疗效[3],但其体内吸收较差[4],不利于药效发挥。目前,有大量关于固体分散体[5]、微乳[6]、固体脂质纳米粒[7]、脂质体[8]等新制剂技术的报道,其中纳米结构脂质载体是从固体脂质纳米粒改良而来,具有较高的包封率及稳定性,可增加药物体内吸收及靶向性,延长药物体内滞留时间,提高药物生物利用度及药效[9]。本实验制备了隐丹参酮纳米结构脂质载体,并对其粒径、Zeta电位、包封率、载药量、体外溶出、药动学进行了考察,以期为相关研究提供更全面的数据。
1 材料
QUINTX224-1CM 型电子天平[赛多利斯(上海)贸易有限公司];Agilent 1260 型高效液相色谱仪(美国Agilent 公司);XW-80A 型涡旋混合器(安徽精科检测技术有限公司);WY-265G 型温控磁力搅拌器(杭州精卓设备有限责任公司);Master-sizer 型粒度分析仪(英国马尔文仪器有限公司);RCZ-8RCZ8 型智能溶出仪(上海五久自动化设备有限公司);FD10-QX 型真空冻干机(上海精密科学仪器有限公司);JXDC-400 型氮气吹扫仪[拓赫机电科技(上海)有限公司];JY92-III 型超声波细胞粉碎机(宁波新芝生物科技有限公司);Nanosep® 超滤离心管(相对分子质量10 000,美国Pall 公司)。
隐丹参酮(批号 110867-201607,纯度99.5%)、克拉霉素(批号1303056-201404,纯度99.6%)对照品(中国食品药品检定研究院);隐丹参酮对照品(批号170216S,纯度>98%,上海源叶生物科技有限公司);中链脂肪酸(批号B50845)、大豆卵磷脂(批号W171124S)(上海辅必成医药科技有限公司);山嵛酸甘油酯(批号158855,上海嘉法狮贸易有限公司);泊洛沙姆188(批号WPE1566D,德国巴斯夫公司)。
清洁级SD 大鼠,体质量(300±20)g,购自河南省实验动物中心,实验动物生产许可证号SCXK(豫)2016-0001。
2 方法与结果
2.1 隐丹参酮纳米结构脂质载体制备 采用高压均质法。称取山嵛酸甘油酯1.2 g、中链脂肪酸0.4 g 于圆底烧瓶中,75 ℃下加热至熔融状态,加入75 mg 隐丹参酮后磁力搅拌(1 000 r/min)至全部溶解,作为油相;称取PVP K30 0.3 g、大豆磷脂0.2 g,溶于50 mL 蒸馏水中,加热至75 ℃,作为水相。在1 000 r/min 搅拌速度下将水相匀速滴入油相中,滴加完毕后继续搅拌浓缩60 min 形成初乳(体积约为40 mL),在80 MPa 压力下循环均质8 次后立即低温固化,即得。同法制备不含隐丹参酮的空白纳米结构脂质载体。
2.2 粒径、Zeta 电位测定 取隐丹参酮纳米结构脂质载体0.1 mL,加入5 mL 超纯水稀释,取适量测定粒径、Zeta 电位,结果见图1~2,可知平均粒径为(175.26±6.07)nm,PDI 为0.068±0.009,Zeta 电位为(-34.2±3.4)mV。
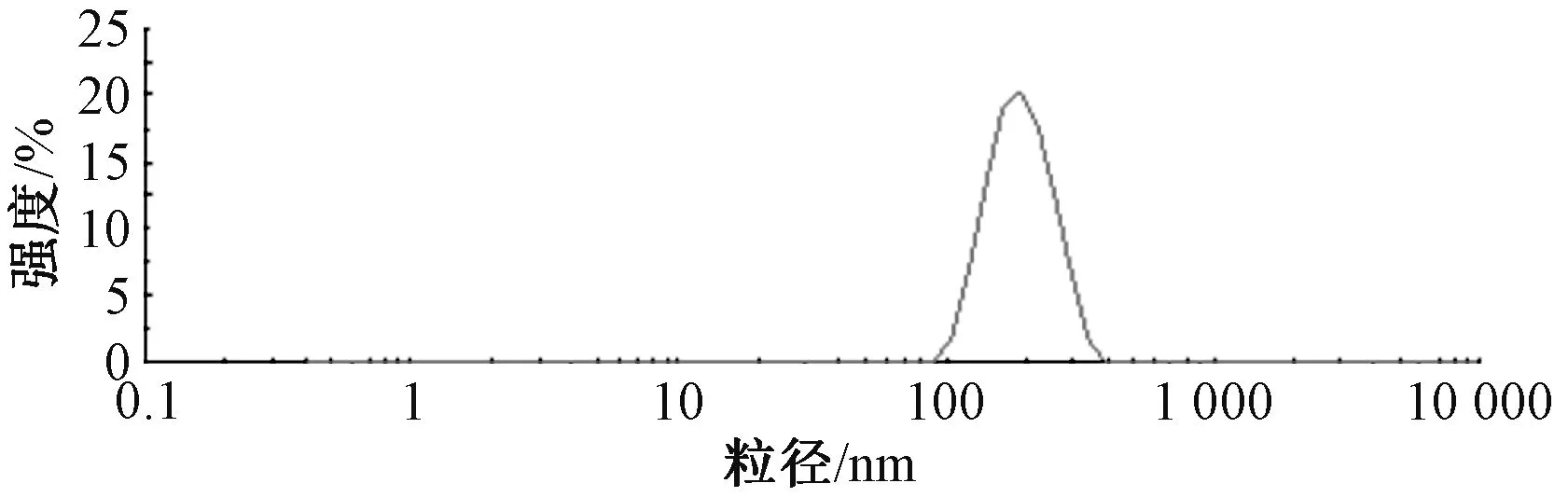
图1 隐丹参酮纳米结构脂质载体粒径分布Fig.1 Particle size distribution of nanostructured lipid carries of cryptotanshinone

图2 隐丹参酮纳米结构脂质载体Zeta 电位Fig.2 Zeta potential of nanostructured lipid carries of cryptotanshinone
2.3 隐丹参酮含有量测定
2.3.1 色谱条件 Waters C18色谱柱(250 mm×4.6 mm,5 μm);流动相甲醇-0.6% 甲酸(70∶30);体积流量1.0 mL/min;柱温30 ℃;检测波长271 nm;进样量20 μL。
2.3.2 线性关系考察 精密称取48.80 mg 隐丹参酮对照品,溶于25 mL 乙腈中,得1.952 mg/mL贮备液,精密量取1.0 mL 至20 mL量瓶中,流动相定容至97.6 μg/mL 后逐步 稀释至0.488、0.976、9.76、24.4、48.8、97.6 μg/mL,在“2.3.1”项色谱条件下进样测定。以溶液质量浓度为横坐标(X),峰面积为纵坐标(Y)进行回归,得方程为Y=0.530 6X-0.481 4(r=0.999 9),在0.488~97.6 μg/mL 范围内线性关系较好。
2.3.3 供试品溶液制备 取2.0 mL 隐丹参酮纳米结构脂质载体至25 mL 量瓶中,甲醇超声处理后定容,8 000 r/min 离心30 min,取2.5 mL 上清液至5 mL 量瓶中,流动相定容至刻度,即得。
2.3.4 方法学考察
2.3.4.1 精密度试验 取0.488、24.4、97.6 μg/mL对照品溶液,在“2.3.1”项色谱条件下进样测定,测得3 种质量浓度溶液中隐丹参酮峰面积RSD分别为0.82%、0.61%、0.18%,表明仪器精密度良好。
2.3.4.2 重复性试验 取同一批隐丹参纳米结构脂质载体混悬液,按“2.3.2”项下方法处理后平行制备6 份供试品溶液,在“2.3.1”项色谱条件下进样测定,测得隐丹参酮峰面积RSD 为0.66%,表明该方法重复性较好。
2.3.4.3 稳定性试验 取同一批隐丹参纳米结构脂质载体混悬液,按“2.3.2”项下方法处理后制备供试品溶液,于0、2、4、8、12、24、48 h 在“2.3.1”项色谱条件下进样测定,测得隐丹参酮峰面积RSD 为0.83%,表明溶液在48 h 内稳定性良好。
2.3.4.4 加样回收率试验 取1.952 mg/mL 隐丹参酮对照品溶液9.0 mL 至10 mL 量瓶中,流动相定容至1.757 mg/mL。取9 份空白纳米结构脂质载体混悬液,每份2.0 mL,置于9 个25 mL 量瓶中,加入上述1.757 mg/mL 溶液1.0、2.0、3.0 mL,平行3 份,甲醇超声处理后定容,8 000 r/min 离心30 min,取2.5 mL 上清液至5 mL 量瓶中,流动相定容至刻度,在“2.3.1”项色谱条件下进样测定,计算回收率。结果,隐丹参酮平均加样回收率分别为98.81%、97.19%、98.05%,RSD 分别为0.69%、0.93%、0.67%。
2.4 载药量、包封率测定 采用低温超滤离心法。按“2.3.3”项下方法制备供试品溶液,在“2.3.1”项色谱条件下进样测定,计算隐丹参酮总含有量(m总);精密量取2.0 mL 隐丹参酮纳米结构脂质载体混悬液至超滤离心管中,平行制备2份,12 500 r/min 离心60 min,合并续滤液后精密量取2 mL 至50 mL 量瓶中,流动相定容至刻度,在“2.3.1”项色谱条件下进样测定,计算游离隐丹参酮含有量(m游离),再测定载药量、包封率,公式分别为载药量=[(m总-m游离)/(m总+m脂质)]×100%、包封率=[(m总-m游离)/m总]×100%(m脂质为隐丹参酮脂质总用量)。结果,3 批隐丹参酮纳米结构脂质载体平均包封率为(87.69±1.97)%,载药量为(3.75±0.38)%。
2.5 体外释药研究 采用透析袋法。量取隐丹参酮纳米结构脂质载体、隐丹参酮原料药(空白溶出介质配制,含有量与纳米结构脂质载体相同,均为9.1 mg)各5 mL,置于透析袋中(截留分子质量8 000~14 000 Da),两端扎紧,设定转速100 r/min,温度(37±1)℃,溶出介质1.0% SDS溶液,于0、0.25、0.5、0.75、1、2、4、8、12、18、24、30、36 h 各取样2 mL,并及时补充等量溶出介质,按1∶1 比例加入甲醇破乳后HPLC 法测定隐丹参酮含有量,绘制释药曲线,结果见图3。由此可知,在释药初期隐丹参酮纳米结构脂质载体有一定突释现象,之后是缓慢释药期;36 h内累积释放度为64.13%,与原料药相比具有明显缓释特征。
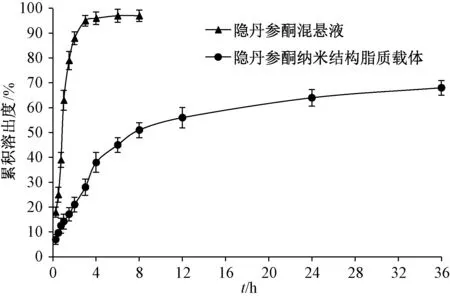
图3 样品体外释药曲线Fig.3 In vitro drug release curves for samples
2.6 体内药动学研究
2.6.1 灌胃液质量浓度确定 经测定,隐丹参酮纳米混悬剂质量浓度为1.82 mg/mL。因此,本实验另选空白纳米混悬剂,制成相同质量浓度的混悬液。
2.6.2 分组、给药及血浆样品采集 取清洁级SD大鼠12 只,随机分为隐丹参酮组和隐丹参酮纳米结构脂质载体组,灌胃给药,剂量以隐丹参酮计为15 mg/kg。大鼠乙醚麻醉后,于0.167、0.5、1、1.25、1.5、2、2.5、3、4、8、12 h 眼眶后静脉丛采血各约0.3 mL,引流至肝素化的离心管中,眼眶棉球止血,血样2 500 r/min 离心2 min,200 μL移液枪分离上层血浆,置于-20 ℃冰箱中。
2.6.3 血浆样品处理 参考文献[10]报道方法。取内标溶液40 μL、血浆样品100 μL、甲醇3 mL至离心管中,涡旋混匀3 min 后5 000 r/min离心10 min,分离上层有机相至空白离心管中,调节氮气体积流量,在45 ℃下缓慢吹除提取液中的有机溶剂,100 μL 流动相复溶残渣,5 000 r/min离心5 min。
2.6.4 线性关系考察 取“2.3.2”项下贮备液,甲醇依次稀释至 24.4、48.8、122.0、244.0、488.0、976.0 μg/L,作为对照品溶液,各精密量取0.5 mL,45 ℃下缓慢吹干,加入0.5 mL SD 大鼠空白血浆溶解;精密称取克拉霉素对照品10 mg,溶于10 mL 甲醇中(1.0 mg/mL),甲醇稀释至100 μg/L,作为内标溶液,按“2.6.3”项下方法处理,在“2.3.1”项色谱条件下进样测定。以隐丹参酮与内标峰面积之比为纵坐标(Y),溶液质量浓度为横坐标(X)进行回归,得方程为Y=0.060 1X+0.005 2(r=0.991 9),在24.4~976.0 μg/L范围内线性关系较好。
2.6.5 方法学考察 取空白血浆、空白血浆加对照品与内标、给药后血浆样品与内标,在“2.3.1”项色谱条件下进样测定,发现内源性物质不干扰隐丹参酮、内标测定,两者保留时间分别为6.6、7.8 min,表明该方法专属性良好。取24.4、244.0、976.0 μg/L 血浆对照品溶液,同一天内在“2.3.1”项色谱条件下进样测定6 次,测得隐丹参酮峰面积RSD 分别为2.14%、1.53%、0.98%,表明该方法日内精密度良好;取上述相同质量浓度血浆对照品溶液,每天测定1 次,连续6 d,测得隐丹参酮峰面积RSD 分别为10.53%、4.69%、4.04%,表明该方法日间精密度良好。取隐丹参酮给药1.0 h 时血药样品,室温下放置72 h,测得隐丹参酮峰面积RSD 为10.86%,表明血浆样品在72 h 内稳定性良好。取“2.6.4”项下24.4、244.0、976.0 μg/L 对照品溶液各1.0 mL,氮气吹干得残渣,加入1.0 mL 空白血浆重新溶解,按“2.6.3”项下方法处理,在“2.3.1”项色谱条件下进样测定,测得隐丹参酮加样回收率为83.44%~92.68%。
2.6.6 分析结果 以取血时间为横坐标,血药浓度为纵坐标,绘制血药浓度-时间曲线,结果见图4;通过DAS2.0 软件计算主要药动学参数,体内过程按照二室开放模型计算,结果见表1。由此可知,隐丹参酮制成纳米结构脂质载体后可延长tmax、t1/2(P<0.05),升高Cmax、AUC0~t、AUC0~∞(P<0.01),相对生物利用提高到226.06%。

图4 样品血药浓度-时间曲线Fig.4 Plasma concentration-time curves for samples
表1 样品主要药动学参数(±s,n=6)Tab.1 Main pharmacokinetic parameters for samples(±s,n=6)

表1 样品主要药动学参数(±s,n=6)Tab.1 Main pharmacokinetic parameters for samples(±s,n=6)
注:与隐丹参酮比较,∗P<0.05,∗∗P<0.01。
3 讨论
将游离药物与纳米药物分开的难度较大,而且两者之间存在动态平衡,分离前者时可能会造成后者不稳定[10],故本实验未对其进行分离。隐丹参酮纳米结构脂质载体在体外释药初期具有突释现象,一方面是由于存在游离药物,另一方面也与吸附在其表面的药物有关。有报道[9]认为,部分纳米结构脂质载体低温固化时固态脂质先形成内核,而溶有药物的液态脂质包裹在内核外部,从而导致突释。另外,体外释药过程的缓释特征可能是由于溶有药物的液态脂质打乱了固体脂质的晶格,使包裹于后者的药物溶出受阻。
隐丹参酮生物利用度较低,除了水溶性较差的原因外[5],还与透膜吸收能力有限[11]、存在肝脏首过效应[4]等因素有关。药动学研究显示,将隐丹参酮制成纳米结构脂质载体后tmax、t1/2、Cmax、AUC0~t、AUC0~∞均显著升高,相对生物利用提高到226.06%,可有助于降低给药量,提高药效,其中tmax延后,可能与纳米结构脂质载体缓释特征有关;t1/2延长,表明纳米结构脂质载体可增加药物体内滞留时间;Cmax提高,说明纳米结构脂质载体可促进药物体内吸收[12-13]。由于药物体内滞留时间延长,纳米级以下粒径的药物与胃肠道的接触面积也大幅增加,有利于纳米结构脂质载体经细胞间转运、淋巴转运等途径进入血液循环,降低首过效应,提高生物利用度[13-15]。
此外,纳米结构脂质载体中的脂质可抑制P糖蛋白等介导的药物外排作用[16],促进乳糜微粒产生,从而增加淋巴转运途径。上官明珠[16]报道,部分纳米结构脂质载体进入肠道后,被胰酶降解成甘油酯和脂肪酸,并释放出药物,随后降解产物、内源性胆盐、药物等重新形成混合胶束或胶束,从而更容易通过小肠上皮静态水层,促进药物经小肠吸收。但纳米药物口服后,经胃肠道吸收进入血液循环的过程受到纳米制剂稳定性、胃肠壁亲水性黏液层阻挡、网状内皮系统中单核巨噬细胞吞噬等因素的影响[17],最终使其生物利用度提高程度受到一定限制,而且差别也较大[18]。今后,可考虑对隐丹参酮纳米结构脂质载体进行表面修饰等方面的研究[17],以期进一步提高生物利用度。
