不同浓度脱脂牛血清白蛋白对人外周血单个核细胞NLRP3炎症通路相关蛋白表达的影响
2020-04-29童晓霞周京国
童晓霞,周京国
1南充市中心医院,四川南充637000;2成都医学院附属第一医院
牛血清白蛋白(BSA)是研究高分子蛋白质的体内代谢、生物学功能、临床应用等的理想蛋白质[1],还可作为脂肪酸、金属离子、有机小分子燃料、代谢物及各类药物的运载体,并用于细胞培养。BSA存在固有免疫反应性,经BSA处理的人脂肪细胞中IL-6、IL-8、TNF-α表达增加[2]。在研究脂肪酸与NOD样受体蛋白3(NLRP3)炎性体信号通路时,作为脂肪酸运载体的脱脂BSA是否对NLRP3炎症通路中NLRP3、凋亡相关斑点样蛋白(ASC)、半胱氨酸的天冬氨酸蛋白水解酶1(Caspase-1)、白细胞介素1β(IL-1β)基因表达有影响,目前仍不明确。本研究观察了不同浓度脱脂BSA对人外周血单个核细胞(PBMCs)中NLRP3、ASC、Caspase-1、IL-1β mRNA表达的影响,现报告如下。
1 材料与方法
1.1 标本来源 选择2018年10~12月在川北医学院附属医院体检中心体检的30例健康体检者,男16例、女14例,年龄18~50岁,体质量指数18.5~23.9 kg/m2。采集受试者空腹外周静脉血28 mL,肝素钠抗凝,绿色生化管分成4 mL/管,共7管。
1.2 脱脂BSA溶液的配制 称取适量脱脂BSA(纯度>99%),加入PBS充分溶解、混匀,经0.22 μm的滤膜过滤除菌,-20 ℃保存备用。
1.3 外周血标本分组与脱脂BSA干预 将外周血标本分为BSA组及空白对照组。BSA组加入PBS稀释的脱脂BSA溶液,使其终浓度分别为0.312 5%、0.625%、1.25%、2.5%、5%、10%;空白对照组加入等量PBS。置于37 ℃、5% CO2培养箱中孵育6 h。然后3 000 r/min离心5 min,分离血浆,血细胞加入人淋巴细胞分离液,提取PBMCs。
1.4 PBMCs中NLRP3、ASC、Caspase-1、IL-1β mRNA表达检测 采用qRT-PCR法。相关基因引物序列见表1。以β-actin为内参,采用2-ΔΔCt表示目的基因的相对表达量。
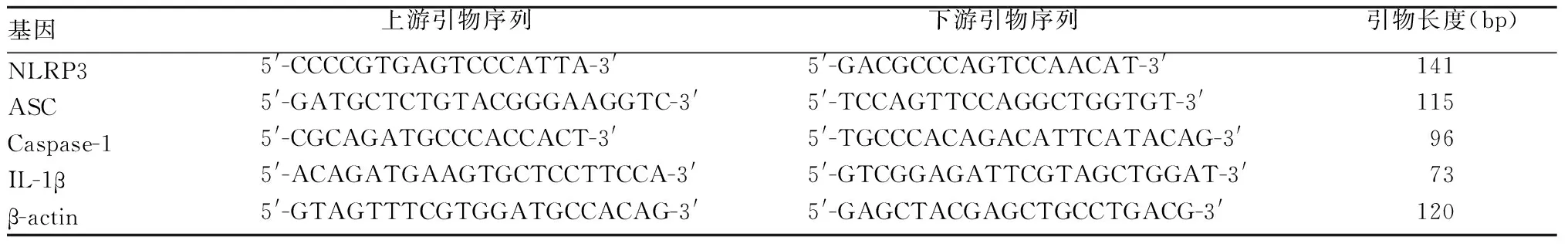
表1 NLRP3、ASC、Caspase-1、IL-1β mRNA及内参引物序列
2 结果
BSA组加入1.25%、2.5%、5%、10%脱脂BSA后,IL-1β mRNA相对表达量高于空白对照组(P均<0.05)。BSA组加入1.25%、2.5%、5%、10%脱脂BSA后,ASC mRNA相对表达量低于空白对照组(P均<0.05)。BSA组NLRP3、Caspase-1 mRNA与空白对照组比较差异均无统计学意义(P均>0.05)。详见表1。
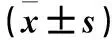
表1 各组IL-1β、ASC、NLRP3、Caspase-1 mRNA表达比较
注:与空白对照组比较,*P<0.05。
3 讨论
BSA广泛用于生化实验中,如Western blotting实验、PCR实验[6]。在动物细胞无血清培养液中添加BSA可起到维持渗透压和pH缓冲、载体及营养作用[7]。BSA存在固有免疫反应性,BSA的构象和线性表位是过敏反应的有效诱导剂[8]。研究显示,BSA表位能够被来自致敏受试者的致敏IgE完全识别,并且能够诱导T细胞增殖[8,9]。Ding等[10]研究表明,BSA可直接激活人肾小管上皮HK2细胞中的NLRP3炎性体;BSA过载可诱导蛋白尿和显著的肾小管间质炎症,表现为CD20+细胞(B淋巴细胞)、CD3+细胞(T淋巴细胞)、CD68+细胞(巨噬细胞)浸润。BSA过载显著增加近端小管上皮细胞和炎症细胞中NLRP3、Caspase-1、IL-1β、IL-18表达。
NLRP3是NLRP亚家族的典型代表,当NLRP3的富含亮氨酸的重复序列(LRR)结构域与其配体结合后使处于自我抑制、无活性状态的NLRP3发生构象变化,暴露出NACHT结构域(又称NOD结构域),通过ATP聚合形成高度有序的NLRP3蛋白寡聚体,并募集ASC及半胱天冬酶1酶原(Pro-Caspase-1)形成NLRP3炎性体。NLRP3炎性体激活Pro-Caspase-1产生活化的Caspase-1,活化的Caspase-1能将胞内不具活性的IL-1β前体形成活化的成熟IL-1β分泌到胞外,产生炎症和免疫反应[11]。
NLRP3炎性体可以被多种外源性病原相关分子模式(如病毒、细菌、真菌等)及内源性损伤相关分子模式(如胞外ATP、UA等)通过不同途径激活,但其激活机制尚不清楚[12]。目前多数研究认为,各种体内外的刺激因素可以通过细胞内钾离子外流、溶酶体膜破裂后组织蛋白酶B释放、活性氧产生这3种模式激活NLRP3炎性体[13]。BSA作为一种白蛋白,可以通过激活肾小管上皮细胞内的NLRP3炎性体,活化Caspase-1,释放IL-1β和IL-18,引起肾小管间质炎症反应[14]。丁丽红等[15]报道,白蛋白可激活肾小管上皮细胞NLRP3炎性体,促进IL-1β mRNA及IL-1β蛋白表达增加,其机制可能与组织蛋白酶B释放和活性氧生成有关。
本研究结果显示,一定浓度的脱脂BSA刺激PBMCs,能够上调IL-1β mRNA表达、下调ASC mRNA表达,而同样浓度的脱脂BSA对NLRP3、Caspase-1 mRNA表达无明显影响。这提示脱脂BSA刺激PBMCs可能激活了NLRP3炎性体,引起IL-1β mRNA表达上调,但其具体激活机制尚不明确。ASC mRNA表达下调以及NLRP3、Caspase-1 mRNA表达未见影响,可能与刺激6 h后启动了机体内的负性调控机制有关,如miR-223对NLRP3的负性调控[16]。自噬在NLRP3炎性体激活中也起关键作用。自噬作为NLRP3炎性体激活的负调节因素通过各种机制起作用,包括通过去除内源性NLRP3炎性体激动剂的来源直接抑制NLRP3炎性体激活和选择性降解炎性体成分。此外,TNF-α诱导的蛋白3是一种NF-κB信号转导抑制剂,可作为NLRP3激活和Caspase-1加工的负调节因子;芳烃受体与NLRP3启动子中的外源性反应元件结合并抑制NLRP3转录;NO和3,4-亚甲二氧基-β-硝基苯乙烯通过靶向NLRP3复合体抑制ASC的形成[17]。
本研究显示1.25%~10%的脱脂BSA刺激人外周血PBMCs 6 h能够上调细胞中IL-1β mRNA表达、下调ASC mRNA表达。在实验中使用脱脂BSA时,需排除脱脂BSA本身对细胞中上述基因表达的影响,避免研究结果的偏差。
