SLAMF7在大颗粒淋巴细胞白血病患者外周血淋巴细胞中的表达及意义
2020-04-29康萍蒋茜毛朝明刘佳梦丁超董利阳
康萍,蒋茜,毛朝明,刘佳梦,丁超,董利阳
江苏大学附属医院,江苏镇江212001
大颗粒性淋巴细胞白血病(LGLL)是一种罕见的慢性成熟淋巴细胞增殖性疾病,其特征是原因不明的CD3+T/CD3-NK细胞的单克隆增殖[1]。大颗粒淋巴细胞的形态特征为胞体变大,细胞核肾型或者半圆型,胞质增多,内含有丰富的嗜天青颗粒[2]。通常,形态学上难以区分病理性单克隆增殖的大颗粒淋巴细胞和生理反应性多克隆增殖的大颗粒淋巴细胞[3,4]。LGLL的临床诊断复杂且费时,没有标准、有效的治疗方案,因此需要寻找新的免疫标志物协助快速诊断及治疗。信号淋巴细胞活化分子家族7(SLAMF7)是一种糖基化的细胞表面蛋白,是信号淋巴细胞活化分子(SLAM)家族的成员[5]。SLAMF7除了在正常的NK细胞、部分T细胞亚群、活化的B细胞、浆细胞表达外,还表达在一些造血系统肿瘤细胞中[6]。越来越多的研究表明,SLAMF7在多种疾病中发挥重要作用,抗SLAMF7的单克隆抗体埃罗妥珠单抗(Elotuzumab)已成功用于多发性骨髓瘤的临床治疗[7],而关于SLAMF7和LGLL的研究较少。2015年3月~2019年8月,本研究观察了LGLL患者外周血淋巴细胞中SLAMF7的表达,及其与嗜天青大颗粒主要成分颗粒酶B(Granzyme B)和穿孔素(Perforin)表达水平的相关性,为寻找LGLL新的诊断指标及治疗靶点提供理论依据。
1 资料与方法
1.1 临床资料 选取2015年3月~2019年8月就诊于江苏大学附属医院的LGLL患者9例(病例组)进入研究,男7例、女2例,年龄52~69岁,T大颗粒淋巴细胞白血病(T-LGLL)6例、NK大颗粒淋巴细胞白血病(NK-LGLL)3例。患者均符合LGLL的诊断标准[8],至少满足以下3个条件:①血液中存在大颗粒淋巴细胞(>500/μL)长于6个月,或大颗粒淋巴细胞数目较低但为单克隆性,且患者表现出其他典型的临床或血液学特征,如类风湿关节炎或细胞减少症;②具有典型的免疫表型,如T-LGLL典型免疫表型为CD3+CD8+CD57+,NK-LGLL为CD3-CD8+CD16+CD56+;③PCR或流式细胞术分析T细胞受体(TCR)基因重排确认T细胞克隆性,杀伤性免疫球蛋白样受体(KILR)激活亚型限制性表达表示NK细胞单克隆扩增[9,10]。同时招募15例年龄、性别相匹配且无造血系统疾病、无自身免疫性疾病和活动性感染的健康志愿者作为对照组。本研究获得江苏大学附属医院伦理委员会的批准,患者均对研究方案知情同意。
1.2 病例组和对照组外周血淋巴细胞中SLAMF7检测 取两组EDTA-K2抗凝的外周全血100 μL,用PerCp Cy5.5偶联抗人CD3抗体、FITC偶联CD8抗体、PE偶联SLAMF7抗体、BV510偶联抗人CD45抗体、BV421偶联抗CD56抗体及Alexa Fluor 647偶联抗人SLAMF7抗体、APC efluor 780偶联FVD抗体染色(用于标记死亡细胞),加入1 mL稀释后的红细胞裂解液静置10 min,离心去上清以去除红细胞后,用PBS洗涤2次,用400 μL的PBS重悬,上FACS Caliber流式细胞仪检测。以CD45/SSC-A设门筛选出活淋巴细胞,进一步筛选细胞毒性T细胞(CD3+CD8+)和NK细胞(CD3-CD56+)后,分析SLAMF7阳性细胞。采用FlowJo10.1软件进行数据分析。每组样本重复检测3次,取均值。
1.3 病例组与对照组淋巴细胞形态观察 取两组EDTA-K2抗凝的外周血以制作头、体、尾分明的血涂片若干张,自然干燥后,滴加5滴瑞氏-吉姆萨染液1 min后滴加10滴pH 6.4的PBS轻轻晃动载玻片,室温静置15 min,流水冲去多余染液,干燥后于显微镜下观察淋巴细胞形态。
1.4 病例组大颗粒淋巴细胞Granzyme B、Perforin检测 取病例组EDTA-K2抗凝的外周血100 μL,以“1.2”步骤进行表面抗体染色后,按照说明书进行细胞内Granzyme B、Perforin染色,流式细胞仪检测Granzyme B、Perforin阳性细胞,每组样本重复检测3次,取均值。
1.5 慢性活化淋巴细胞模型制作及SLAMF7表达观察 取对照组EDTA-K2抗凝的外周血10 mL,利用Ficoll密度梯度离心法从人淋巴细胞分离液提取外周血单个核细胞(PBMC),用含10%胎牛血清的1640培养基将PBMC浓度调整为1×106/mL。根据预实验结果,选择0.5 μg/mL的植物血凝素(PHA)制作慢性活化淋巴细胞模型。将1×106个PBMC接种于24孔板,加入含0.5 μg/mL PHA、100 U/mL IL-2的无血清培养基750 μL,分别于培养0、24、48、72 h收集细胞,参照“1.2”方法,采用流式细胞术检测CD4+T细胞、CD8+T细胞中SLAMF7表达及CD4/CD8比例,FlowJo10.1软件分析结果。每组样本重复检测3次。
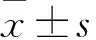
2 结果
2.1 两组外周血淋巴细胞中SLAMF7表达比较 病例组T-LGLL患者、对照组CD8+T细胞中SLAMF7阳性表达率分别为99.55%±0.16%、65.75%±9.00%,病例组T-LGLL患者CD8+T细胞中SLAMF7阳性表达率高于对照组(P<0.05);病例组NK-LGLL患者、对照组NK细胞中SLAMF7阳性表达率分别为98.63%±0.32%、99.13%±0.59%,两组相比,P>0.05。
2.2 两组淋巴细胞形态特点及SLAMF7与嗜天青颗粒表达的关系 与正常淋巴细胞相比,大颗粒淋巴细胞体积变大、胞质增多、细胞核大且不规则,其中可见多少不等的核仁,轻微嗜碱性胞质中出现大小不等的嗜天青大颗粒(图1)。大颗粒淋巴细胞中SLAMF7阳性表达率为98.60%±0.50%、Granzyme B+Perforin阳性表达率为90.92%±0.90%,Pearson相关分析显示,SLAMF7阳性表达与Granzyme B+Perforin阳性表达呈正相关(r=0.818,P<0.05)。

图1 病例组大颗粒淋巴细胞形态(瑞氏-吉姆萨染色)
2.3 PHA刺激后CD4+T细胞、CD8+T细胞中SLAMF7表达及CD4/CD8比例变化 0.5 μg/mL的PHA刺激3 d后,CD4/CD8比例无明显变化,0、24、48、72 h分别为1.356±0.01、1.407±0.03、1.290±0.02、1.270±0.02(P均>0.05)。0.5 μg/mL的PHA刺激0、24、48、72 h后CD4+T细胞中SLAMF7阳性表达率分别为29.40%±1.20%、52.70%±3.90%、79.40%±0.20%、51.80%±3.50%,CD8+T细胞中SLAMF7阳性表达率分别为49.93%±2.59%、72.47%±2.28%、98.73%±0.64%、99.17%±0.43%。CD4+T细胞中SLAMF7阳性表达率在PHA刺激24 h后上调,48 h时达峰值,72 h时有所降低(P均<0.05);CD8+T细胞中SLAMF7阳性表达率从刺激24 h后逐渐升高,48 h达峰值,72 h仍维持高值(P均<0.05);低浓度PHA持续刺激3 d后,CD8+T细胞中SLAMF7阳性表达率高于CD4+T细胞(P均<0.05)。
3 讨论
2002年WHO将LGLL分为T-LGLL和NK-LGLL,2008年又根据临床表现将后者分为侵袭性大颗粒淋巴细胞白血病(ANKL)和慢性NK细胞淋巴增殖性疾病(CLPD-NK),并沿用至今[11,12]。T-LGLL作为最常见的LGLL(>75%),临床表现多为无症状或进展缓慢,中位生存期可达10年,但近年来不断有侵袭性T-LGLL的病例报道,多与NK细胞相关抗原的表达有关(如CD56)。NK-LGLL相对罕见(<15%),CLPD-NK(<10%)临床表现与T-LGLL相似,二者治疗方案多采取随访观察,必要时予以对症治疗[13,14]。在实际临床工作中,从形态学上难以区分病理性的单克隆大颗粒淋巴细胞和生理反应性的多克隆大颗粒淋巴细胞。LGLL的诊断需结合临床表现、细胞形态学、免疫表型、分子遗传学指标,诊断过程复杂且费时,治疗方案多参考少量的回顾性分析。因此,需要寻找新的免疫标志物以协助该病的快速诊断及治疗。
SLAMF7是免疫球蛋白超家族受体CD2家族的一员,能够活化其胞内基于免疫受体酪氨酸的开关基序(ITSMs),招募EAT-2调节淋巴细胞的免疫功能[6]。对SLAMF7的研究主要集中在多发性骨髓瘤(MM)的治疗方面,人源化的抗SLAMF7单克隆抗体Elotuzumab可通过直接激活NK细胞、增强抗体依赖的细胞介导的细胞毒性(ADCC)、阻断可溶性SLAMF7(sSLAMF7)与MM细胞上SLAMF7间的相互作用这三种途径清除肿瘤细胞[15,16]。但目前尚无关于SLAMF7和LGLL的研究。本研究发现,SLAMF7在T-LGLL患者的CD3+CD8+大颗粒T细胞中明显高表达;虽然在NK-LGLL大颗粒淋巴细胞中SLAMF7也呈强表达,但与正常NK细胞表达差异无统计学意义。大颗粒淋巴细胞的特征是胞质中出现多少不等的嗜天青颗粒,其中最主要的成分包括Perforin和Granzyme B,而Perforin和Granzyme B主要存在于细胞毒性T淋巴细胞和NK细胞中,是宿主细胞杀伤靶细胞的主要效应分子[17]。在NK细胞中,SLAMF7活化后,通过一系列途径导致Ca2+内流增强、MAPK/ERK通路激活,最终导致NK细胞中颗粒极化、促进细胞毒颗粒向靶细胞释放[18],因此,推测SLAMF7可能参与大颗粒淋巴细胞中嗜天青颗粒的形成。我们对患者的血涂片进行瑞氏-吉姆萨染色,镜检显示肿瘤细胞为胞质中颗粒增多的大淋巴细胞;相关性分析表明,大颗粒淋巴细胞中SLAMF7阳性表达与Perforin+Granzyme B阳性表达呈正相关,间接表明SLAMF7与白血病细胞中的大颗粒有关。有学者发现,系统性红斑狼疮患者外周血中Perforin+Granzyme B的表达仅限于SLAMF7+CD8+T细胞,且SLAMF7活化能够增强CD8+T细胞的活性[19],这进一步支持了我们的推测。
至今,LGLL的发病原因仍不清楚,但多数学者认为是由未知抗原(细菌、病毒等)的慢性持续刺激导致淋巴细胞的异常活化与单克隆增殖[14]。我们利用低浓度的PHA持续刺激PBMC来模拟淋巴细胞慢性活化,并观察SLAMF7表达的变化。实验结果显示,在相同刺激条件下,CD8+T细胞中SLAMF7阳性表达增加明显高于CD4+T细胞,且更稳定,这与我们在T-LGLL患者中观察到的SLAMF7在CD8+T细胞中高表达的现象相一致,由此推断SLAMF7可作为CD8+T细胞持续活化的指标。
综上,本研究发现,SLAMF7在LGLL大颗粒淋巴细胞中高表达,并与细胞中嗜天青大颗粒主要成分Perforin和Granzyme B的表达水平呈正相关,提示SLAMF7是细胞毒性淋巴细胞的特征标志,有望成为LGLL潜在的诊断指标及治疗靶点。由于LGLL发病率低,本研究样本量不足,在接下来的研究中,我们将扩大样本量进一步探讨SLAMF7在LGLL发生、发展中的作用。有研究表明SLAMF7能够诱导同样缺乏EAT-2的MM细胞的中枢生长和生存信号通路[20],推测SLAMF7本身参与了LGLL白血病性细胞的颗粒形成、凋亡或肿瘤细胞间同型黏附激活的生存通路的调节。本研究结果为LGLL新的诊断标志物或免疫治疗靶点的探索提供了理论依据。
