热打击诱导血管内皮细胞释放的外泌体特征及其功能分析
2020-04-28陈怀生张明梁泳欣施学智童华生苏磊
陈怀生,张明,梁泳欣,施学智,童华生*,苏磊
1深圳市人民医院重症医学科,广东深圳 518020;2广州医科大学第六附属医院/清远市人民医院重症医学科一区,广东清远 511500;3解放军南部战区总医院重症医学科/解放军热区损伤与组织修复重点实验室,广州 518020
既往研究发现,热浪与重症中暑病死率呈正相关[1]。随着极端气候的出现,重症中暑发病率呈现升高的趋势[2]。据不完全统计,我国中暑病死率为10%~15%,而重症中暑病死率更高。重症中暑常表现为中心体温升高超过40 ℃及以严重凝血功能障碍、中枢神经系统功能障碍为主的多脏器功能障碍综合征(multiple organ dysfunction syndrome,MODS)[3],而血管内皮细胞损伤在重症中暑凝血功能障碍的发生发展中起重要作用[4]:一方面血管内皮细胞损伤可促进炎性因子的释放,另一方面则启动凝血功能紊乱。两者相互影响,进而导致弥漫性血管内凝血(disseminated intra-vascular coagulation,DIC)及微血栓的形成,并进展为MODS[5]。近年来发现,旁分泌途径在炎症反应过程中扮演着重要角色。微小RNA(microRNA,miRNA)是一类长为19~25个核苷酸序列的内源性非编码单链小RNA[6],能够与靶基因的mRNA部分或完全互补配对结合,抑制mRNA翻译或促进mRNA降解,对多种靶基因的表达起调控作用,从而参与细胞的生物学过程[7]。血清中的miRNA主要存在于外泌体中。外泌体是一种细胞外囊泡,由细胞释放进入血清,发挥旁分泌作用。本研究分析人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)受热打击后释放的外泌体的特征及其对细胞生物行为的影响。
1 材料与方法
1.1 主要试剂及仪器 HUVECs购自中科院上海细胞中心;DMEM高糖培养基、青霉素和链霉素均购自美国Gibco公司;ZetaView纳米颗粒跟踪分析仪(ZetaView PMX 110)购自德国PMX公司;聚苯乙烯颗粒购自美国Sigma公司;CD63和TSG101一抗购自英国Abcam公司;CD63和TSG101二抗购自美国Proteintech公司;BD FACSCalibur流式细胞仪购自美国BD公司。
1.2 细胞培养及模型建立 HUVECs用含10%胎牛血清、10万U/L青霉素和100 mg/L链霉素的DMEM高糖培养基在37 ℃、5% CO2培养箱中培养。经过夜饥饿同步化处理后,将HUVECs分为对照组与热打击组。热打击组细胞给予41 ℃热刺激培养2 h,建立热打击细胞模型;对照组细胞于37 ℃孵育培养2 h。
1.3 外泌体特征鉴定
1.3.1 外泌体提取 在提取外泌体之前,先将细胞培养基更换为无血清培养基,并进行过夜饥饿处理。收集细胞培养液上清,500×g离心10 min,去除细胞沉淀;2000×g离心10 min,去除细胞碎片;用0.22 μm滤膜过滤,收集上清;100 000×g超速离心4 h,收集沉淀并用少量PBS重悬,100 000×g离心70 min,得到的沉淀即为外泌体。
1.3.2 纳米颗粒追踪分析法(NTA)检测外泌体的粒径及浓度 将外泌体样品用PBS稀释至(3~5)×107颗粒/ml,采用ZetaView纳米颗粒跟踪分析仪(ZetaView PMX 110)及直径110 nm的聚苯乙烯颗粒校准,用去离子水清洗样本池,将样品上机检测,检测温度为23 ℃,用ZetaView 8.04.02 SP2软件分析外泌体浓度及粒径分布。
1.3.3 Western blotting检测外泌体标志蛋白CD63和TSG101的表达 在外泌体样品中加入上样缓冲液,使蛋白变性,然后用10% SDS-PAGE分离(200 mA),2 h后转至PVDF膜上,脱脂奶粉室温封闭1 h;加入CD63和TSG101一抗(1:1000)4 ℃孵育过夜,5% TBST洗膜3次;加入二抗(1:3000)室温孵育1 h,5% TBST洗膜3次,采用化学发光液显色。
1.3.4 外泌体进入细胞情况观察 将适量Dil染料加入外泌体样品中,避光染色20 min;经外泌体染色滤柱去除多余染料,然后加入正常HUVECs中培养24 h,用4%甲醛固定,荧光显微镜下观察外泌体进入细胞的情况。
1.4 外泌体干预细胞实验 将细胞分为空白对照组、37 ℃外泌体处理组及41 ℃外泌体处理组。空白对照组细胞于37 ℃温育培养,37 ℃外泌体处理组细胞在培养过程中加入对照组细胞释放的外泌体共培养,41 ℃外泌体处理组细胞在培养过程中加入热打击组细胞释放的外泌体共培养,检测外泌体对细胞周期、细胞凋亡、细胞增殖及凝血功能指标的影响。
1.4.1 流式细胞仪检测细胞周期及凋亡情况 加入PBS制成细胞悬液,1000 r/min离心5 min,弃上清;加入70%乙醇2 ml,4 ℃下离心3 min,弃上清;加入含RNase A的PBS溶液(20 mg/ml) 500 ml,37 ℃下离心30 min,弃上清;加入含PI的PBS溶液(50 mg/ml) 500 ml,室温避光孵育30 min;吹打混匀,300目筛网过滤至流式管中,4 ℃保存,在流式细胞仪器中检测细胞周期并收集数据。
细胞悬液采用预冷的PBS液洗涤,加入300 ml 1×结合缓冲液悬浮细胞,5 ml Annexin V-FTTC与之混合均匀,室温下避光孵育15 min,加入5 ml PI染色液,5 min后,上机检测细胞凋亡情况。
1.4.2 MTS法检测细胞增殖情况 取对数生长期细胞,接种于96孔板中孵育过夜,吸尽培养液。每组设置3个复孔,分别培养24、48、72 h后,吸尽培养液,每孔加入100 μl CCK-8工作液(DMEM培养基:CCK-8=9:1),孵育60 min,用酶标仪检测490 nm波长处的吸光度(OD)值。
1.4.3 ELISA法检测组织因子(TF)、血管性血友病因子(vWF)、纤溶酶原激活物抑制因子1(PAI-1)和组织型纤维蛋白溶酶原激活剂(t-PA)的含量 收集细胞上清,按照ELISA试剂盒说明书步骤稀释标准品,设置空白孔、标准孔、待测样品孔,加样体系为100 μl,封板膜封板,室温孵育1 h,洗涤5次,拍干;加入酶标试剂100 μl/孔(空白孔除外),室温孵育1 h,洗涤5次,拍干;加入显色剂100 μl/孔,轻轻震荡混匀,室温避光显色15 min;加入终止液100 μl/孔,终止反应,用酶标仪测定490 nm波长处的OD值。
1.5 高通量测序分析外泌体中的miRNA 提取样品总RNA,用PAGE胶分离回收18~30 nt的小RNA。在5'接头连体系混匀离心,充分反应,用PAGE胶纯化回收5'连接产物;在3'接头连体系混匀离心,充分反应,用PAGE胶纯化回收3'连接产物,反转录成双链,通过PCR扩增,再用PAGE胶回收纯化。构建好的文库采用Agilent 2100 Bioanalyzer和ABI Step One Plus Real-Time PCR System Time进行质量和产量检测。将测序平台得到的原始数据进行质控和过滤,获得clean tags(原始序列数据去除杂质后获得的数据)。通过比对不同数据库对该tags进行注释(miRNA、rRNA、tRNA、snRNA、exon、intron等)。将匹配上基因组的tags进行新miRNAs预测,结合比对miRBase数据库中已知miRNA的定量分析、差异分析,以及基于差异miRNAs的后续分析(包括差异miRNAs的聚类分析、靶基因分析和靶基因的功能富集分析等)。
1.6 统计学处理 采用SPSS 17.0软件进行统计分析。计量资料以表示,多组间比较采用单因素方差分析,两组间比较采用Student-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 外泌体的特征 NTA检测结果显示,两组细胞释放的外泌体大小存在差异。对照组细胞释放的外泌体直径为150 nm,浓度为5.37×108颗粒/ml;热打击组细胞释放的外泌体直径为152 nm,浓度为5.34×108颗粒/ml(图1A)。Western blotting检测结果显示,与37 ℃热打击外泌体比较,41 ℃热打击HUVECs外泌体中标志蛋白CD63表达减少,TSG101表达增加(图1B)。将荧光染料标记的热打击组细胞释放的外泌体与正常细胞共孵育,可见外泌体进入细胞内(图1C)。
2.2 外泌体对细胞周期和凋亡的影响 流式细胞仪检测结果显示,37 ℃外泌体处理组细胞周期与空白对照组相似(图2A、B);41 ℃热打击HUVECs释放的外泌体增加了G2期的细胞数量(图2C)。37 ℃外泌体处理组细胞凋亡情况与空白对照组相似(图3A、B);41 ℃热打击HUVECs释放的外泌体能够促进细胞凋亡(图3C)。
2.3 外泌体对细胞增殖及对凝血功能指标的影响 MTS检测结果显示,与空白对照组和37 ℃外泌体处理组比较,41 ℃热打击HUVECs释放的外泌体明显抑制了正常细胞的增殖活性(P<0.05,图4A)。与空白对照组比较,37 ℃外泌体处理组TF、vWF、PAI-1的表达增加,t-PA表达降低(P<0.05);与37 ℃外泌体处理组比较,41 ℃外泌体处理组TF、vWF、PAI-1的表达明显增加,t-PA表达明显降低(P<0.01,图4B)。
2.4 外泌体中miRNA分析 高通量测序结果显示,与37 ℃孵育HUVECs比较,41 ℃热打击HUVECs释放的外泌体共出现2590条miRNA调节变化。差异miRNAs的聚类分析结果显示,37 ℃孵育与41 ℃热打击HUVECs释放的外泌体中miRNAs的表达存在明显差异,其中表达量及表达差异最高的miRNA热图如图5A所示。与37 ℃孵育HUVECs释放的外泌体比较,41 ℃热打击后HUVECs释放的外泌体中经测序共发现2002条表达上调的miRNA和588条表达下调的miRNA,其中有493条上调的miRNA与412条下调的miRNA,其差异具有统计学意义(P<0.05),其中60条miRNA的上调和下调具有1倍以上的倍数关系。miRNA靶基因GO和Pathway分析结果显示,41 ℃热打击HUVECs释放的外泌体中miRNA与凋亡相关通路有关,并结合泛素样蛋白、泛素蛋白等(图5B、C)。
3 讨 论
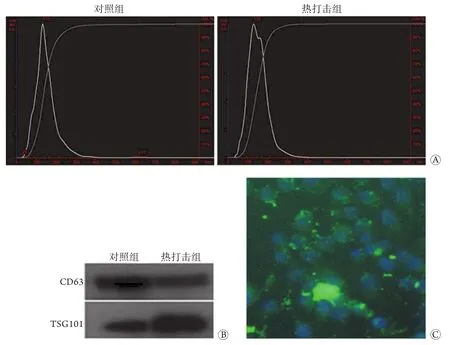
图1 人脐静脉内皮细胞释放的外泌体的特征鉴定Fig.1 Characterization of exosomes

图2 人脐静脉内皮细胞释放的外泌体对细胞周期的影响Fig.2 Effect of exosomes on HUVECs cell cycle
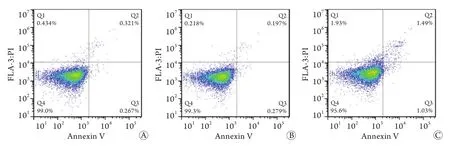
图3 人脐静脉内皮细胞释放的外泌体对细胞凋亡的影响Fig.3 Effect of exosomes on HUVECs apoptosis

图4 人脐静脉内皮细胞释放的外泌体对细胞增殖及凝血功能指标的影响Fig.4 Effects of exosomes on the proliferation and coagulation of HUVECs
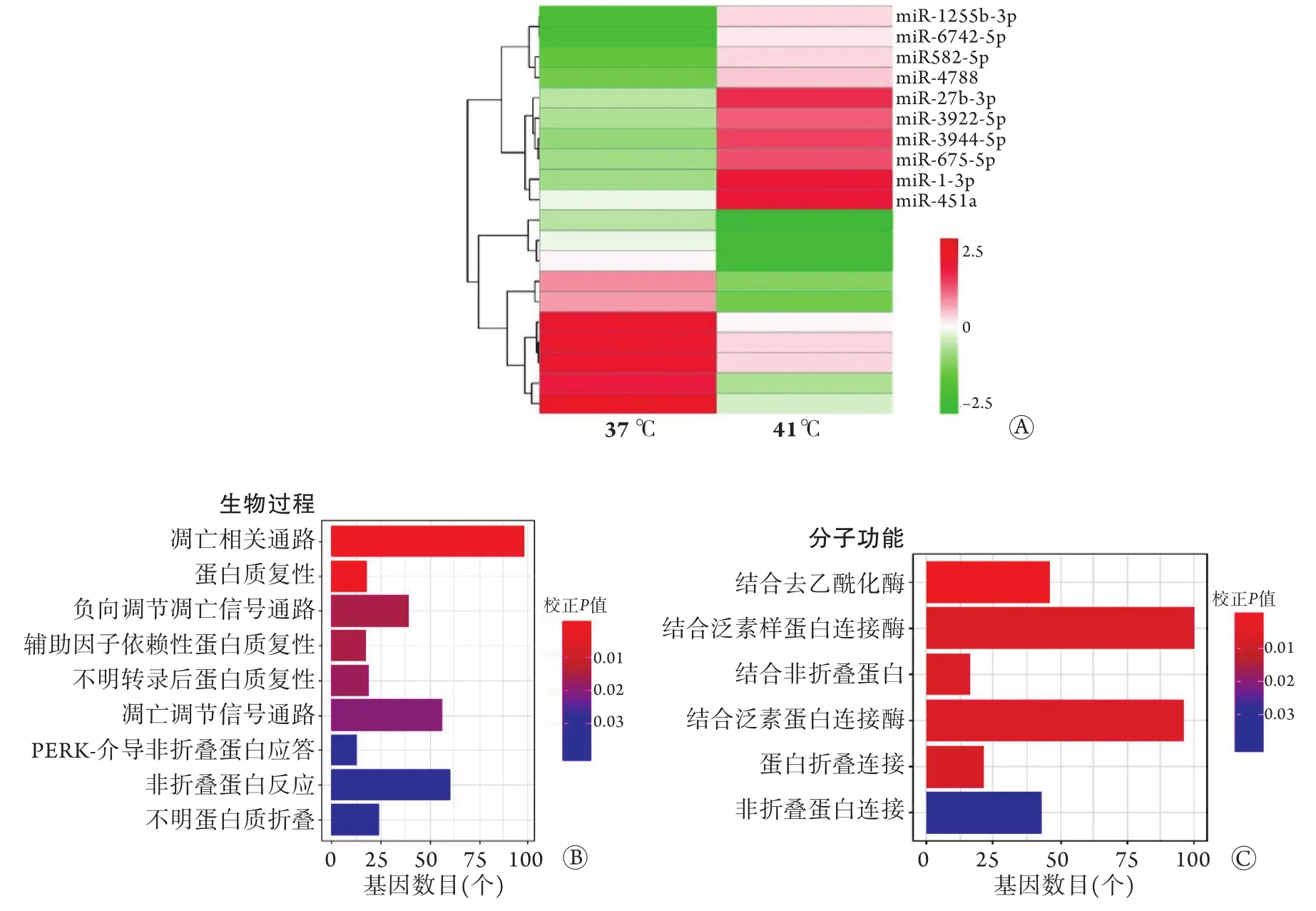
图5 37 ℃孵育和41 ℃热打击HUVECs释放外泌体的miRNA比较Fig.5 Comparison of microRNAs in exosomes released from HUVECs by incubation at 37 ℃ and heat shock at 41 ℃
极端炎热天气会导致病死率升高[8],且重症中暑可导致更高的病死率。极热期间,美国城镇地区中暑发生率约为20/10万人,潜在病死率高达10%~70%[9]。血管内皮细胞损伤是中暑后机体发生炎症反应、凝血功能障碍的主要原因。本研究通过细胞实验首次发现,受到热打击后,血管内皮细胞释放外泌体的浓度发生改变,且能被共同孵育的正常血管内皮细胞吞入胞内,改变了细胞的行为。41 ℃热打击HUVECs释放的外泌体能够抑制正常血管内皮细胞分裂,促进细胞凋亡,降低细胞活力。
重症中暑可引起血管内皮细胞损伤,并导致凝血功能障碍。本研究结果显示,正常血管内皮细胞与41 ℃热打击HUVECs释放的外泌体共同孵育后,其TF、vWF、PAI-1的表达增加,t-PA表达降低。TF是连结炎症与凝血功能紊乱的因子[10],既往研究发现,重症中暑狒狒表现出明显的凝血功能紊乱及血栓形成,血栓中存在TF,且循环中TF水平增高与微血管广泛血栓的形成具有明显相关性,提示重症中暑所致的血栓可能主要为免疫血栓,且与TF关系较大[4]。本研究发现,将41 ℃热打击HUVECs释放的外泌体加入正常HUVECs中共同孵育后,可以促进HUVECs释放TF,并引起下游的凝血相关指标(包括vWF、PAI-1、t-PA等)发生变化。vWF可同时结合血小板及血管内皮下胶原纤维,将血小板黏附于血管壁,导致血栓形成;PAI-1能够抑制已经形成的纤维蛋白原溶解,对血栓形成具有促进作用;t-PA是一种由血管内皮细胞分泌、释放的蛋白,能够亲和纤维蛋白,并使酪氨酸纤溶酶原形成纤溶酶,降解纤维蛋白原[11]。本研究结果表明,41 ℃热打击HUVECs释放的外泌体能够抑制正常HUVECs分泌t-PA,改变血管内皮细胞的形态,影响凝血因子的释放,最终起到促凝的作用。
本研究结果显示,41 ℃热打击HUVECs释放的外泌体中包含多种miRNAs,上调的miRNAs预测与凋亡信号通路调节有关。有研究发现,抑制缺氧诱导因子-1α(HIF-1α)可以抑制血管内皮生长因子(VEGF)的表达,增加p53的表达,从而促进宫颈癌细胞凋亡[12]。p53等蛋白表达增加可导致热打击后血管内皮细胞凋亡增加[13]。SIRT1激动剂能够改善和促进p53的表达,抑制糖基化终产物诱导的血管内皮细胞凋亡,以及抑制促进细胞凋亡的相关信号分子,而SIRT1抑制剂能够阻抑这种作用,导致细胞凋亡[14]。通常MAPK9与MAPK8可共同抑制p53泛素化、稳定p53而诱导凋亡,MAPK10则能够激活MAPK8/JNK系统,对细胞凋亡起促进作用[15]。Bcl-2为凋亡分子机制研究的主要靶分子,可抑制细胞色素C(Cyt-C)的释放,从而抑制超氧化阴离子的产生;还可增加胞内谷胱甘肽(GSH)等抗氧化剂的含量,升高NAD/NADH比值,降低凋亡相关的GSH,促进GSH进入细胞核,调节细胞的氧化还原状态,从而抑制细胞凋亡[16]。本研究预测结果显示,抑制凋亡基因的miRNAs亦上调,表明热打击所导致的血管内皮细胞凋亡过程受促进凋亡和抑制凋亡的双重作用,而在热打击细胞模型中,Bcl-2蛋白可能并未起到保护细胞、抑制凋亡的作用。此外,PI3K/Akt信号转导通路参与调节热打击血管内皮细胞凋亡的过程。PI3K是一种胞内磷脂酰肌醇激酶,能够产生PIP2和PIP3,Akt则是PI3K信号转导通路中一个重要的下游靶点,当细胞受到胞外信号刺激时,PI3K活化产生的PIP3和Akt N端的PH结构域结合,使Akt向质膜转位而激活,后者催化其自身的Ser124和Thr450磷酸化,同时使PIP3依赖激酶(PDK1、PDK2)分别催化Akt的Thr308和Ser473磷酸化,进而激活Akt,引起级联反应[17]。PI3K/Akt信号通路具有抗凋亡和促凋亡的双重作用。PI3K/Akt直接调控Bcl-2蛋白家族,使Bad蛋白的Ser136磷酸化,抑制细胞凋亡[18]。激活的Akt能促进Ser196磷酸化,灭活caspase-9[19],抑制GSK-3B酶的活性,发挥抗凋亡的作用[20]。PI3K/Akt信号转导通路可通过间接调控鼠双微粒体2(Mdm2),抑制p53的活性[21];还可通过促进CREB蛋白活性,增强Bcl-2的功能[22],磷酸化FOXO蛋白亚型,降低转录因子活性,起抑制凋亡的作用。
本研究发现,旁分泌途径在细胞损伤中起重要作用。旁分泌途径是指由细胞分泌的有功能的细胞因子或外泌体对附近甚至远处的器官、细胞造成影响。近年来研究发现,旁分泌是导致炎症、凝血功能异常的重要途径,且与血管内皮细胞有关[23]。本研究体外细胞实验首次证实,热打击血管内皮细胞分泌的外泌体与健康人体温度(37 ℃)下细胞释放的外泌体形态存在差异,并且能够改变正常细胞的细胞周期、活力,促进细胞凋亡,并对凝血功能造成影响,提示旁分泌途径可用于疾病治疗。最近研究发现,利用间充质干细胞的旁分泌机制能够改善心肌缺血/再灌注损伤[24],而血管内皮细胞能够释放生长因子,可利用其旁分泌途径对低氧、糖尿病患者的视网膜进行修复[25]。外泌体源性miRNA也可通过旁分泌途径对器官功能造成影响。目前有研究发现,在猪心肌梗死、心力衰竭模型中,由心脏基质细胞释放的外泌体中过表达的miR-21-5p能够修复心肌细胞[26]。
本研究未涉及外泌体中的miRNA,但外泌体源性miRNA必然起到了重要作用,进一步深入探讨外泌体的作用机制必然要探讨这些miRNA所发挥的作用。外泌体中包含的miRNA数量巨大,因此先从外泌体的功能入手研究,能够为发现有价值的miRNA指明方向。
综上所述,血管内皮细胞受41 ℃热打击损伤后可释放异常外泌体,后者可导致正常HUVECs细胞行为、功能异常,TF释放增加,同时促凝因子释放增加、抗凝因子释放减少,从细胞学上解释了热打击血管内皮细胞发生炎症及免疫血栓形成的机制。
