上下垂荡运动刺激下大鼠及人体模拟晕船的反应规律
2020-04-28毛宇奇潘磊磊苏阳肖水凤祁瑞瑞王俊骎叶小飞张婷蔡懿灵
毛宇奇,潘磊磊,苏阳,肖水凤,祁瑞瑞,王俊骎,叶小飞,张婷,蔡懿灵*
1海军军医大学海军医学系航海特殊损伤防护教研室,上海 200433;2海军军医大学卫生勤务学系统计学教研室,上海 200433;3海军军医大学海军医学系海军航空医学教研室,上海 200433
晕动症(motionsickness)是由各种原因引起的摇摆、颠簸、旋转、加速运动等所致疾病的统称,根据加速度特点,可将其分为航空晕动症(晕机)、航天晕动症(空间晕动症)、跳伞晕动症、晕车、晕船及模拟器晕动症等[1-3]。晕船(seasickness)是人体感知由风、浪、涌引起水面舰船产生的不同方向的变加速度异常运动后,引发的一系列以自主神经反应为主的症状和体征[4]。晕船引起的嗜睡、头晕、恶心及呕吐等反应严重影响海员的海上作业能力,其防治方法主要包括适应性训练、药物防治及非药物措施(包括中医治疗、心理行为对策、营养饮食措施等),其中,提前开展科学的适应性训练是预防晕船最有效的方法,且与抗晕药物(如抗胆碱能和抗组胺药物)相比,无不良反应[5]。目前,陆上适应性训练器材如浪木、转椅、四柱秋千、弹力绳训练器等模拟仿真度低,训练效果不理想。研究发现,风、浪、涌引起的舰船复杂运动可分解为左右横摇、前后纵摇、左右横荡、前后纵荡、绕垂直轴旋转、上下垂荡运动,其中上下垂荡变加速度运动是引起晕船的主要因素[6]。本研究观察了上下垂荡运动刺激下大鼠及人体模拟晕船的反应规律,通过模拟不同模式的海浪纵向线性垂荡运动,探讨晕船严重程度与垂荡运动模式(频率、加速度)的关系,以期为制定抗晕船模拟仿真训练方法奠定基础。
1 资料与方法
1.1 实验仪器 动物活动监测系统(中国上海吉量软件科技有限公司),包括DigBehav动物行为分析系统及旷场探索实验黑箱;动物垂荡运动晕船模拟器(型号:NMU-ASV-01,本实验室自行研发制作,频率与加速度可调,按正弦波规律运动)。人体垂荡运动晕船模拟器(型号:NMU-HSV-01,本实验室自行研发制作,频率与加速度可调,按正弦波规律运动)。
1.2 实验动物及分组 成年雄性SD大鼠64只,体重230~250 g,购自上海西普尔-必凯实验动物有限公司,合笼饲养。随机分为4组(n=16):垂荡运动A组(频率0.20 Hz,最大加速度0.05g)、垂荡运动B组(频率0.40 Hz,最大加速度0.13g)、垂荡运动C组(频率0.80 Hz,最大加速度0.48g)和静置对照组。
1.3 动物实验 实验分两批进行。随机选取垂荡运动A、B、C组及静置对照组各8只大鼠,观察大鼠条件性张口行为以及排便反射和旷场探索行为。结束后进行第2批实验。所有动物实验过程均符合国家及单位关于实验动物管理的规定。
1.3.1 大鼠条件性张口观察 建立条件反射:将大鼠置于底部透明的黑色遮光有机玻璃盒内(22.5 cm×26.0 cm×20.0 cm),有机玻璃盒四周插有4支10 ml塑料试管,试管内填塞浸有香草提取物的棉条,以持续释放香草气味。垂荡运动组大鼠同时给予垂荡运动刺激和气味刺激2 h,静置对照组大鼠给予静置和气味刺激2 h。重复3次,每次间隔24 h。张口观察:将大鼠置于有机玻璃盒内,给予气味刺激,静置录像(SONY,HDR-PJ670,日本)2 h,记录大鼠张口次数。大鼠条件性张口的判断标准为快速、大幅度打开下颌骨,可见门齿[7],记为1次。
1.3.2 大鼠排便反射及旷场探索行为观察 垂荡运动组大鼠给予相应垂荡运动刺激2 h,静置对照组大鼠静置2 h,记录刺激期间大鼠的排便颗粒数。随后将大鼠置于旷场探索实验黑箱,监测并记录大鼠在旷场中3 min的运动轨迹,采用Ethovision XT 8.5软件(Noldus,荷兰)分析大鼠的运动参数,包括平均运动速度、移动总距离和停滞时间等。
1.4 受试对象及分组 选取36名男性健康志愿者,年龄22~27岁,身高167~183 cm,体重60~78 kg,无前庭系统疾病、神经系统疾病及心血管系统疾病病史,试验前3 d内未服用过解热镇痛药、催眠药及中枢兴奋药物。受试人员均自愿同意参加试验并签署知情同意书。本试验经海军军医大学医学伦理委员会批准。根据伦理委员会要求,如受试对象出现呕吐等严重不适反应,或受试者无法耐受实验,立即停止刺激。
试验前填写晕动症易感性问卷(motion sickness susceptibility questionnaire,MSSQ),采用本项目组设计的修改版公式,计算MSSQ易感指数(MSSQAdt)[8],并将受试者分为轻度、中度、重度易感。MSSQ-Adt=(2×TSSN+TSSV)×7/NST。其中Adt表示仅统计成年期易感指数,TSSN为恶心症状总积分,TSSV为呕吐症状总积分,NST为乘坐交通工具或游乐设施的种类数。根据易感程度将受试者随机分为4组(n=9):垂荡运动甲组(频率0.42 Hz,最大加速度0.22g)、垂荡运动乙组(频率0.42 Hz,最大加速度0.44g)、垂荡运动丙组(频率0.30 Hz,最大加速度0.33g)和垂荡运动丁组(频率0.25 Hz,最大加速度0.44g)。
1.5 人群试验 受试者坐于人体垂荡运动晕船模拟器中,双眼平视前方,依据分组设置垂荡运动模式参数,连续运动刺激30 min,通过摄像头实时观察受试者体征(面色苍白、出冷汗、打哈欠等),通过步话机每隔5 min询问受试者症状(头晕、恶心、流涎等)发生情况。采用Graybiel晕动症等级评分表评价晕动症严重程度。
1.6 统计学处理 采用SPSS 21.0软件进行统计分析。正态分布数据多组间比较采用单因素方差分析(One-way ANOVA),进一步两两比较采用LSD-t检验,多个率间的比较采用χ2检验。非正态分布数据多组间比较采用Kruskal-Wallis检验,进一步两两比较采用Kruskal-Wallis单因素方差分析。采用MATLAB软件进行人群试验数学建模。P<0.05为差异有统计学意义。
2 结 果
2.1 不同垂荡运动刺激模式对大鼠条件性张口和排便反射的影响 条件性张口观察结果显示,各组大鼠条件性张口次数(F=5.48,P<0.01,图1A)和排便颗粒数差异有统计学意义(F=20.23,P<0.0001,图1B)。与静置对照组相比,垂荡运动A组大鼠条件性张口次数和排便颗粒数差异均无统计学意义(P>0.05),垂荡运动C组大鼠条件性张口次数明显增加(P<0.01),垂荡运动B、C组大鼠排便颗粒数均明显增加(P<0.01,P<0.001)。随着运动频率增加,大鼠条件性张口次数和排便颗粒数均增加,其中垂荡运动C组大鼠条件性张口次数多于垂荡运动A组(P<0.01),排便颗粒数均多于垂荡运动A、B组(P<0.001,P<0.05);垂荡运动B组大鼠排便颗粒数多于垂荡运动A组(P<0.01),条件性张口次数与垂荡运动A组差异无统计学意义(P>0.05)。

图1 不同垂荡运动刺激模式对大鼠条件性张口和排便反射的影响Fig.1 Effects of different patterns of vertical motion on conditioned open mouth and defecation reflex in rats
2.2 不同垂荡运动刺激模式对大鼠自发活动的影响 旷场探索行为观察结果显示,各组大鼠平均运动速度(F=16.60,P<0.001,图2A)、移动总距离(F=16.60,P<0.001,图2B)及停滞时间(F=11.06,P<0.001,图2C)差异有统计学意义。与静置对照组相比,垂荡运动A组大鼠平均运动速度、移动总距离及停滞时间差异无统计学意义(P>0.05),垂荡运动B、C组大鼠平均运动速度、移动总距离均明显减少(P<0.01或0.001),停滞时间明显延长(P<0.05或0.001)。随着垂荡运动频率的增加,大鼠自发活动明显减少。与垂荡运动A组相比,垂荡运动B、C组大鼠平均运动速度均明显减慢(P<0.01,P<0.001)、移动总距离均明显减少(P<0.01,P<0.001)、停滞时间均明显延长(P<0.05或0.001)。与垂荡运动B组相比,垂荡运动C组大鼠平均运动速度、移动总距离明显减少,停滞时间明显延长,差异均有统计学意义(P<0.05)。

图2 不同垂荡运动刺激模式对大鼠自发活动的影响Fig.2 Effects of different patterns of vertical motion on spontaneous activity in rats
2.3 不同垂荡运动刺激模式对人群晕动症反应的影响 MSSQ问卷结果显示,各组受试者年龄、身高、体重差异无统计学意义,晕动症易感性人数构成差异无统计学意义(P>0.05,表1)。Graybiel晕动症等级评分结果显示,接受相应垂荡运动刺激后,垂荡运动甲、乙、丙、丁组受试者Graybiel晕动症等级评分分别为7.67±6.36、4.22±4.97、1.44±1.51、0.22±0.44,差异有统计学意义(F=11.47,P<0.01,图3A)。垂荡运动甲组受试者Graybiel晕动症等级评分明显高于垂荡运动丙、丁组(P<0.05,P<0.01);垂荡运动乙组明显高于垂荡运动丁组(P<0.05)。各组受试者恶心发生率差异有统计学意义(F=16.61,P<0.001,图3B),垂荡运动甲组恶心发生率明显高于垂荡运动丙、丁组(P<0.01)。各组受试者流涎发生率差异无统计学意义(F=6.25,P>0.05,图3C)。人群试验数学模型显示,在垂荡运动模式甲(频率0.42 Hz,最大加速度0.22g)刺激下,受试者晕动症等级评分最高;在垂荡运动模式丁(频率0.25 Hz,最大加速度0.44g)刺激下,晕动症等级评分最低。随着刺激频率的增加,晕动症等级评分增高;当频率固定时,随着加速度的增加,晕动症等级评分呈先升后降的趋势(图3D)。
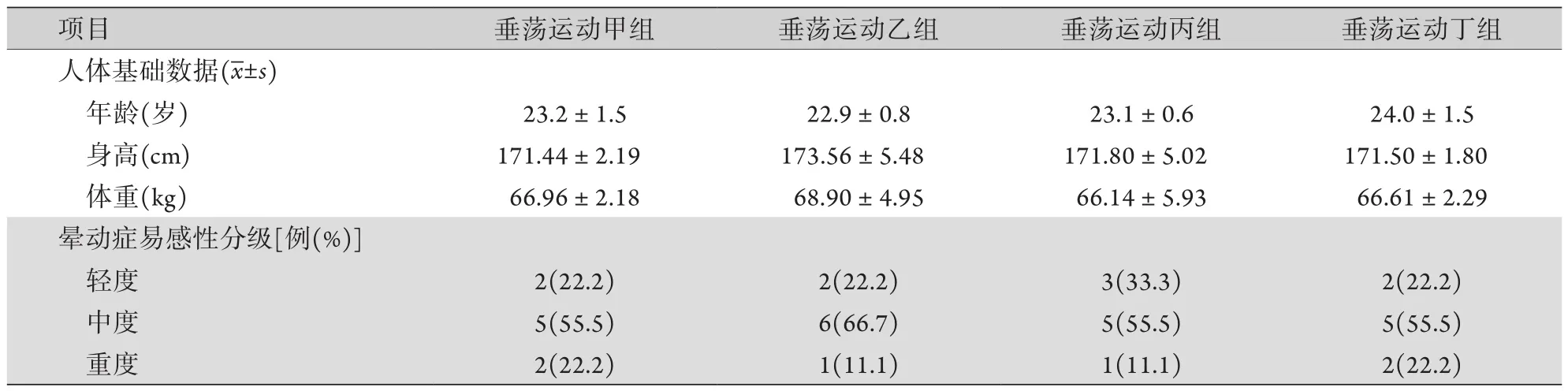
表1 各垂荡运动组人体基础数据及修改版MSSQ指数分级(n=9)Tab.1 Basic demographics and modified MSSQ index grading of each vertical exercise group (n=9)
3 讨 论
晕动症会导致部分哺乳动物如狗、猫、猴子、鼩鼱等发生呕吐反应,可采用呕吐潜伏期或呕吐次数评价上述动物的晕动症易感性和症状严重程度[9-12];由于啮齿类动物(大鼠、小鼠等)无呕吐反射,一般采用异食癖、条件性张口、排便和排尿反射、体温下降及自发活动等指标进行评价[13-15]。异食癖作为评价啮齿类动物晕动症后胃部不适的指标,因个体反应差异较大且具有滞后性,不作为晕动症敏感性的评价方法[16]。Rock等[7]观察发现致吐剂氯化锂及氟西汀注射可诱发大鼠出现条件性张口行为,并将此行为作为评价大鼠类恶心样反应的指标,用于评价晕动症大鼠恶心反应。Parker等[17]将条件性张口作为抗呕吐药物的临床前评价指标。本课题组的前期研究建立条件性张口大鼠模型,探讨了大鼠性别、年龄与晕动症易感性的关系[18],并开展了抗晕药物的药效学评价研究[19]。由此可见,条件性张口是评价大鼠类恶心样反应的可靠指标。Xu等[15]采用旋转刺激建立大鼠晕动症模型,将排便反射等应激样反应作为评价大鼠晕动症严重程度的指标,结果发现,接受旋转刺激后,大鼠的高级神经中枢被抑制,自发活动减弱。本研究分别以条件性张口、排便反射及自发活动3个指标评价晕动症大鼠的胃肠道不适、应激反应及高级神经中枢变化,结果显示:在0.20 Hz的垂荡运动刺激下,大鼠无明显晕动症症状;当运动频率增至0.40 Hz甚至0.80 Hz时,大鼠表现出明显的张口行为、排便增多及自发活动减弱。本课题组的前期研究采用Crampton旋转模型[20]观察大鼠晕动症反应,该模型的运动形式为上下垂荡运动(0.40 Hz)合并前后纵荡运动,大鼠的晕动症症状较本研究中单纯0.40 Hz垂荡刺激[18]时重,表明在一定频率范围内,大鼠晕动症的严重程度随着垂荡频率的增加而加重,提示垂荡运动是引起晕船的主要因素,但混合纵荡刺激可加重晕船症状。
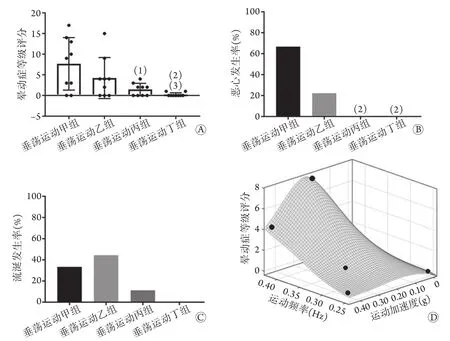
图3 不同垂荡运动刺激模式对人群晕动症反应的影响Fig.3 Effects of different patterns of vertical motion stimulate on population motion sickness
国外研究报道的针对飞行员和航天员的抗晕训练方法,如美国军方为飞行员制定的持续数周的晕动症脱敏计划,成功率>85%[21]。微重力环境下,70%的航天员在72 h内出现晕动症,虚拟现实(VR)、飞行模拟器及旋转椅(Barany's chair)的组合训练可有效降低航天员晕动症的发病率[22]。人体在反复接受垂荡刺激后会产生耐受,当再次接受垂荡刺激时,头晕、恶心等晕动症症状减轻,因此本研究不宜采用同一批受试者进行不同条件下晕动症反应的研究,应采用队列研究。
大规模抗晕船训练常用的方法主要分为主动训练和被动训练。主动训练包括旋梯、浪木、滚轮、原地旋转等;被动训练包括转椅、四柱秋千、弹力绳训练器等[4]。杨月珍等[23]设计制作了弹力绳训练器模拟舰船垂荡运动,其运动频率仅可固定为0.30 Hz,未考虑加速度对晕动症的影响。本实验室依据东海海域海浪的涌动规律,设计制作了人用可调垂荡式晕船模拟器,官兵可用其在陆地上进行晕动症适应性训练。国外研究发现,在0.10~0.70 Hz的垂荡运动中,晕动症症状随频率增加先加重后减轻,0.20 Hz时达到峰值,且晕动症症状随加速度增大而加重[24]。晕动症敏感性与性别、年龄、种族等因素相关。研究发现,黄种人的晕动症敏感性明显高于白种人[18],在不同频率和加速度的垂荡运动刺激下,两种人产生不同的反应。因此,探索并制定符合中国军人晕动症特点的训练参数尤为重要。本研究建立的人群试验数学模型显示,晕动症症状随加速度增大先加重后减轻,0.22g时达到峰值。接受0.25 Hz垂荡运动刺激后,受试者未表现出明显的晕动症症状;当频率增加至0.42 Hz时,多数受试者出现恶心、冒冷汗、流涎等症状。本研究结果表明,在一定的垂荡范围内,大鼠及人体模拟晕船的严重程度随频率增加而加重。在频率不变、加速度为0.22g时,受试者模拟晕船的发病率最高,这为进一步开发模拟仿真抗晕船训练装置提供了试验依据,也为重力加速度变化引起的航天晕动症[3]、运输机上下颠簸及直升机垂直起降时随行人员的晕机反应[25]、空降兵的跳伞晕动症[26]的抗晕训练提供了参考。
