子宫内膜异位症患者血清及腹腔液中IL-37与TNF-α、IFN-γ的关系
2020-04-28江昭颖蒋建发薛敏
江昭颖,蒋建发,薛敏
中南大学湘雅三医院妇产科,长沙 410013
子宫内膜异位症(endometriosis,EMT)指子宫内膜组织在子宫腔被覆内膜及子宫肌层以外的部位生长、浸润,并且反复出血,形成结节或包块,具有易复发及侵袭性等特点,是育龄期妇女常见的妇科良性病变[1]。6%~10%的育龄期妇女有盆腔疼痛及不孕等症状,严重影响患者的身心健康及生活质量[2]。EMT病变广泛,形式多样,发病率呈明显增长趋势[3]。目前其发病机制尚不明确,但有研究显示,免疫机制异常在EMT的发生发展中起重要作用[4]。有研究发现,在EMT中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)及干扰素-γ(interferon-γ,IFN-γ)通过影响炎症、免疫表达参与疾病的发生发展[5],白细胞介素-37(interhukin-37,IL-37)作为IL-1家族成员之一,在慢性炎症疾病患者体内通常呈高表达[6]。EMT也是一种慢性炎症,但IL-37是否可能作为抗炎因子参与EMT的发生发展目前国内尚无相关报道。本研究通过测定EMT患者血清及腹腔液中IL-37、TNF-α与IFN-γ的水平,探讨IL-37与TNF-α、IFN-γ的关系及在EMT发生发展中的作用。
1 资料与方法
1.1 研究对象 选取中南大学湘雅三医院妇科2018年7月-2019年1月收治的经腹腔镜手术及术后病理证实为EMT的36例患者为EMT组,所有患者均无盆腔及其他部位急性感染史,无免疫系统疾病,术前3个月无激素治疗史。按1997年美国生育协会修正分期法(r-AFS)对患者进行分期:早期(Ⅰ-Ⅱ期)13例,晚期(Ⅲ-Ⅳ期)23例。选取同期因单纯性卵巢囊肿、畸胎瘤或子宫肌瘤在该院行腹腔镜手术治疗的28例患者为对照组。EMT组患者年龄为(30.6±5.6)岁,对照组为(31.1±5.5)岁,组间差异无统计学意义,具有可比性。两组患者均有正常的月经周期。本研究获得中南大学湘雅三医院伦理委员会批准。所有入组患者均签署知情同意书。
1.2 研究方法
1.2.1 采集标本 于术前采集入选对象肘正中静脉血4 ml,静置2 h后以3000 r/min离心15 min,留取上层血清并等量分装,标记后放-80 ℃冰箱,待测。两组患者均于腹腔镜检查时通过吸引管吸取子宫直肠陷凹和子宫膀胱陷凹腹腔液,以3000 r/min离心10 min,取上清液,-80 ℃保存待测。
1.2.2 酶联免疫吸附法(ELISA)测定IL-37、TNF-α、IFN-γ水平 将待测血清、腹腔液标本解冻,采用试剂盒检测血清、腹腔液的IL-37、TNF-α、IFN-γ水平,试剂盒均购自中国台湾Arigo公司;所有操作均严格参照试剂盒说明书执行,用酶标仪测定光密度(OD)值,绘制标准曲线,然后通过标准曲线计算标本中IL-37、TNF-α、IFN-γ的水平。
1.3 统计学处理 采用SPSS 20.0软件进行统计分析。计量资料以表示,两组间比较采用t检验;多组间比较采用方差分析,进一步两两比较采用Games-Howell法。采用Pearson相关分析IL-37水平与TNF-α、IFN-γ的相关性。P<0.05为差异有统计学意义。
2 结 果
2.1 两组血清及腹腔液中IL-37、TNF-α、IFN-γ水平比较 EMT组患者血清及腹腔液中的IL-37、TNF-α水平均明显高于对照组,IFN-γ水平明显低于对照组,差异均有统计学意义(P<0.01,表1)。
表1 两组血清及腹腔液中IL-37、TNF-α、IFN-γ水平比较 (pg/ml, )Tab.1 Comparison of IL-37, TNF-α and IFN-γ levels in serum and peritoneal fluid between EMT and control group(pg/ml, )
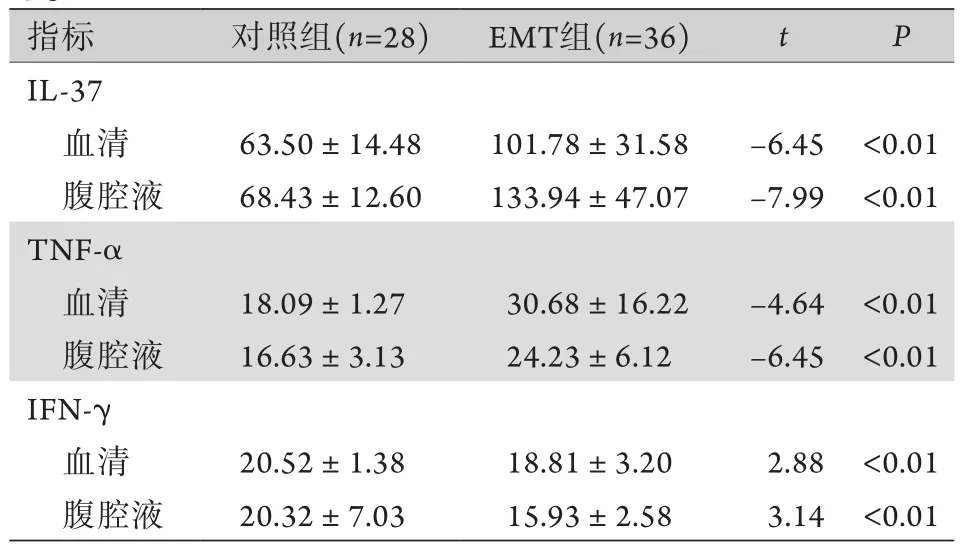
表1 两组血清及腹腔液中IL-37、TNF-α、IFN-γ水平比较 (pg/ml, )Tab.1 Comparison of IL-37, TNF-α and IFN-γ levels in serum and peritoneal fluid between EMT and control group(pg/ml, )
EMT.子宫内膜异位症;IL-37.白细胞介素-37;TNF-α.肿瘤坏死因子-α;IFN-γ.干扰素-γ
指标 对照组(n=28) EMT组(n=36) t P IL-37血清 63.50±14.48 101.78±31.58 -6.45 <0.01腹腔液 68.43±12.60 133.94±47.07 -7.99 <0.01 TNF-α血清 18.09±1.27 30.68±16.22 -4.64 <0.01腹腔液 16.63±3.13 24.23±6.12 -6.45 <0.01 IFN-γ血清 20.52±1.38 18.81±3.20 2.88 <0.01腹腔液 20.32±7.03 15.93±2.58 3.14 <0.01
2.2 对照组与早期、晚期EMT患者血清及腹腔液中IFN-γ、TNF-α、IL-37水平比较 晚期EMT患者血清及腹腔液中的IL-37、TNF-α水平明显高于对照组及早期EMT患者,早期EMT患者血清及腹腔液中的IL-37、TNF-α水平明显高于对照组,差异有统计学意义(P<0.05);晚期EMT患者血清及腹腔液中的IFN-γ水平明显低于对照组及早期EMT患者,差异有统计学意义(P<0.05),但早期EMT患者血清及腹腔液中的IFN-γ水平与对照组比较差异无统计学意义(P>0.05,表2)。
2.3 IL-37与TNF-α、IFN-γ的相关性 在EMT组中,血清及腹腔液中IL-37水平与TNF-α呈正相关(r分别为0.338、0.518,P<0.05),与IFN-γ呈负相关(r分别为-0.332、-0.370,P<0.05)。在对照组中,血清及腹腔液中IL-37水平与TNF-α、IFN-γ均不存在相关关系。
表2 对照组与早期、晚期EMT患者血清及腹腔液中IL-37、TNF-α、IFN-γ水平比较 (pg/ml, )Tab.2 Comparison of IL-37, TNF-α and IFN-γ levels in serum and peritoneal fluid between control group and early stage and late stage EMT patients (pg/ml, )
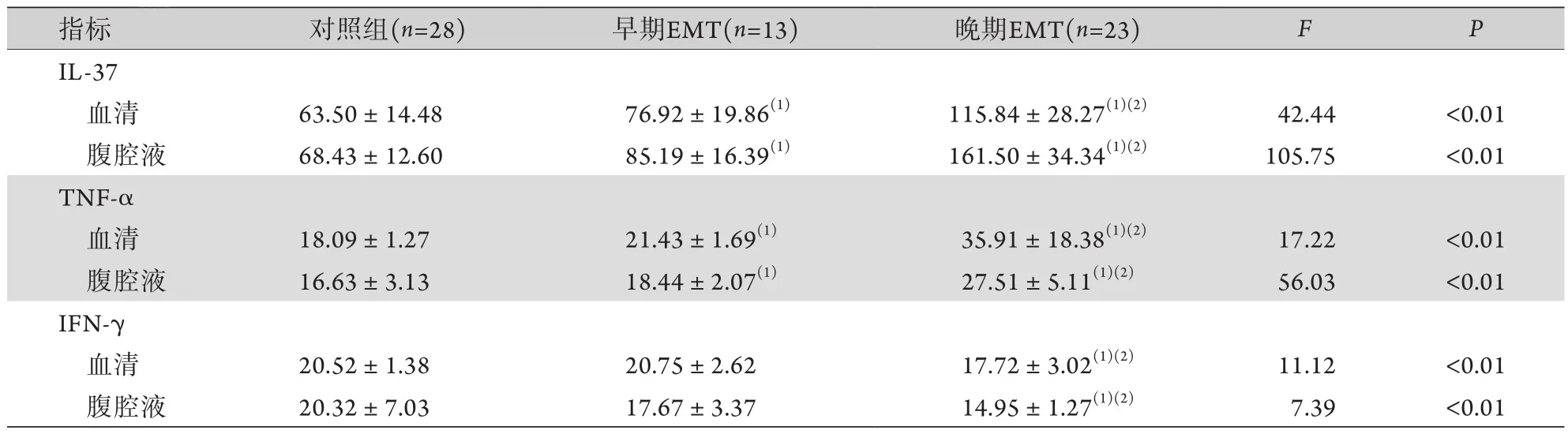
表2 对照组与早期、晚期EMT患者血清及腹腔液中IL-37、TNF-α、IFN-γ水平比较 (pg/ml, )Tab.2 Comparison of IL-37, TNF-α and IFN-γ levels in serum and peritoneal fluid between control group and early stage and late stage EMT patients (pg/ml, )
与对照组比较,(1)P<0.05;与早期EMT比较,(2)P<0.05。
指标 对照组(n=28) 早期EMT(n=13) 晚期EMT(n=23) F P IL-37血清 63.50±14.48 76.92±19.86(1) 115.84±28.27(1)(2) 42.44 <0.01腹腔液 68.43±12.60 85.19±16.39(1) 161.50±34.34(1)(2) 105.75 <0.01 TNF-α血清 18.09±1.27 21.43±1.69(1) 35.91±18.38(1)(2) 17.22 <0.01腹腔液 16.63±3.13 18.44±2.07(1) 27.51±5.11(1)(2) 56.03 <0.01 IFN-γ血清 20.52±1.38 20.75±2.62 17.72±3.02(1)(2) 11.12 <0.01腹腔液 20.32±7.03 17.67±3.37 14.95±1.27(1)(2) 7.39 <0.01
3 讨 论
3.1 EMT与炎症、免疫的关系 EMT为育龄期女性常见的妇科疾病,临床常表现为慢性盆腔疼痛、不孕等。其发病机制目前还未完全阐明,近年来EMT患者的神经-生殖内分泌-免疫调节网络概念受到重视,有研究认为,EMT可能是一种全身性自身免疫性疾病,EMT患者血清和腹腔液中的多种细胞因子参与机体的炎症-免疫调节功能,使腹腔免疫功能紊乱,盆腔内无菌性炎症反应增强,从而导致EMT的发生发展[7]。
3.2 EMT与TNF-α的关系 TNF-α主要为巨噬细胞产生的多功能细胞因子,具有免疫调节、炎症介导等作用,在正常情况下具有抗肿瘤、抗感染等作用,但释放过多或与其他细胞因子的关系失调时又会引起机体一系列病理损伤。本研究中EMT组血清及腹腔液中TNF-α水平明显高于对照组,且随着疾病发展,TNF-α水平进一步增高。考虑可能是异位内膜刺激机体产生相应的体液免疫及细胞免疫,使腹腔液中巨噬细胞数量增加,促使其产生大量的TNF-α,参与机体炎性反应,进而促使异位的子宫内膜间质细胞及间皮黏附,同时刺激间质细胞增殖,从而形成异位内膜病灶[4],这是TNF-α参与EMT发生发展的重要机制之一。
3.3 EMT与IFN-γ的关系 IFN-γ主要由Ⅰ型辅助性T细胞(Th1细胞)及自然杀伤细胞产生,具有免疫调节、抗病毒及抗肿瘤等特性。本研究发现,早期EMT组患者血清及腹腔液中的IFN-γ水平变化不明显,晚期EMT患者的IFN-γ水平明显下降。原因可能是当疾病发展到晚期,异位内膜刺激造成局部的炎性环境,减少了Th1细胞的产生,其分泌的IFN-γ可能作为EMT的保护因子遭到抑制,使局部腹腔中免疫功能明显下降,机体无法识别抗原,从而使子宫内膜细胞逃避了免疫监视,逆流的内膜碎片未能清除,在盆腔和腹腔中继续存活、种植,并且再次引发腹腔液中炎症的级联放大反应,导致异位内膜的种植与生长,促进EMT的发展[8]。
3.4 EMT与IL-37的关系 IL-37属于IL-1家族成员,可抑制树突细胞和巨噬细胞产生促炎性因子,从而抑制炎症发展[9]。目前国内外尚无研究明确IL-37在EMT中的作用机制。通常情况下,健康机体中IL-37表达很少[10]。本研究发现,EMT组患者血清、腹腔液中IL-37水平明显高于对照组,且随着疾病进一步发展,IL-37水平进一步升高,显示其可能参与了EMT的发生发展。本研究还发现,EMT患者的IL-37水平与TNF-α呈正相关,与IFN-γ呈负相关,而在对照组中三者无明显相关性,考虑原因为:在EMT患者中IL-37可能通过促进巨噬细胞增生活跃产生大量TNF-α,抑制T细胞分泌IFN-γ,从而与TNF-α、IFN-γ互相作用,导致免疫调节紊乱及局部炎性反应,促进EMT的发生;且随着疾病的发展,IL-37表达进一步增多,使EMT患者体内免疫失调、炎性反应进一步加重,从而促进EMT的发展。此外,有研究表明,IL-37可能通过促进腹腔局部的炎性反应而参与EMT患者不孕的发生过程[11]。
综上所述,EMT患者血清及腹腔液中IL-37、TNF-α表达升高,IFN-γ表达下降;随着EMT病情的进展,IL-37、TNF-α表达进一步升高,IFN-γ表达进一步下降。EMT患者血清及腹腔液中IL-37水平与TNF-α呈正相关,与IFN-γ呈负相关,在EMT患者中IL-37可能通过促进TNF-α的分泌,抑制IFN-γ的分泌,使病灶微环境中的炎症-免疫反应紊乱,从而参与EMT的发生发展。
