CCR5第一、第二胞外环特异性结合的拮抗短肽对哮喘小鼠气道炎症反应及Th1迁移的影响
2020-04-27张颖丽梁蓉蓉谢艾岑史文倩黄花荣
张颖丽 梁蓉蓉 谢艾岑 史文倩 黄花荣

【摘要】目的 探討CC趋化因子受体5(CCR5)第一、第二胞外环特异性结合的拮抗短肽(拮抗短肽)对哮喘小鼠气道炎症和辅助性T淋巴细胞1(Th1)迁移的影响和机制。方法 40只健康野生型 BALB/c小鼠,分为空白对照组(对照组)、致敏组、模型组、GH拮抗短肽治疗组(GH组)、HY拮抗短肽治疗组(HY组),每组各8只。采用卵清白蛋白构建BALB/c小鼠急性哮喘模型,并予CCR5第一、第二胞外环拮抗短肽(分别为GH和HY短肽)干预。通过制备小鼠肺组织切片评估气道炎症浸润及黏液分泌程度,采用ELISA检测小鼠支气管肺泡灌洗液(BALF)IFN-γ表达水平,使用流式细胞仪分别检测小鼠脾脏和外周血Th1比例。结果 对照组小鼠肺组织无或仅少量炎症细胞浸润,支气管壁均匀无增厚,无黏液栓;致敏组支气管周围少量炎症细胞浸润,管壁及支气管上皮细胞轻微损伤。与对照组比较,模型组可见大量炎症细胞浸润,以支气管和动静脉周围明显,管壁增厚,出现支气管上皮细胞损伤。GH组、HY组小鼠肺组织炎症浸润程度明显减轻。与模型组相比,GH组和HY组小鼠气道炎症浸润程度明显减轻、气道黏液分泌下降、BALF中IFN-γ水平降低、脾脏中Th1比例上升、外周血中Th1比例下降(P均< 0.05)。其中,HY组小鼠脾脏中Th1比例高于GH组,外周血中Th1比例低于GH组(P均< 0.05)。结论 CCR5第一、第二胞外环拮抗短肽缓解哮喘小鼠的气道炎症可能是通过抑制Th1向炎症部位趋化实现的。
【关键词】CC趋化因子受体5;哮喘;干扰素-γ;辅助性T淋巴细胞1
【Abstract】Objective To investigate the effect and mechanism of antagonistic peptides specifically binding to the first and second extracellular loops of CC chemokine receptor 5 (CCR5) on airway inflammation and T-helper cell 1 (Th1) migration in the asthmatic mouse models. Methods Forty healthy wild-type BALB/cmice were evenly divided into the blank control group (control group), sensitization group, model group, GH peptide group and HY peptide group. The experimental BALB/c mouse models of acute asthma were induced by OVA, and treated by antagonistic peptides of CCR5 (GH and YH peptide). The degree of airway inflammation and mucus hypersecretion were assessed by HE and PAS staining, respectively. The expression level of IFN-γ in the bronchoalveolar lavage fluid (BALF) was detected by ELISA. Besides, the proportion of Th1 cells in the spleen and peripheral blood was detected by flow cytometry. Results In the control group, no or slight inflammatory cell infiltration was noted in the lung tissues, no bronchial wall thickening or mucus plug was observed. In the sensitization group, a slight amount of inflammatory cell infiltration was seen surrounding the bronchi, and mild injury was noted in the bronchial wall and epithelial cells. Compared with the control group, a larger quantity of inflammatory cell infiltration was observed, especially surrounding the bronchi and arteriovenous region in the model group. Besides, bronchial wall thickening and bronchial epithelial cell injury were observed. In the GH and HY peptide groups, the severity of inflammatory cell infiltration in the lung tissues was significantly attenuated. Compared with the asthmatic model group, two antagonistic peptides of CCR5 significantly mitigated the allergic airway inflammation and mucus secretion, down-regulated the expression level of IFN-γ, up-regulated the proportion of Th1 cells in the spleen and down-regulated the proportion of Th1 cells in the peripheral blood (all P < 0.05). In the HY group, the proportion of Th1 cells in the spleen was significantly higher, whereas that in the peripheral blood was remarkably lower compared with those in the GH group (both P < 0.05). Conclusion These findings suggest that antagonistic peptides of CCR5 can alleviate the airway inflammation in the asthmatic mouse models probably by suppressing the Th1 chemotaxis to inflammatory sites.
【Key words】CC chemokine receptor 5;Asthma;Interferon-gamma;T-helper cell 1
支气管哮喘是全球性影响人类生活质量的公共卫生问题,发病率未能得到很好地控制。其中多种细胞(杯状细胞、肌细胞、淋巴细胞、中性粒细胞、嗜酸性粒细胞等)及细胞成分参与了哮喘的发生发展过程[1-2]。自不同的辅助性T淋巴细胞(Th)亚群被发现以来,Th2就与过敏性哮喘联系在一起,研究主要集中在Th2炎症反应而忽略了Th1在哮喘免疫反应中的调节作用。最近有研究者在过敏原刺激后检测到CD4+ T淋巴细胞来源的IFN-γ水平升高,参与过敏反应的发展[3]。此外,Th1表面会表达CC趋化因子受体5(CCR5)、CXCR3和CXCR6等趋化因子受体,感受其对应配体的浓度变化,从而募集到炎症部位发挥作用。因此,本研究拟探索CCR5第一、第二胞外环特异性结合的活性拮抗短肽(拮抗短肽)对哮喘小鼠炎症反应及Th1趋化的影响和机制。
材料与方法
一、动 物
健康野生型 BALB/c小鼠,6 ~ 8周龄,雌性,体质量20 ~ 22 g,购自中山大学实验动物中心(东校区),饲养于中山大学实验动物中心(东校区)的SPF级环境,本实验方案征得中山大学实验动物管理与使用委员会及实验动物伦理委员会的批准,动物实验伦理委员会批准编号为IACUC-2019-000097。
二、主要试剂与仪器
CCR5第一、第二胞外环的拮抗短肽(GH短肽和HY短肽),由中山大学孙逸仙纪念医院消化内科钟英强教授惠赠;鸡卵白蛋白(OVA,Ⅴ级)购自美国Sigma公司;IFN-γ的ELISA试剂盒购自美国R&D公司;异硫氰酸荧光素(FITC)-CD4、APC-CD3e、eFluor 450-IFN-γ流式抗体和Cell Stimulation Cocktail试剂购自美国eBioscience公司;固定破膜液购自美国BD公司。
三、实验方法
1. 急性哮喘小鼠模型的建立及干预
急性哮喘小鼠模型构建参考课题组前期模型构建方式[4]。将40只小鼠编号,按随机数表法分为5组,每组各8只小鼠。其中空白对照组(对照组)小鼠予等体积生理盐水替代OVA腹腔致敏和滴鼻激发;致敏组小鼠予等量OVA(50 μg)腹腔致敏,等体积生理盐水滴鼻激发;模型组小鼠予OVA(100 μg)致敏、激发; GH拮抗短肽治疗组(GH组)小鼠使用OVA致敏激发建立哮喘模型后,连续7 d通过尾静脉注射GH短肽(35 mg/kg),
每日1次;HY拮抗短肽治疗组(HY组)小鼠使用OVA致敏激发建立哮喘模型后,连续7 d通过尾静脉注射HY短肽(25 mg/kg),每日1次。GH和HY拮抗短肽剂量根据预实验小鼠肺部病理活组织检查(活检)结果确定。
2. 标本的收集
实验第24日,予过量10%水合氯醛麻醉处死各组实验小鼠。打开小鼠胸腔,仔细分离暴露气管,插入静脉留置针,行肺泡灌洗得肺泡灌洗液(BALF),并进行炎症因子检测。然后用生理盐水冲洗肺部至发白后,取一部分用于HE染色和过碘酸雪夫(PAS)染色分析。最后取脾脏组织和外周血用于流式细胞术检测。
3. 小鼠肺组织的HE染色及评价
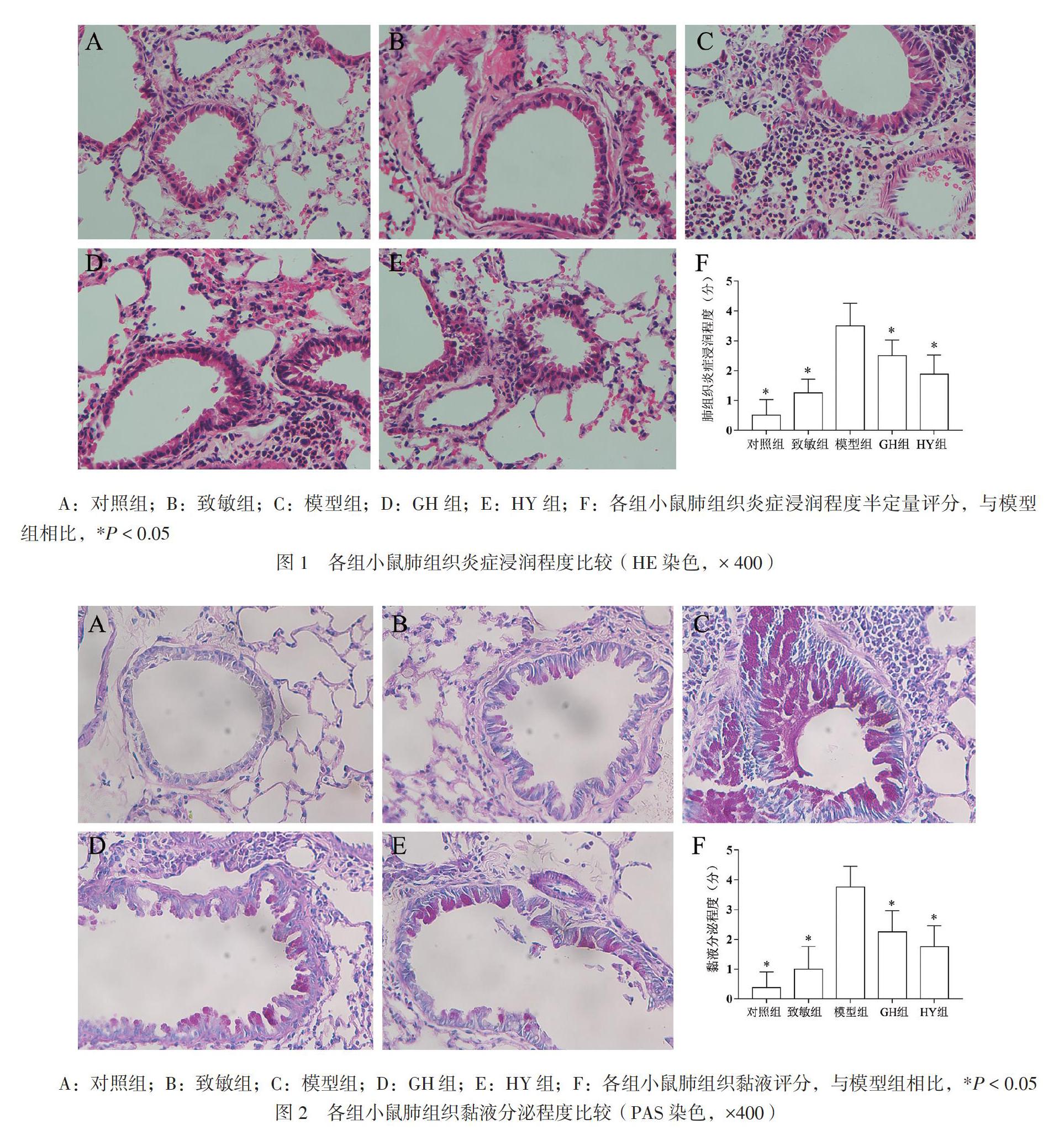
将肺组织置于4%多聚甲醛中固定过夜,制备石蜡切块,切片厚度为5 μm。经HE染色后于显微镜下观察组织病理学改变,包括支气管黏膜及气道上皮细胞的改变、炎症细胞浸润程度,并根据浸润程度评分[5]。标准如下:0分,气道周围无炎症细胞浸润;1分,气道周围有少量炎症细胞浸润;2分,大部分气道周围有1层炎症细胞浸润;3分,大部分气道周围有2 ~ 4层炎症细胞浸润;4分,大部分气道周围有超过4层炎症细胞浸润;5分,几乎全部气道周围均有多层炎症细胞浸润。
4. 小鼠肺组织的PAS染色及评价
将肺组织置于4%多聚甲醛中固定过夜,制备石蜡切块,切片厚度为5 μm。经PAS染色后于显微镜下观察并评估气道黏液分泌程度,评分标准如下:0分,PAS阳性的杯状细胞占整个气道上皮细胞数≤5%;1分,PAS阳性的杯状细胞占整个气道上皮细胞数6% ~ 25%;2分,PAS阳性的杯状细胞占整个气道上皮细胞数26% ~ 50%;3分,PAS陽性的杯状细胞占整个气道上皮细胞数51% ~ 75%;4分,PAS阳性的杯状细胞占整个气道上皮细胞数≥76%;5分,几乎所有气道均有大量PAS阳性的杯状细胞[5]。
5. 小鼠支气管肺泡灌洗液(BALF)中IFN-γ表达水平的检测
将取得的BALF离心,收集上清液,采用ELISA法测定上清液中IFN-γ的表达水平。具体操作严格按照试剂盒说明书步骤进行。
6. 小鼠脾脏和外周血中Th1比例的检测
用淋巴细胞分裂液提取小鼠脾脏及外周血中的淋巴细胞,磷酸盐缓冲液(PBS)洗涤后用含10%胎牛血清的RPMI-1640培养液重悬。取1×106淋巴细胞于24孔板中,加入刺激剂2 μl后置于含5% CO2 37 ℃培养箱中培养5 h。取出用PBS洗涤后加入0.5 μl FITC-CD4、1 μl APC-CD3e抗体,4℃避光孵育30 min。加入150 μl固定破膜液混匀,4 ℃避光孵育30 min。用PBS洗涤后加入2.5 μl eFluor 450-IFN-γ抗体,4℃避光孵育30 min。200 μl 2%多聚甲醛重悬后用流式细胞仪检测。FlowJo软件分析数据。
四、统计学处理
采用SPSS 22.0处理数据。符合正态分布的计量资料以表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验。P < 0.05为差异有统计学意义。
结果
一、CCR5第一、第二胞外环拮抗短肽对哮喘小鼠肺组织炎症浸润的影响
显微镜下观察,对照组小鼠肺组织无或仅少量炎症细胞浸润,支气管壁均匀无增厚,无黏液栓;致敏组支气管周围少量炎症细胞浸润,管壁及支气管上皮细胞轻微损伤,见图1A、B。与对照组比较,模型组可见大量炎症细胞浸润,以支气管和动静脉周围明显,管壁增厚,出现支气管上皮细胞损伤,见图1C。GH组、HY组小鼠肺组织炎症浸润程度明显减轻,见图1D、E。5组小鼠间炎症评分比较差异有统计学意义(F = 29.98,P < 0.01)。与对照组及致敏组相比,模型组气道炎症呈现高水平状态(图1F,P < 0.05)。GH组、HY组炎症浸润程度均低于模型组(P均< 0.05),GH组和HY组比较差异无统计学意义(P > 0.05)。
二、CCR5第一、第二胞外环拮抗短肽对哮喘小鼠肺组织黏液分泌的影响
5组小鼠黏液分泌程度比较差异有统计学意义(F = 28.53,P < 0.01)。在PAS染色中,对照组小鼠气道基底膜未见杯状细胞。与对照组及致敏组相比,模型组出现明显的杯状细胞增生与黏液分泌。与模型组相比,GH组和HY组黏液分泌程度明显减轻、杯状细胞减少(P均< 0.05),GH组和HY组比较差异无统计学意义(P > 0.05),见图2。
三、CCR5第一、第二胞外环拮抗短肽对哮喘小鼠BALF中IFN-γ表达水平的影响
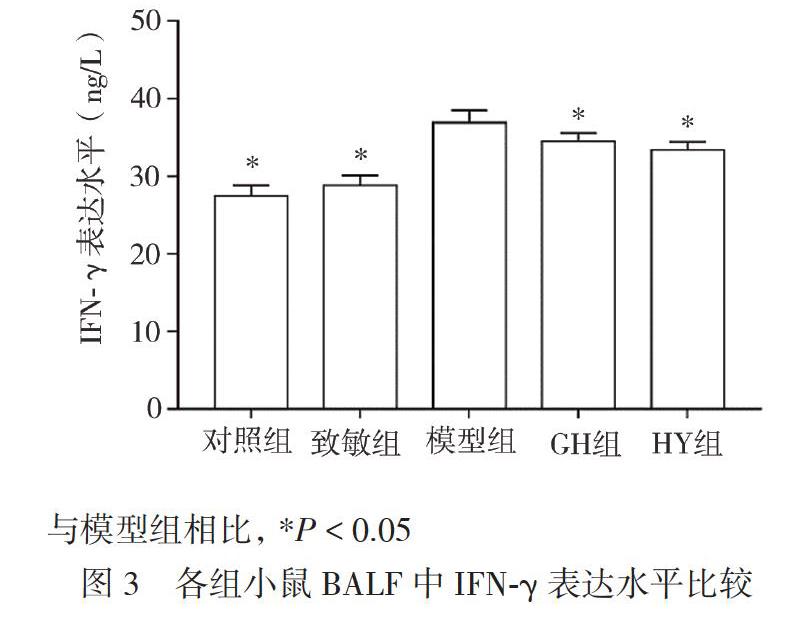
5组小鼠BALF间IFN-γ表达水平比较差异有统计学意义(F = 75.59,P < 0.01)。对照组与致敏组小鼠BALF中IFN-γ表达水平比较差异无统计学意义(P > 0.05)。模型组IFN-γ表达水平约为对照组的1.35倍(P < 0.05)。与模型组相比,GH组和HY组IFN-γ表达水平均有所下降(P均< 0.05),GH组的IFN-γ表达水平与HY组比较差异无统计学意义(P > 0.05),见图3。
四、CCR5第一、第二胞外环拮抗短肽对哮喘小鼠脾脏Th1比例的影响
5组小鼠脾脏间Th1比例比较差异有统计学意义(F = 126.85,P < 0.01)。对照组与致敏组小鼠脾脏Th1比例比较差异无统计学意义(P > 0.05)。模型组小鼠脾脏CD4+ T淋巴细胞中Th1比例高于对照组(P < 0.05),约为对照组的1.16倍。此外,GH组和HY组Th1比例均高于模型组(P均< 0.05),分别约为模型组的1.13倍和1.17倍。其中,HY组上升效果最为明显,与GH组比较差异有统计学意义(P < 0.05),见图4。
五、CCR5第一、第二胞外环拮抗短肽对哮喘小鼠外周血Th1比例的影响
5组小鼠外周血Th1比例比较差异有统计学意义(F = 493.07,P < 0.01)。对照组与致敏组小鼠外周血Th1比例比较差异无统计学意义(P > 0.05)。模型组小鼠外周血CD4+ T淋巴细胞中Th1比例高于对照组,约为对照组的1.64倍(P < 0.05)。与模型组相比,GH组和HY组外周血Th1均有所下降(P均< 0.05),分别约为模型组的86%、71%。同样地,HY组下降效果最为明显,与GH组比较差异有统计学意义(P < 0.05),见图5。
討论
目前,全球哮喘的发病率与病死率仍居高不下,严重影响患者生活质量。但其分子机制涉及范围广,其中多种免疫细胞和介质参与其发生发展。探索哮喘潜在发病机制并开创精准的靶向治疗策略具有重要的现实意义。
相关研究认为,Th1/Th2失衡与免疫炎症的发生发展密切相关。其中Th2及其分泌的IL-4、IL-5、IL-13和与其相关的IgE在气道炎症中水平升高,并且具备Th1的抑制作用[6]。对于Th1及其分泌的IFN-γ在免疫调节中的作用尚不能明确。研究显示,过敏性哮喘中Th1分泌的IFN-γ能拮抗Th2反应,恢复Th1/Th2平衡,有效缓解气道炎症并减少黏液分泌。在过敏性气道炎症诱导前或诱导中使用IFN-γ干预,可观察到IFN-γ的保护作用[7]。但是,IFN-γ如何减轻哮喘炎症反应的具体机制尚不清楚,而且相关结果相反的研究发现,IFN-γ或IFN-γ诱导的细胞因子在动物模型中引起了类似哮喘的炎症反应[8]。在严重哮喘患者的BALF中发现,该类型哮喘以IFN-γ、IL-17等炎症因子升高为特点,对糖皮质激素治疗反应不明显[9-10]。此外在哮喘患儿的外周血上清液中,Th1型IFN-γ和Th2型IL-5水平均增高。上述研究均提示,哮喘患者体内Th1促炎功能增强。本研究使用OVA构建急性哮喘小鼠模型,与对照组对比发现,模型组炎症水平明显,肺部主要以淋巴细胞和嗜酸性粒细胞浸润为主,伴有大量的黏液分泌,符合OVA构建的哮喘模型特征[11]。此外,模型组BALF中亦发现IFN-γ表达水平的升高,与前述研究相符,表明IFN-γ在哮喘中可能发挥着重要的促炎作用。
CCR5是CC趋化因子受体的一种,属于G蛋白偶联受体家族,包括3个胞外环和3个胞内环。在功能上不仅能促进炎症介质的分泌,还参与包括树突状细胞、单核/巨噬细胞、T淋巴细胞等白细胞向炎症组织的趋化和迁移[12-13]。已有研究表明CCR5在多种炎症性疾病(炎症性肠病、支气管哮喘等)和自身免疫性疾病(SLE、类风湿关节炎、银屑病等)中发挥重要作用[14-15]。课题组前期研究发现,CCR5第二胞外环拮抗肽作用于哮喘小鼠能缓解肺部炎症反应[4]。上述研究表明拮抗CCR5能达到抗炎的效果,而细胞膜表面表达CCR5的Th1是否受拮抗短肽调控从而减轻炎症,并未见相关报道。为深入探讨CCR5特异性拮抗短肽与Th1的关系,本研究使用CCR5第一、第二胞外环拮抗短肽干预哮喘小鼠,以观察作用效果及相关机制。
在炎癥性疾病如支气管哮喘、COPD中,CCR5大量表达于白细胞表面,并且能够介导白细胞激活向炎症部位趋化[16]。本研究显示,经GH和HY短肽干预的小鼠肺部炎症浸润及黏液分泌程度均有所下降。因此,GH和HY短肽可能对炎症细胞向肺部的趋化有直接的阻断作用,但也不排除协同其他方式达到共同缓解炎症的效果[17]。另有研究显示,初始CD4+ T淋巴细胞从胸腺迁移到次级淋巴组织(例如淋巴结和脾脏),在次级淋巴组织中与抗原提呈细胞接触并诱导分化为Th1、Th2、Th17等,随后在趋化因子等的作用下迁移到炎症部位[18]。此外,CCR5对于Th1趋化到炎症部位并发挥生物学作用起着重要作用。本研究也证实了CCR5第一、第二胞外环拮抗短肽能降低主要由Th1分泌的IFN-γ的表达水平,同时经过短肽干预后,脾脏的Th1水平增高而外周血中降低。可能是CCR5第一、第二胞外环拮抗短肽阻断了次级淋巴组织中Th1的趋化,即导致脾脏中Th1迁移受阻而表现出轻度升高,进一步引起外周血及肺部Th1数量的减少。因此,GH和HY拮抗短肽可能是通过抑制Th1的趋化作用减轻哮喘小鼠炎症反应的。
本研究中,GH组与HY组BALF中IFN-γ比
较差异无统计学意义,而2组在脾脏和外周血Th1比例比较差异有统计学意义,表现为HY短肽干预效果较GH短肽明显。研究认为,CCR5的天然配体如调节激活正常T淋巴细胞表达分泌因子、巨噬细胞炎性蛋白-1α(MIP-1α)、MIP-1β等主要与CCR5的N端或第二胞外环结合发挥生物学效应[19]。但具体结果仍需加大样本量以进一步明确。本研究使用的GH、HY短肽由噬菌体肽库展示技术筛选合成,具有特异性高、安全性高和成本低的特点,具备较好应用前景[20]。本研究也为CCR5拮抗短肽用于精准治疗支气管哮喘提供了一定的实验依据。
综上所述,本研究探讨了CCR5第一、第二胞外环拮抗短肽对哮喘小鼠Th1趋化的影响,验证了CCR5拮抗短肽可能是通过阻断Th1迁移减轻哮喘炎症反应的,提示支气管哮喘中针对CCR5的拮抗抑制可作为新的研究方向和策略。
参 考 文 献
[1] Barnig C, Frossard N, Levy BD. Towards targeting resolution pathways of airway inflammation in asthma. Pharmacol Ther, 2018, 186:98-113.
[2] Ray A, Kolls JK. Neutrophilic inflammation in asthma and association with disease severity. Trends Immunol, 2017, 38(12):942-954.
[3] Raundhal M, Morse C, Khare A, Oriss TB, Milosevic J, Trudeau J, Huff R, Pilewski J, Holguin F, Kolls J, Wenzel S, Ray P, Ray A. High IFN-γ and low SLPI mark severe asthma in mice and humans. J Clin Invest, 2015, 125(8):3037-3050.
[4] 梁蓉蓉, 李雯静, 刘娟, 沈溪明,黄花荣. CCR5第二胞外环的拮抗短肽对哮喘小鼠肺组织炎症细胞浸润和TNF-α表达的影响. 中国病理生理杂志, 2017, 33(4): 596-602.
[5] Tian BP, Hua W, Xia LX, Jin Y, Lan F, Lee JJ, Lee NA, Li W, Ying SM, Chen ZH, Shen HH. Exogenous interleukin-17A inhibits eosinophil differentiation and alleviates allergic airway inflammation. Am J Respir Cell Mol Biol, 2015, 52(4):459-470.
[6] Deo SS, Mistry KJ, Kakade AM, Niphadkar PV. Role played by Th2 type cytokines in IgE mediated allergy and asthma. Lung India, 2010, 27(2):66-71.
[7] Yoshida M, Leigh R, Matsumoto K, Wattie J, Ellis R, OByrne PM, Inman MD. Effect of interferon-gamma on allergic airway responses in interferon-gamma-deficient mice. Am J Respir Crit Care Med, 2002, 166(4):451-456.
[8] Koch M, Witzenrath M, Reuter C, Herma M, Schütte H, Suttorp N, Collins H, Kaufmann SH. Role of local pulmonary IFN-gamma expression in murine allergic airway inflammation. Am J Respir Cell Mol Biol, 2006, 35(2):211-219.
[9] Wisniewski JA, Muehling LM, Eccles JD, Capaldo BJ, Agrawal R, Shirley DA, Patrie JT, Workman LJ, Schuyler AJ, Lawrence MG, Teague WG, Woodfolk JA. TH1 signatures are present in the lower airways of children with severe asthma, regardless of allergic status. J Allergy Clin Immunol, 2018, 141(6):2048-2060.
[10] Ricciardolo FLM, Sorbello V, Folino A, Gallo F, Massaglia GM, Favatà G, Conticello S, Vallese D, Gani F, Malerba M, Folkerts G, Rolla G, Profita M, Mauad T, Di Stefano A, Ciprandi G. Identification of IL-17F/frequent exacerbator endotype in asthma. J Allergy Clin Immunol, 2017, 140(2):395-406.
[11] Kianmeher M, Ghorani V, Boskabady MH. Animal model of asthma, various methods and measured parameters: a meth-odological review. Iran J Allergy Asthma Immunol, 2016, 15(6):445-465.
[12] Arimont M, Sun SL, Leurs R, Smit M, de Esch IJP, de Graaf C. Structural analysis of chemokine receptor-ligand interactions. J Med Chem, 2017, 60(12):4735-4779.
[13] Adewoye AB, Shrine N, Odenthal-Hesse L, Welsh S, Malarstig A, Jelinsky S, Kilty I, Tobin MD, Hollox EJ, Wain LV. Human CCL3L1 copy number variation, gene expression, and the role of the CCL3L1-CCR5 axis in lung function. Version 2. Wellcome Open Res, 2018, 3:13.
[14] Robinson RT. IL12Rβ1: the cytokine receptor that we used to know. Cytokine, 2015, 71(2):348-359.
[15] 宋楊达, 刘思雪, 宋铱航,沈溪明,黄花荣,钟英强. CCR5第一和第二胞外环特异性结合短肽对大鼠结肠炎的炎症细胞浸润及 NF-κB/TNF-α信号通路的影响. 新医学,2018,49(5): 309-314.
[16] Barnes PJ. The cytokine network in asthma and chronic obst-ructive pulmonary disease. J Clin Invest, 2008, 118(11): 3546-3556.
[17] 刘娟, 梁蓉蓉, 张颖丽, 谢艾岑,黄花荣. CCR5 第 2 胞外环特异性拮抗短肽对哮喘小鼠肺组织自噬相关基因的表达和自噬泡形成的影响. 新医学, 2019, 50(5): 347-352.
[18] Chen W, Zhu C. Mechanical regulation of T-cell functions. Immunol Rev, 2013, 256(1):160-176.
[19] Schnur E, Kessler N, Zherdev Y, Noah E, Scherf T, Ding FX, Rabinovich S, Arshava B, Kurbatska V, Leonciks A, Tsimanis A, Rosen O, Naider F, Anglister J. NMR mapping of RANTES surfaces interacting with CCR5 using linked extracellular domains. FEBS J, 2013 , 280(9):2068-2684.
[20] 刘思雪, 胡梅, 叶小研, 黄花荣,钟英强. 应用噬菌体展示肽库技术淘选大鼠 CCR5膜外第一、 二胞外环特异性结合的活性拮抗肽与初步鉴定. 中国病理生理杂志, 2015, 31(7): 1225- 1230.
(收稿日期:2020-01-24)
(本文编辑:林燕薇)
