慢病毒载体介导的IRX1基因沉默对宫颈癌SiHa细胞增殖和凋亡的影响
2020-04-27陈晓洁郭玲宇张萍
陈晓洁 郭玲宇 张萍

【摘要】目的 观察慢病毒载体介导的易洛魁家族同源盒1(IRX1)基因沉默对宫颈癌SiHa细胞增殖和凋亡的影响。方法 培养宫颈癌SiHa细胞并分为3组:其中未做任何处理的SiHa细胞为Control组、转染空载质粒的SiHa细胞为sh-NC组、轉染IRX1短发夹RNA(shRNA)重组慢病毒载体质粒的SiHa细胞为sh-IRX1组。实时定量PCR和蛋白免疫印迹法分别在IRX1 mRNA和蛋白表达水平上鉴定转染效果,CCK-8法和克隆形成试验检测转染后SiHa细胞增殖能力变化,流式细胞术检测转染后SiHa细胞周期和细胞凋亡的变化,蛋白免疫印迹法检测SiHa细胞中增殖细胞核抗原(PCNA)、细胞周期蛋白 D1(Cyclin D1)、B淋巴细胞瘤(BCL)关联X蛋白(BAX)和BCL-2蛋白表达水平。结果 与Control组和sh-NC组比较,sh-IRX1组SiHa细胞中IRX1 mRNA和蛋白表达水平均下调,SiHa细胞活性和克隆形成能力均降低,G0/G1期细胞比例增多,S期和G2/M期细胞比例减少,细胞凋亡率升高,细胞中PCNA、Cyclin D1和BCL-2蛋白表达水平下调,BAX蛋白表达水平上调(P均< 0.05)。结论 慢病毒载体介导IRX1基因沉默可抑制人宫颈癌SiHa细胞增殖,并促进细胞凋亡。
【关键词】易洛魁家族同源盒1基因;宫颈癌SiHa细胞;增殖;凋亡
【Abstract】Objective To observe the effect of lentiviral vector-mediated Iroquois homeobox 1 (IRX1) gene silencing on the proliferation and apoptosis of cervical cancer SiHa cells. Methods Primary Cervical cancer SiHa cells were cultured and divided into three groups. In the control groups, cervical cancer SiHa cells were untreated. In the sh-NC group, cervical cancer SiHa cells were transfected with empty plasmid. In the sh-IRX1 group, human cervical cancer SiHa cells were transfected with the IRX1 shRNA recombinant lentiviral vector. The transfection efficiency of IRX1 expression at the mRNA and protein levels was evaluated by real-time PCR and Western blot, respectively. The changes in the proliferation of SiHa cells after transfection were detected by CCK-8 assay and colony formation assay. The cell cycle and apoptosis of SiHa cells were detected by flow cytometry. The expression levels of PCNA, Cyclin D1, BAX and BCL-2 proteins in SiHa cells were measured by Western blot. Results After transfection of IRX1 shRNA lentiviral vector, the expression levels of IRX1 mRNA and protein in SiHa cells were significantly down-regulated compared with those in the control and sh-NC groups (both P < 0.05). After IRX1 gene silencing, SiHa cell activity and clone formation ability were significantly decreased. The G0/G1 phase cell ratio was significantly increased, whereas the S phase and G2/M phase cell ratios were dramatically decreased. The cell apoptosis rate was remarkably elevated. The expression levels of PCNA, Cyclin D1 and BCL-2 proteins were significantly down-regulated, whereas that of BAX protein was significantly up-regulated (all P < 0.05). Conclusion Lentiviral vector-mediated IRX1 gene silencing can inhibit the proliferation of human cervical cancer SiHa cells and promote cell apoptosis.
【Key words】Iroquois homeobox 1 gene;Cervical cancer SiHa cells;Proliferation;Apoptosis
宫颈癌是女性第二高发恶性肿瘤,也是女性恶性肿瘤死亡的第三大原因[1]。根据近年我国的统计数据,女性中宫颈癌的发病率呈逐年上升的趋势[2-3]。目前,宫颈癌的治疗方式主要有手术、放射治疗和化学治疗,但患者的生存率仍未能明显提高[4-5]。随着分子生物学及医疗技术的发展,基因治疗在包括宫颈癌在内的多种恶性肿瘤中取得突破性的进展[6-8]。肿瘤的发生发展是一种涉及多因素、多步骤的繁杂过程,其中促癌基因和抑癌基因的异常表达均可参与恶性肿瘤的发病[9-12]。易洛魁家族同源盒1(IRX1)基因与神经系统发育、胚胎发育等密切相关[13-14]。研究显示,IRX1通过介导肿瘤细胞增殖、凋亡、侵袭和迁移等生物学行为在肿瘤的发生和发展中发挥重要作用[15-16]。亦有研究显示IRX1在宫颈癌中呈高表达,且与宫颈癌的临床分期密切相关[17]。然而,IRX1在宫颈癌中的功能及作用机制鲜有报道。因此,本研究探究IRX1对宫颈癌SiHa细胞增殖和凋亡的影响,以期为宫颈癌的基因治疗提供作用靶点。
材料与方法
一、材 料
人宫颈癌细胞株SiHa细胞株(美国标准生物品收藏中心),DMEM培养基(美国Sigma公司),胎牛血清、胰蛋白酶、Opi-MEM培养基(美国Gibco公司),Trizol试剂、逆转录试剂盒(赛默飞世尔科技有限公司),CCK-8试剂(日本TaKaRa公司),IRX1短发夹RNA(shRNA)重组慢病毒载体质粒及空载质粒(上海吉凯基因化学技术有限公司),细胞蛋白提取试剂盒(美国Pierce公司),BCA蛋白浓度检测试剂盒、电化学发光(ECL)试剂及蛋白免疫印迹法检测所需试剂(上海碧云天生物技术研究所),鼠抗人IRX1、增殖细胞核抗原(PCNA)、细胞周期蛋白 D1(Cyclin D1)、B淋巴细胞瘤(BCL)关联X蛋白(BAX)和BCL-2蛋白抗体及山羊抗鼠二抗(美国Cell Sigaling Technology公司)。
二、方 法
1. 细胞培养
人宫颈癌SiHa细胞株用含10%胎牛血清、100 U/ml青霉素和100 μg/ml链霉素的DMEM培养液培养,置于5%CO2、饱和湿度、37℃恒温培养箱中。待细胞贴壁生长融合度达90%后,使用0.25%胰蛋白酶消化传代,取对数期的SiHa细胞进行后续研究。
2. 细胞慢病毒转染和分组
对数生长期的SiHa细胞以胰酶消化,计数后以1×105/孔接种到6孔板中,将细胞分为3组:其中未做任何处理的SiHa细胞为Control组、转染空载质粒的SiHa细胞为sh-NC组、转染IRX1 shRNA重组慢病毒载体质粒的SiHa细胞为sh-IRX1组。转染过程严格参照慢病毒转染及Lipofectamine 2000转染试剂说明书,转染后筛选并收集稳定转染的SiHa细胞。
3. IRX1基因表达水平的检测
使用实时定量PCR法。分别收集转染48 h后的各组SiHa细胞,利用Trizol试剂裂解并提取细胞中总RNA,以分光光度计对提取RNA的纯度和浓度进行鉴定。按照逆转录试剂盒说明书进行加样和扩增,将RNA逆转录成第一链模板DNA,并以GAPDH为内参基因,使用SYBR premix Ex Taq Kit试剂盒行实时定量PCR检测。反应体系包括2倍SYBR premix 10 μl、模板DNA 2 μl、上游引物1 μl、下游引物1 μl、DEPC水6 μl。反应程序:95℃预变性30 s,95℃变性30 s、60℃退火20 s共40个循环,72℃延伸30 s。待反应结束后,分析熔链曲线确定产物的特异性,并获得Ct值,-△△CT=目的基因Ct值-内参基因Ct值,以相对定量2-△△CT法分别计算各组SiHa细胞中IRX1 mRNA相对表达量。IRX1上游引物序列5-AGTTAAAGTCGCCCTTCCAG-3,下游引物序列5-CCCCGCAAAAGTAAAAGAAGAC-3,产物长度120 bp;GAPDH上游引物序列5-GATAC ACGGAGCACCAGGTT-3,下游引物序列5-CAGG TCACATACACGGTTGC-3,产物长度158 bp。
4. IRX1、PCNA、Cyclin D1、BAX和BCL-2蛋白表达水平的检测
使用蛋白免疫印迹法。转染48 h后各组SiHa细胞以胰酶消化,离心收集细胞,使用蛋白提取试剂盒提取各组SiHa细胞中总蛋白。加入适量上样缓冲液与蛋白混匀,加热变性,取30 μg蛋白进行加样,行10% SDS-聚丙烯酰胺凝胶电泳,随后采用半干法将蛋白转至聚偏氟乙烯(PVDF)膜。在5%脱脂奶粉的封闭液中封阻2 h。TBST缓冲液洗膜,分别加入相应一抗,一抗按照使用说明书进行稀释,4℃过夜杂交,TBST洗膜后加入1∶2000稀释的二抗,室温杂交1 h。TBST洗膜后以ECL显色,于暗室中使用凝胶成像系统成像拍照。以GAPDH进行标定,使用Quantity One软件分析各蛋白条带灰度值。分别计算各组SiHa细胞中目的蛋白相对表达水平。
5. IRX1对SiHa细胞增殖能力影响的检测
采用CCK-8法。對数生长期的SiHa细胞接种到96孔板中,接种密度为1×103/孔,在37℃培养箱中继续培养,待细胞生长密度达50%左右时按前述方法进行分组和转染,在转染24、48、72 h时分别向每孔细胞加入100 μl CCK-8溶液,37℃继续孵育4 h,使用多功能酶标仪测定450 nm波长处细胞吸光度(OD)值。
6. IRX1对SiHa细胞增殖影响的检测
采用克隆形成试验。各组处于对数生长期SiHa细胞以胰酶消化,离心收集细胞并制成细胞悬液,计数后分别以8×102/孔接种到6孔板中,将接种好的细胞放置在37℃培养箱继续培养约14 d,
直至大部分细胞克隆数大于50时结束培养,取出6孔板,向各孔细胞中加入1 ml多聚甲醛固定1 h,磷酸盐缓冲液(PBS)洗涤后再向细胞中加入500 μl Giemsa染色液,染色20 min,清水洗涤3次,对各组细胞克隆数进行计数。
7. IRX1对SiHa细胞周期及凋亡影响检测
采用流式细胞术。转染后的各组SiHa细胞以胰酶消化,加入含10%胎牛血清的DMEM培养液终止消化,离心收集细胞,调整细胞悬液密度为3×105/ml,加入预冷的70%的乙醇对细胞进行固定。离心弃上清,加入预冷的PBS 200 μl洗涤细胞2次。向细胞中加入20 μl RNA酶,置37 ℃下孵育30 min,再加入400 μl 碘化丙啶(PI)染液,置于冰上,避光反应15 min,流式细胞仪检测细胞周期比例。另收集转染后的各组SiHa细胞,加入100 μl结合缓冲液重悬细胞,再向细胞悬液中加入异硫氰酸荧光素Annexin V-FITC和PI各5 μl,
混匀后避光孵育30 min,1 h内上流式细胞仪检测细胞凋亡情况。
三、统计学处理
采用SPSS 21.0对数据进行统计分析。数据均以表示,所有试验均重复3次。多组间差异比较采用单因素方差分析,两两比较采用SNK-q检验。P < 0.05为差异有统计学意义。
结果
一、慢病毒载体介导转染建立稳定沉默IRX1基因的SiHa细胞株
sh-IRX1组SiHa细胞中IRX1 mRNA和蛋白相对表达水平均低于Control组和sh-NC组(P < 0.05),而Control组和sh-NC组IRX1 mRNA和蛋白相对表达水平比较差异无统计学意义(P均> 0.05),见图1、表1。
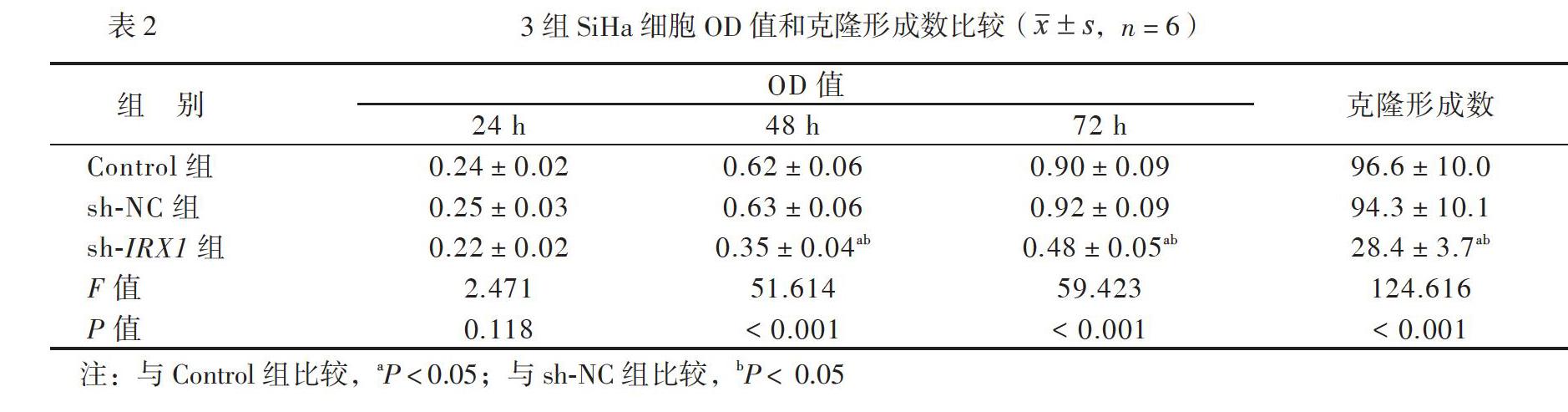
二、IRX1对SiHa细胞增殖的影响
从转染48 h开始,sh-IRX1组SiHa细胞OD值均低于Control组和sh-NC组(P均< 0.05),而Control组和sh-NC组SiHa细胞在各个时间点OD值比较差异均无统计学意义(P均> 0.05)。另外,sh-IRX1组SiHa细胞克隆形成数均少于Control组和sh-NC组(P均< 0.05),而Control组和sh-NC组SiHa细胞克隆形成数比较差异无统计学意义(P > 0.05),见表2。
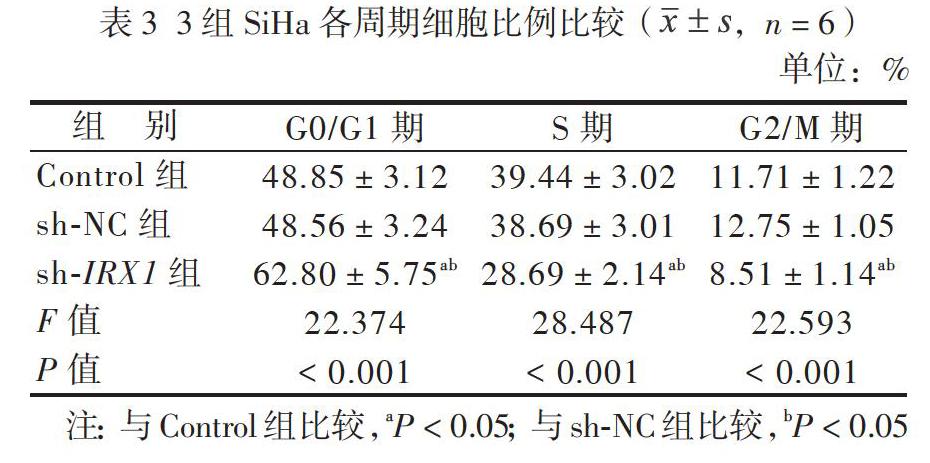
三、IRX1对SiHa细胞周期的影响
流式细胞术检测结果显示,sh-IRX1组G0/G1期细胞百分比均高于Control组和sh-NC组(P均< 0.05),S期和G2/M期细胞百分比均低于sh-IRX1组(P均< 0.05),而Control组和sh-NC组各时期细胞百分比比较差异均无统计学意义(P均> 0.05),见表3。
四、IRX1对SiHa细胞凋亡的影响
sh-IRX1组SiHa细胞凋亡率为(21.94± 3.24)%,均高于Control组的(3.36±0.55)%和sh-NC组的(3.82±0.57)%,P均< 0.05。Control组和sh-NC组SiHa细胞凋亡率比较差异无统计学意义(P > 0.05),见图2。
五、IRX1对SiHa细胞中蛋白表达水平的影响
sh-IRX1组SiHa细胞中PCNA、Cyclin D1和BCL-2蛋白表达水平均低于Control组和sh-NC组(P均< 0.05),其BAX蛋白表达水平高于Control组和sh-IRX1组(P均< 0.05),而Control组和sh-NC组SiHa细胞中PCNA、Cyclin D1、BAX和BCL-2蛋白表达水平比较差异均无统计学意义(P均> 0.05),见表4、图3。
讨论
既往研究显示,IRX1在多种肿瘤中起抑癌基因或促癌基因的作用[18]。Liu等[19]研究表明,蛋白质精氨酸甲基转移酶5(PRMT5)作为IRX1的主要上游调节剂通过诱导IRX1的表观遗传沉默促进胃癌细胞的致瘤性和转移。IRX1 mRNA在原发性肝癌组织中的表达量显著高于相应癌旁组织,IRX1基因的异常高表达可促进肝癌细胞凋亡,抑制细胞生长[20]。以上这些研究显示出IRX1基因的抑癌作用。然而,在Lu等[21]的研究中,IRX1在人骨肉瘤细胞系和临床骨肉瘤组织中过表达,体外研究显示,IRX1通过上调CXCL14/NF-κB信号传导通路促进细胞体外迁移和侵袭。另一项研究显示,IRX1在胶质瘤组织中的表达高于正常脑组织及癌旁组织,且与胶质瘤的恶性程度呈正相关[22]。
Zhang等[23]报道指出,在胶质瘤组织和U373、LN229和T98G细胞中IRX1的表达升高,其表达量与神经胶质瘤患者的总体存活率呈正相关,提示基因可能在神经胶质瘤中表现出致癌作用。这些研究显示出IRX1基因的促癌作用,并提示IRX1在不同肿瘤中发挥不同作用可能与其表达量有关。何杨等[17]指出,IRX1在宫颈癌组织和细胞株中的表达显著升高,提示IRX1可能促进宫颈癌的发生和发展。基于以往研究结果,本研究通过慢病毒载体转染IRX1 shRNA至宫颈癌SiHa细胞,探究沉默IRX1基因对SiHa细胞增殖和凋亡的影响。
本研究显示,宫颈癌SiHa细胞中IRX1 mRNA和蛋白表达水平均降低,表明稳定沉默IRX1基因的SiHa细胞株构建成功。CCK-8和克隆形成试验显示,沉默IRX1基因能够抑制SiHa细胞增殖能力。这与Yu等[24]关于IRX1能够调节牙釉质外上皮和肺泡Ⅱ型上皮细胞增殖和分化的研究类似。PCNA是增殖细胞核抗原,仅存在于增殖细胞和肿瘤细胞中,与细胞中DNA合成密切相关,且能够启动细胞增殖,是反映细胞处于增殖状态的良好指标[25]。Cyclin D1是一类细胞周期蛋白,其在进化上高度保守,能够促进细胞增殖,且在细胞周期调控中发挥关键作用[26]。本研究显示,沉默IRX1基因后SiHa細胞中PCNA和Cyclin D1蛋白表达下调,提示沉默IRX1对SiHa细胞增殖抑制作用可能与下调PCNA和Cyclin D1的表达有关。此外流式细胞仪检测结果显示,沉默IRX1基因能够阻滞细胞周期进程并促进细胞凋亡。BAX和BCL-2属于BCL-2蛋白家族,在细胞凋亡过程中扮演重要角色[27]。BAX是主要的凋亡促进因子,其编码的BAX蛋白可与BCL-2结合形成异二聚体,当BAX含量增多时可阻抑BCL-2对细胞的保护作用诱导细胞发生凋亡[28]。本研究显示,沉默IRX1基因能够上调SiHa细胞中BAX的表达,下调BCL-2的表达,表明沉默IRX1基因可能通过上调BAX的表达及下调BCL-2的表达促进SiHa细胞凋亡。
综上所述,本研究表明沉默IRX1基因能够抑制宫颈癌SiHa细胞增殖并诱导细胞凋亡,其潜在作用机制可能与调控PCNA、Cyclin D1、BAX和BCL-2的表达有关。然而,IRX1在宫颈癌中的确切作用机制尚不清楚,仍有待进一步探究。随着对IRX1的不断深入了解,相信IRX1有可能成为宫颈癌诊断和治疗的潜在作用靶点。
参 考 文 献
[1] Small W Jr, Bacon MA, Bajaj A, Chuang LT, Fisher BJ, Harkenrider MM, Jhingran A, Kitchener HC, Mileshkin LR, Viswanathan AN, Gaffney DK. Cervical cancer: a global health crisis. Cancer, 2017, 123(13):2404-2412.
[2] Song B, Ding C, Chen W, Sun H, Zhang M, Chen W. Incidence and mortality of cervical cancer in China, 2013. Chin J Cancer Res, 2017, 29(6):471-476.
[3] 蔡存伟, 李晓燕, 张丽娜, 陈立群, 张帆. ZNF711在宫颈癌组织中的表达及臨床意义. 解剖科学进展, 2019, 25(1):54-58.
[4] 刘巍巍, 王美娇, 杨敬贤, 于松茂,杜乙. 热塑膜联合发泡胶固定技术在宫颈癌放疗中的应用价值. 中国医学物理学杂志, 2019, 36(6): 636-640.
[5] 王芳芳, 廖思辉, 陈运强, 马昌承. 不同化疗药物联合同期放疗治疗局部中晚期宫颈癌的临床疗效及不良反应观察. 广西医科大学学报, 2019, 36(3): 412-415.
[6] Ji W, Sun B, Su C. Targeting MicroRNAs in cancer gene therapy. Genes (Basel), 2017, 8(1):21.
[7] 张庆颜, 董小玉, 臧乃亮, 徐伟文. CRISPR/Cas9 系统在人类疾病中的研究应用进展. 分子诊断与治疗杂志, 2018, 10(3): 206-211.
[8] 相元翠, 刘文枝, 王雅莉, 李红娟. 五味子活性物质五味子乙素联合KLF6基因调控宫颈癌细胞增殖和凋亡的机制研究. 中华生物医学工程杂志, 2019, 25(1): 63-68.
[9] Wu WK, Li X, Wang X, Dai RZ, Cheng AS, Wang MH, Kwong T, Chow TC, Yu J, Chan MT, Wong SH. Oncogenes without a neighboring tumor-suppressor gene are more prone to amplification. Mol Biol Evol, 2017, 34(4):903-907.
[10] 谭麟, 张谢, 李宏. 磷酸酶及张力蛋白同源物与肝细胞肝癌. 新医学, 2017, 48(5): 293-296.
[11] 张桂虾, 施飞熊, 周宇. DIO3 基因在肿瘤发病机制中的作用研究进展. 新医学, 2019, 50(10): 725-728.
[12] 李康, 黄卫, 陈诞芳, 汤绍辉, 张铂, 张晖. PDSS2 在肝细胞癌中的表达及对肝癌细胞生长和侵袭的影响. 热带医学杂志, 2017, 17(6): 714-718.
[13] Cipriani V, Silva RS, Arno G, Pontikos N, Kalhoro A, Valeina S, Inashkina I, Audere M, Rutka K, Puech B, Michaelides M, van Heyningen V, Lace B, Webster AR, Moore AT. Duplication events downstream of IRX1 cause north carolina macular dystrophy at the MCDR3 locus. Sci Rep, 2017, 7(1):7512.
[14] Díaz-Hernández ME, Bustamante M, Galván-Hernández CI, Chimal-Monroy J. Irx1 and Irx2 are coordinately expressed and regulated by retinoic acid, TGFβ and FGF signaling during chick hindlimb development. PLoS One, 2013, 8(3):e58549.
[15] Kühn A, L?scher D, Marschalek R. The IRX1/HOXA connection: insights into a novel t(4;11)-specific cancer mechanism. Oncotarget, 2016, 7(23):35341-35352.
[16] 涂艳阳, 张鹏幸, 张永生, 王樑. IRX1在肿瘤发生发展中的作用研究. 转化医学电子杂志, 2016, 3(10):1-5.
[17] 何杨, 黄奕, 李娜, 严浩, 杨润峰, 蒋蕾, 蒋孝会, 曹波. IRX1在宫颈癌中的表达及其与癌症分期的相关性. 中华医学杂志, 2018, 98(3):222-226.
[18] Lu J, Wang J. IRX1 hypomethylation in osteosarcoma metastasis. Oncotarget, 2015, 6(19):16802-16803.
[19] Liu X, Zhang J, Liu L, Jiang Y, Ji J, Yan R, Zhu Z, Yu Y. Protein arginine methyltransferase 5-mediated epigenetic silen-cing of IRX1 contributes to tumorigenicity and metastasis of gastric cancer. Biochim Biophys Acta Mol Basis Dis, 2018, 1864(9 Pt B):2835-2844.
[20] 刘良田, 许海涛, 唐永华. IRX1、IRX2基因在原发性肝癌组织细胞中的表达及其对肝癌细胞的免疫保护作用. 中国现代药物应用, 2018, 12(5):217-219.
[21] Lu J, Song G, Tang Q, Zou C, Han F, Zhao Z, Yong B, Yin J, Xu H, Xie X, Kang T, Lam Y, Yang H, Shen J, Wang J. IRX1 hypomethylation promotes osteosarcoma metastasis via induction of CXCL14/NF-κB signaling. J Clin Invest, 2015, 125(5):1839-1856.
[22] 張鹏幸, 曾伟涛, 刘辉, 刘楠, 李倩, 徐小珊, 祁婧, 涂艳阳. 易洛魁家族同源盒基因IRX1在胶质瘤中的表达研究. 现代生物医学进展, 2017, 17(7):39-42.
[23] Zhang P, Liu N, Xu X, Wang Z, Cheng Y, Jin W, Wang X, Yang H, Liu H, Zhang Y, Tu Y. Clinical significance of iroquois homeobox gene-IRX1 in human glioma. Mol Med Rep, 2018, 17(3):4651-4656.
[24] Yu W, Li X, Eliason S, Romero-Bustillos M, Ries RJ, Cao H, Amendt BA. Irx1 regulates dental outer enamel epithelial and lung alveolar type Ⅱ epithelial differentiation. Dev Biol, 2017, 429(1):44-55.
[25] Choe KN, Moldovan GL. Forging ahead through darkness: PCNA, still the principal conductor at the replication fork. Mol Cell, 2017, 65(3):380-392.
[26] Ramos-García P, Gil-Montoya JA, Scully C, Ayén A, González-Ruiz L, Navarro-Trivi?o FJ, González-Moles MA. An update on the implications of cyclin D1 in oral carcinogenesis. Oral Dis, 2017, 23(7):897-912.
[27] Renault TT, Dejean LM, Manon S. A brewing understanding of the regulation of Bax function by Bcl-xL and Bcl-2. Mech Ageing Dev, 2017, 161(Pt B):201-210.
[28] Andreu-Fernández V, Sancho M, Genovés A, Lucendo E, Todt F, Lauterwasser J, Funk K, Jahreis G, Pérez-Payá E, Mingarro I, Edlich F, Orzáez M. Bax transmembrane domain interacts with prosurvival Bcl-2 proteins in biological membranes. Proc Natl Acad Sci U S A, 2017, 114(2):310-315.
(收稿日期:2019-11-25)
(本文编辑:林燕薇)
