基于多酚类化合物HPLC指纹图谱在红缨子高粱原料品质监控中的应用
2020-04-25倪德让叶兴乾孙崇德孔祥礼王和玉
倪德让,叶兴乾,林 琳,孙崇德,孔祥礼,王和玉,王 莉,
(1.贵州茅台酒股份有限公司技术中心,贵州 仁怀 564501;2.浙江大学生物系统工程与食品科学学院,浙江 杭州 310058;3.浙江大学农业与生物技术学院,浙江 杭州 310058)
在我国,以高粱为原料生产白酒已有700多年的历史,高粱中淀粉含量高,蛋白质、单宁和脂肪等含量适当,是酿酒的优质原料,如茅台酒、泸州老窖、剑南春、五粮液等众多国家优质白酒均以高粱作为主要原料或单一原料[1]。红缨子高粱,是贵州省仁怀市本地的一种原生有机糯高粱品种,也是茅台酒酿造的主要原料[2-3]。相较于东北及其他地区高粱,红缨子高粱颗粒坚实、饱满、均匀,粒小皮厚,其独特的玻璃质地,十分有利于白酒的生产[3]。高粱在我国种植地域十分广泛,品种多样,但并不是所有的高粱都适合于酿酒。因此,研究高粱原料品质的科学评定方法和质量监测体系,对于维持白酒的优质风味和品质具有重大意义。
所有高粱品种富含多酚类物质[4-7],包括黄酮类化合物、酚酸和原花色素,它们能够在发酵过程中起到抑菌效果,并与白酒风味和其营养保健功能密切相关[8-12]。文献报道,高粱的基因型及其生长环境会影响其多酚类化合物的组成和含量,进而影响其颜色、外观和品质[13-15]。黑色种皮的高粱品种,其总3-脱氧花青素的含量是红、棕两色种皮高粱品种的4 倍[16],而白色种皮高粱品种中黄烷酮类化合物含量最低,在柠檬黄种皮高粱品种中黄烷酮含量最高[17]。高粱中的多酚类化合物在酿酒过程中对白酒风味等有重要的影响,同时也是白酒中功能成分的重要贡献者。据报道,4-乙烯基愈创木酚是通过前体物质阿魏酸脱羧形成[18],同时少量的单宁经过蒸煮及发酵也能变成芳香物质从而赋予酒特殊的香味[19]。
指纹图谱技术在目前被广泛应用于掺假中药鉴别、食品评价、种子检测和鉴定等领域,也常用于分析酒中挥发性成分特征[20-23]。因此,本实验基于多酚类物质建立红缨子高粱高效液相色谱指纹图谱,以期为红缨子高粱原料的品种鉴别、质量监控提供新的思路和方法。
1 材料与方法
1.1 材料与试剂
样品预处理:17 批次红缨子高粱分别取自贵州省仁怀市及周边不同地区,见表1。8 批次其他酿酒高粱品种均由市场购得,样品分别研磨,过35 目筛(500 μm),密封保存于-20 ℃。
色谱级酚酸、黄酮类化合物标准品:氯化芹菜定(批号:Z10M10H87072)和氯化木犀草定(批号:Z10M10H87073) 上海源叶生物科技有限公司;柚皮素(批号:L1701073)、芹菜素(批号:C1412096)、花旗松素(批号:C1412096)、木犀草素(批号:E1731036)、原儿茶酸(批号:072K3446)、咖啡酸(批号:B1802106)和阿魏酸(批号:G1628090)上海阿拉丁生化科技股份有限公司;4-香豆酸(批号:C10365642) 上海麦克林生化科技有限公司。
甲醇、乙腈(均为色谱纯) 德国默克公司;其他试剂均为国产分析纯。
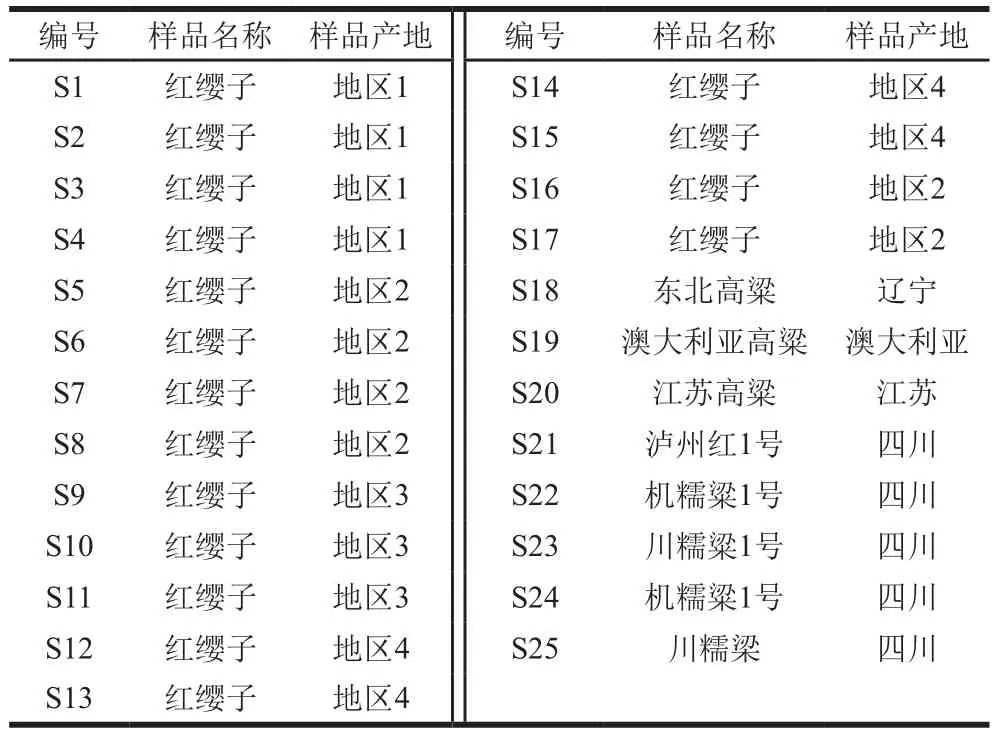
表 1 高粱样品信息Table 1 Information about the sorghum samples tested in this study
1.2 仪器与设备
e2695分析型高效液相色谱仪(2998二极管阵列检测器) 美国Waters公司;3K15离心机 美国Sigma-Aldrich公司;MS105DU电子天平 瑞士Mettler Toledo公司;ZM200超离心粉碎仪 德国Retsch GmbH公司。
1.3 方法
1.3.1 供试样品准备
样品:准确称取2 g粉碎样品于50 mL离心管中,加入30 mL 80%冰乙醇摇床振荡提取15 min。提取结束后在3 000 r/min离心10 min。移出上清液,残渣再提取2 次,合并3 次上清液,用0.45 μm滤膜过滤。将过滤后的上清液放置在旋转蒸发仪中,设置45 ℃,在真空条件下蒸干,并用甲醇定容至10 mL。使用0.22 μm滤膜过滤后保存于-80 ℃,用于液相色谱分析[24]。标准品:取适量各标准品,各自用纯甲醇溶解,均使用0.22 μm滤膜过滤后用于液相色谱分析。
1.3.2 高粱多酚类物质指纹图谱建立
分别取25 批高粱样品及标准品,进行高效液相色谱指纹图谱分析。检测条件:ZORBAX C18RP-HPLC色谱柱(250 mm×4.6 mm,5 μm);流动相A为0.1%甲酸溶液,流动相B为乙腈;流速0.5 mL/min;进样量10 μL;柱温25 ℃;洗脱梯度:5%~15% B,5 min;15%~50% B,40 min;50%~70% B,2 min;70%~100% B,1 min;100% B,7 min;100%~5% B,1 min;5% B,9 min;检测波长288 nm[25]。以花旗松素的色谱峰(S)为参照峰计算相对保留时间和相对峰面积比值。将所有样品的液相色谱图导入国家药典委员会“中药色谱指纹图谱相似度评价系统(2012版)”软件进行处理,生成相应的高粱原料高效液相色谱指纹图谱[26]。
1.3.3 方法学考察
1.3.3.1 精密度
按1.3.2节色谱条件取某一样品提取液连续进样6 次,记录色谱图,计算各色谱峰的相对峰面积与相对保留时间。
1.3.3.2 稳定性
取某一样品提取液,分别在0、2、4、8、12、24 h进样测定,记录色谱图,计算各色谱峰的相对峰面积与相对保留时间。
1.3.3.3 重复性
称取某一样品高粱全籽粒粉末共6 份,按1.3.1节平行制备供试液,进行测定,计算各色谱峰的相对峰面积与相对保留时间。
1.3.4 高效液相色谱指纹图谱相似度的计算
采用国家药典委员会“中药色谱指纹图谱相似度评价系统(2012版)”软件进行处理,将高效液相色谱实验数据导入软件中,为减小极端数据的影响,选择中位数法,时间窗宽度设为0.1,运用多点校正方法对色谱峰进行匹配,计算样品之间的相似度。
1.3.5 聚类分析
为进一步观察不同产地不同品种之间的差异,本实验应用SPSS 22.0统计软件,以所有样品的共有峰峰面积为聚类参数,将所得的25 个样品的数据,按照组之间联接和欧式距离联用的方法进行聚类分析,分析不同酿酒高粱样品的亲疏程度。
1.3.6 主成分分析
将所有高粱样品的共有峰峰面积运用SPSS 22.0进行主成分分析,解析样品的主成分得分,用于不同品种酿酒用高粱的差异模式识别。
2 结果与分析
2.1 方法学考察结果
2.1.1 精密度结果
取S7号样品按照1.3.1节方法制备供试品溶液,连续进样6 次,结果表明各共有峰相对保留时间的相对标准偏差(relative standard deviation,RSD)在0.00%~0.26%之间,相对峰面积RSD在0.00%~4.06%之间,表明仪器精密度良好,符合指纹图谱的检测要求。
2.1.2 稳定性结果
取S7号样品按照1.3.1节方法制备供试品溶液,分别在制备后0、2、4、8、12、24 h进样检测,测得各共有峰的相对保留时间RSD在0.00%~0.186%之间,各共有峰的相对峰面积RSD在0.00%~0.38%之间,说明样品溶液在24 h内稳定性良好。
2.1.3 重复性结果
分别取S7号样品6 份,按照1.3.1节方法制备供试品溶液6 份,分别进样分析,测得各共有峰的相对峰面积RSD在0.00%~0.19%之间,各共有峰的相对保留时间RSD在0.00%~0.42%之间,说明所用方法重复性良好。
2.2 指纹图谱的建立及相似度评价
将所得的25 批高粱多酚色谱图谱以AIA格式依次导入到国家药典委员会“中药指纹图谱相似度评价系统软件(2012版)”,得到25 批高粱样品的色谱叠加图(图1)以及各样品相似度结果(表2)。由表2可以看到,来自贵州省不同地区的红缨子高粱样品在共有模式下的相似度均在0.97以上,样品之间具有极高的相似度,不同产地的各批次红缨子样品的质量比较稳定。对于其他酿酒高粱品种,在共有模式下与红缨子高粱的相似度均低于0.90,说明在这部分高粱的多酚类化合物中,能与红缨子高粱相匹配的共有峰的占比较少,因此,可通过高粱多酚化合物高效液相色谱指纹图谱将其与红缨子高粱进行区分。
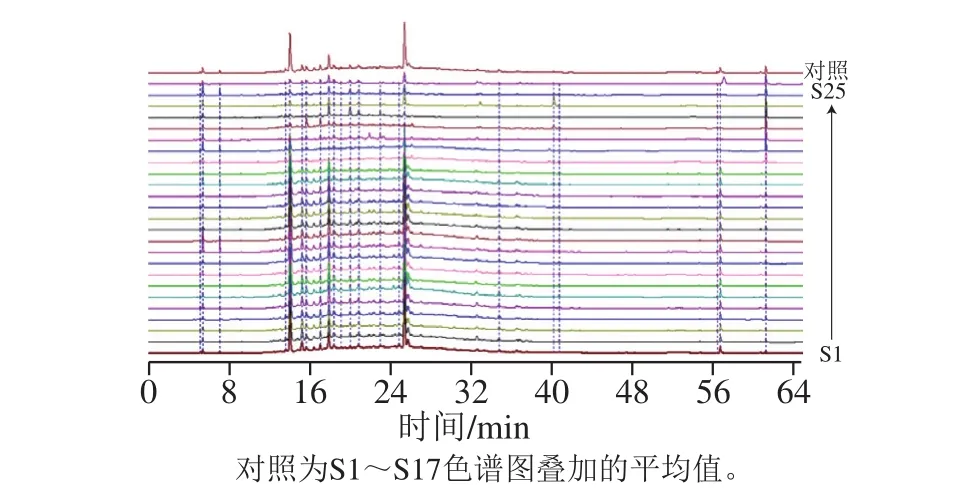
图 1 25 批高粱样品多酚类化合物的高效液相色谱叠加指纹图谱Fig. 1 Overlapped HPLC fingerprints of phenolics from 25 batches of sorghum samples

表 2 共有模式下高粱样品的相似度评价结果Table 2 Similarity evaluation of sorghum samples under common pattern
2.3 指纹图谱共有峰的标定及基于共有峰相对峰面积的聚类分析
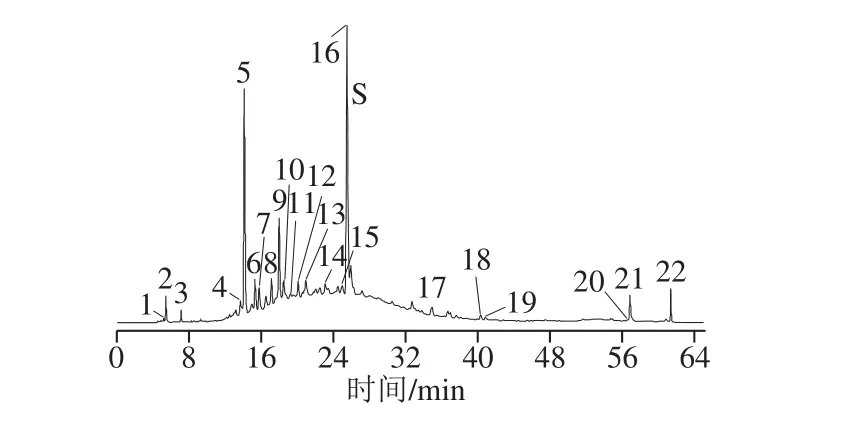
图 2 25 批高粱样品高效液相色谱指纹图谱共有模式Fig. 2 HPLC chromatograms showing peaks common to 25 batches of sorghum samples
采用标准品比对结合高效液相色谱分析,通过保留时间和对比文献,匹配到共有色谱峰22 个,如图2所示。通过保留时间、标准品比对及文献检索,确认了共有峰中的11 个峰,其中,4号峰为原儿茶酸(13.645 min),5号峰为花旗松素己糖苷(14.091 min),10号峰为咖啡酸(18.445 min),11号峰为木樨草定(19.177 min),13号峰为芹菜定(20.889 min),14号峰为4-香豆酸(23.042 min),15号峰为阿魏酸(24.924 min),16号峰为花旗松素(25.451 min),17号峰为木犀草素(34.857 min),18号峰为芹菜素(40.278 min),19号峰为柚皮素(40.814 min)[25]。
根据以上22 个共有峰的相对峰面积,应用SPSS 22.0软件对各批次的高粱样品进行分析,形成25×22 阶数据矩阵,采用欧氏距离类平均法作为样品聚类依据。分析结果如图3所示。
当判别条件距离为10时,25 批高粱样品共聚为4 大类,其中,大部分红缨子高粱S1~S5、S7~S9及S11~S17在更小的判别距离上聚为一类,而S6和S10单独聚为一类,但二者在判别距离为20时仍能与其他红缨子高粱聚为一类。因此,通过聚类分析能将红缨子高粱与其他品种酿酒高粱明显区分开。
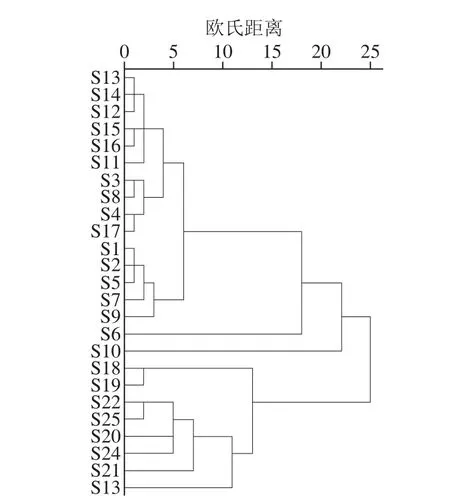
图 3 聚类分析结果Fig. 3 Results of hierarchical cluster analysis
2.4 主成分分析
应用SPSS 22.0软件对各共有峰峰面积进行标准化处理后,对25 批高粱样品指纹图谱所得的22 个共有峰进行主成分分析,求得相关矩阵的特征值及其方差,见表3。选取特征根大于1的前3 个因子,其累计方差贡献率达到84.383%,因此样本间内在的相互关系可较好地表现出来,可用于代替所有高粱样品指纹图谱22 个共有峰的大部分信息,故选取这3 个因子分别作为主成分1~3。

表 3 主成分特征值及方差Table 3 Eigenvalues and variance contribution rates of principal components
主成分载荷矩阵反映了各变量对主成分的贡献大小和贡献方向,见表4。在主成分1上,共有峰4~17和峰19、21有较高的正载荷,峰22有较高的负载荷,说明主成分1反映的主要为峰4~17、19和21中提取得到的综合信息。在主成分2中,峰1~3和峰20有较高载荷,说明主成分2主要受变量峰1~3、20影响。主成分3上峰18有较高的正载荷,峰1有较高的负载荷,故主成分3是由峰1和18所决定的。
对上述主成分载荷值进行计算,可得到各主成分的线性模型,将各样本数据带入模型,可得到各批次样品的主成分得分,如表5所示。主成分得分见图4,红缨子高粱样品S1~S5、S7~S8、S11~S17整体分布较为接近,说明各批次红缨子高粱质量比较接近,而S6、S9和S10分布位置相对较为独立,这与聚类的结果保持基本一致。从表5可看出,S6、S9和S10的综合主成分得分在所有样品中排名前三,因此推测多酚含量的差异导致其在聚类分析中未能与其他红缨子高粱样品聚在一类。此外,其他品种高粱均与红缨子高粱分布较远,同时红缨子高粱样品的综合主成分得分均高于其他品种高粱,因此可以与其他品种进行很好的区分。

表 4 共有峰化合物及主成分载荷矩阵Table 4 Loading matrix and principal components

表 5 样品主成分得分Table 5 Principal component scores and synthetic scores for 25 sorghum samples

图 4 不同品种高粱样品的主成分分析得分Fig. 4 PCA score plots for 25 sorghum samples
3 结 论
本研究发现,红缨子高粱提取物中最丰富的多酚化合物为花旗松素及其糖苷类化合物,与其他红皮高粱多酚化合物的研究基本一致[27]。不同品种高粱中多酚化合物含量和种类有显著差异,其中基因型、灌溉和温度是影响高粱多酚化合物差异的主要因素[28-30]。而研究也证明不同品种高粱多酚提取物具有不同的抗氧化活性[28],因此针对不同产地酿酒高粱品种中所含的多酚类化合物进行分析和品种区别,对酿酒高粱的综合利用具有积极意义。
本实验运用相似度分析、聚类分析和主成分分析对不同酿酒高粱样品中的多酚类化合物高效液相色谱指纹图谱进行分析。经过相似度评价发现,不同地区的红缨子高粱样品间相似度均大于0.97,说明不同地区种植的红缨子样品的质量相对稳定。对于其他酿酒高粱样品,在共有模式下与红缨子高粱的相似度均在0.90以下,说明其他品种酿酒高粱和红缨子高粱在多酚类化合物组成上存在较大的差异,可通过高效液相色谱指纹图谱将其与红缨子高粱区分开。
进一步通过聚类分析和主成分分析对指纹图谱进行综合评价。聚类分析发现,大部分红缨子高粱在较小判别距离上能单独聚为一类,从而与其他高粱品种区分开。而有个别红缨子高粱样品单独聚为一类,通过主成分分析发现,这些个别红缨子样品的得分明显高于其他红缨子样品,即该差异由多酚类含量差异导致。通过相似度评价结合聚类分析与主成分分析,能够有效且快速的将红缨子高粱与其他酿酒高粱品种区分开,为红缨子高粱的品种识别和质量监控提供新思路。
