C-5固醇去饱和酶ERG3对酿酒酵母耐盐性的影响
2020-04-25林卫潮李曜灵
王 慧,陈 雄,林卫潮,李曜灵,代 俊
(湖北工业大学生物工程与食品学院,发酵工程教育部重点实验室,湖北 武汉 430068)
在自然环境或工业环境中,微生物经常会面临各种胁迫,包括外界环境中的胁迫因素和微生物自身代谢过程中产生的代谢物对细胞的胁迫作用[1]。自然界中广泛存在Na+,高盐胁迫无论在食品还是在自然环境中都广泛存在[2]。
酵母耐盐性即酵母对高Na+浓度溶液的适应能力,是某些工业酵母所必需的特性之一[3]。溶液中的高浓度Na+会降低水分活度,限制酵母在自然和工业环境中的生长,并影响酵母的代谢水平。在高盐环境中,维持胞内相对低的Na+浓度与细胞膜的流动性息息相关[4]。质膜中固醇的比例、组成和结构是影响脂质膜和脂筏流动性的主要因素,固醇类型和含量的调控具有关键的生理调节作用[5],这对许多细胞活动(包括细胞分选、细胞骨架组织和交配)都很重要[6-7]。
研究表明,麦角固醇是酵母膜脂中的重要组分,主要合成途径如图1所示,而C-5固醇去饱和酶ERG3为合成过程中最关键的酶之一,对麦角固醇形成至关重要[8]。本实验通过构建敲除ERG3的菌株研究酵母固醇变化对其耐盐性的影响。
1 材料与方法
1.1 材料、试剂与培养基
野生酿酒酵母菌株Saccharomyces cerevisiaeBY4741(MATahis3Δ1 leu2Δ0 lys2Δ0 ura3Δ0),保藏于本实验室;工程菌株Bs-1采用Cre-loxP系统[9-10]通过同源重组方法敲除ERG3基因构建[11];过表达菌株Bs-2通过质粒pYES2游离表达BY4741的ERG3基因构建[12];Escherichia coliDH5α用于构建游离表达质粒。质粒pUG6、pSH47、pYES2均用于本研究菌株构建。
氨苄青霉素、卡那霉素、遗传霉素G418 广州赛国生物科技有限公司;PC11-2×Pfu聚合酶链式反应(polymerase chain reaction,PCR)Master Mix 北京艾德莱生物科技有限公司;HindIII 宝日医生物技术(北京)有限公司;D-半乳糖 上海麦克林生化科技有限公司;5-氟乳清酸 BBI生命科学有限公司;胆固醇(色谱级) 上海源叶生物科技有限公司;酵母DNA提取试剂盒 广州捷倍斯生物科技有限公司;质粒DNA小量试剂盒、PCR清洁试剂盒、DNA凝胶回收试剂盒 康宁生命科学(吴江)有限公司;一步法快速克隆试剂盒上海翊圣生物科技有限公司;其余试剂均为国产分析纯。
酵母菌株耐盐性验证采用酵母浸出粉胨半乳糖(yeast extract peptone galactose,YPG)诱导培养基(20 g/L半乳糖、20 g/L蛋白胨、10 g/L酵母提取物、相应含量NaCl、20 g/L琼脂);酵母菌株活化采用酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基(20 g/L葡萄糖、20 g/L蛋白胨、10 g/L酵母提取物);盐胁迫采用60 g/L NaCl-YPD培养基(20 g/L葡萄糖、20 g/L蛋白胨、10 g/L酵母提取物、60 g/L NaCl)用于摇瓶发酵;大肠杆菌质粒扩增采用LB培养基(10 g/L胰蛋白胨、5 g/L酵母提取物、10 g/L NaCl,NaOH调pH值至7.0),根据对应质粒加入相应抗生素;酵母质粒筛选采用尿嘧啶省却培养基(20 g/L葡萄糖、6.7 g/L不含氨基酸的细菌用酵母氮碱、2 g/L省却尿嘧啶混合物(微量的各种氨基酸混合物));酵母质粒pSH47丢失筛选采用5-氟-乳清酸筛选培养基(20 g/L葡萄糖、6.7 g/L不含氨基酸的细菌用酵母氮碱、2 g/L省却尿嘧啶的混合物(微量的各种氨基酸混合物)、50 μg/mL尿嘧啶、1 g/L 5-FOA、20 g/L琼脂)。
1.2 仪器与设备
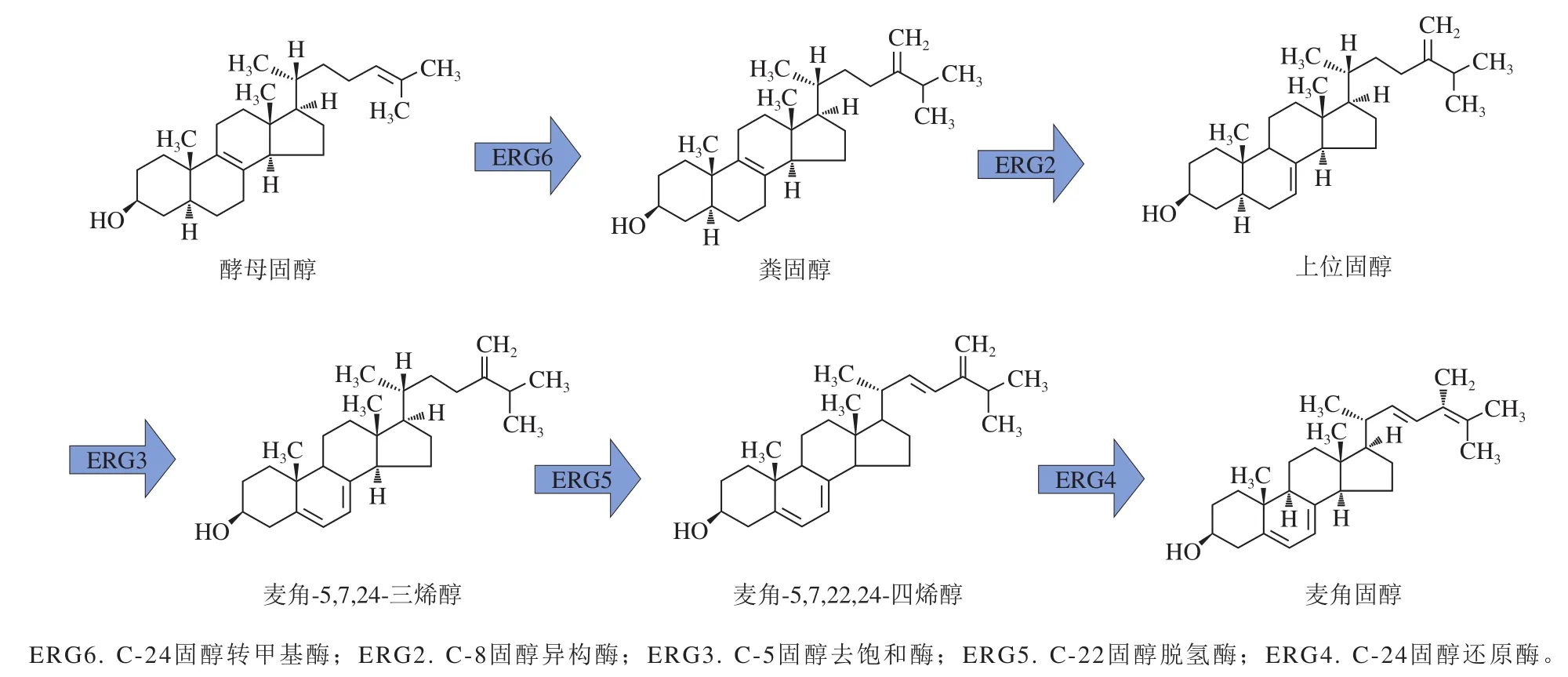
图 1 麦角固醇合成步骤Fig. 1 Synthetic pathway of ergosterol
WFJ2000型可见分光光度计 尤尼柯(上海)仪器有限公司;7890B型气相色谱 赛默飞世尔科技(中国)有限公司;YXQ-LS-100S II型高压蒸汽灭菌锅上海博讯实业有限公司;5810R型高速冷冻离心机、PCR仪德国Eppendorf公司;DYY-6C型电泳仪 北京市六一仪器厂;SBA-90型生物分析传感仪 山东省科学院生物研究所;气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用仪 美国Agilent公司。
1.3 方法
1.3.1 敲除菌株Bs-1的构建
ERG3敲除所用引物见表1,由上海生物工程有限公司合成,构建ERG3基因敲除盒步骤如下:1)以S. cerevisiaeBY4741的DNA为模板,以ERG3-UF和ERG3-UR为引物进行PCR扩增构建上游同源臂,以ERG3-DF和ERG3-DR为引物进行PCR扩增构建下游同源臂;2)以质粒pUG6的DNA为模板,以kanMX-f和kanMX-r为引物进行PCR扩增,获得PCR产物loxP-kanMX-loxP;3)以ERG3-UF和ERG3-DR为引物,以上述3 种PCR产物为模板,通过融合PCR构建ERG3基因敲除盒[9-10]。

表 1 本实验所用引物Table 1 Sequences of primers used in this experiment
利用LiAc转化法[13-14]将获得的ERG3基因敲除盒转化到S. cerevisiaeBY4741感受态细胞中,涂布含100 μg/mL G418的YPD平板上,30 ℃培养2~4 d。挑选单菌落转移到含100 μg/mL G418的液体YPD中,30 ℃培养2 d进行菌落PCR,扩增结果送南京金唯智公司测序验证,获得转化成功的重组菌株(ERG3::kanMX)。
为防止kanMX筛选标记表达对菌株的代谢产生影响,构建菌株时将kanMX筛选标记删除。将本实验室保藏的pSH47质粒[15]用LiAc转化法转化到重组菌株(ERG3::kanMX)感受态细胞中,利用尿嘧啶省却平板筛选阳性克隆子。阳性菌落利用YPG培养基诱导pSH47质粒中的Cre酶表达,删除kanMX抗性筛选标记。再利用5-氟-乳清酸平板,筛选pSH47质粒丢失重组菌株[16]。通过尿嘧啶省却液体培养基验证pSH47质粒丢失成功。
1.3.2 过表达菌株Bs-2的构建
将本实验室保藏的pYES2质粒[12]用HindIII酶切线性化;用表1中pYES2 UF和pYES2 UR为引物,以S. cerevisiaeBY4741的DNA为模板,采用PCR扩增ERG3基因。用一步法快速克隆试剂盒将线性化的pYES2质粒DNA和ERG3基因连接,构建重组质粒pYES2-ERG3[17]。利用LiAc转化法将重组质粒转化到S. cerevisiaeBY4741感受态细胞。同样利用尿嘧啶省却液体培养基筛选转化成功的过表达菌株。
1.3.3 菌株的耐盐性验证
BY4741、Bs-1、Bs-2活化菌液按10%接种量接种到5 mL的YPD液体培养基中,置于28 ℃、200 r/min的恒温摇床中培养至OD600nm均为3.0。再将每种菌株的菌液用无菌水稀释成4 个梯度,即稀释10、50、250、1 250 倍。将每种菌株的每个梯度菌液取0.8 μL点在YPG平板上,于28 ℃培养,每天观察它们的生长状态并拍照。所有实验重复至少3 次,并显示代表性结果。
1.3.4 菌株生理特性的测定
BY4741和Bs-1接种于YPD、60 g/L NaCl-YPD培养基,28 ℃、200 r/min的恒温培养。菌液样品于5 000 r/min、4 ℃离心10 min,上清液和菌体保存于-20 ℃,用于生理特性测定。
菌体烘干12 h计数菌体干质量浓度,菌体干质量浓度/(g/L)=菌体干质量/菌液体积。OD600nm用可见光分光光度计检测[2]。葡萄糖含量用二硝基水杨酸法测定[18]。乙醇含量用生物传感仪测定[19]。乙酸用气相色谱测定,检测条件为:安捷伦7890B,火焰离子化检测器;Agilent HP-5毛细管柱(30 m×320 μm,0.25 μm);程序升温条件:40 ℃保留时间5 min,后以20 ℃/min升到120 ℃,再以10 ℃/min升到220 ℃,220 ℃保留时间6 min;分流比10∶1,分流流量50 mL/min,进样口温度250 ℃,检测器280 ℃,进样体积1 μL。甘油浓度用甘油试剂盒(北京普利莱基因技术有限公司)测定,比甘油产率/(mmol/g)=甘油浓度/菌体干质量浓度。
1.3.5 固醇分析
将BY4741、Bs-1、Bs-2菌株接种到YPD、60 g/L NaCl-YPD培养基中,28 ℃、200 r/min培养至稳定期。将菌液于4 ℃、5 000 r/min离心10 min,弃上清液,菌体用去离子水水洗2 次,于液氮罐中速冻,再置于-80 ℃冰箱冰冻24 h,于冷冻干燥机中制成冻干菌粉。称取20 mg冻干菌粉,加入7 mL溶剂(甲醇-异丙醇1∶1)、50 μg色谱级胆固醇内标和0.5 μm的玻璃珠涡旋破碎10 min,4 ℃、5 000 r/min离心10 min,将上清液转到旋转蒸发仪中,转速100 r/min、40 ℃水浴蒸发约2 min,浓缩为约1 mL的溶液,0.2 μm的有机滤膜过滤,进样到GC-MS检测。
GC-MS检测条件:7890/5977 GC-MS系统;HP-5 ms色谱柱(30 m×0.25 mm,0.25 μm);程序升温条件:GC-炉温度以5 ℃/min从180 ℃(2 min)至300 ℃(4 min);载气流速1 mL/ min,进样量1 μL,界面温度250 ℃,离子源温度230 ℃,电子碰撞电离70 eV,全扫描范围m/z30~550,溶剂延迟3.5 min[20]。目标化合物的峰识别基于国家标准和技术研究所(NIST 14)数据库。
1.4 数据统计
摇瓶实验做3 次重复,并计算标准偏差,用Origin 9.0软件作图。固醇含量和比甘油产率进行3 次测定,运用GraphPad Prism 5.0软件进行计算。
2 结果与分析
2.1 工程菌株的获得
2.1.1kanMX同源敲除ERG3基因
利用引物对ERG3-UF和ERG3-DR,分别以野生型S. cerevisiaeBY4741 DNA和重组菌株(ERG3::kanMX)DNA为模板进行PCR扩增。如图2所示,野生型菌株的扩增产物为2 497 bp,重组菌株(ERG3::kanMX)的扩增产物为2 960 bp。

图 2 kanMX敲除菌株的PCR验证Fig. 2 PCR validation of knockout strain with kanMX markers
2.1.2kanMX筛选标记的删除
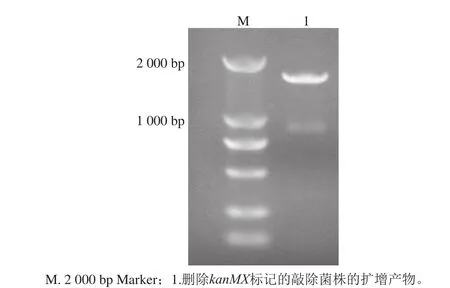
图 3 删除kanMX标记的敲除菌株的PCR验证Fig. 3 PCR validation of knockout strain with kanMX markers being deleted
以Bs-1菌株的DNA为模板,以引物对ERG3-UF和ERG3-DR进行PCR扩增。Bs-1的扩增产物为1 500 bp(图3)。
2.1.3 过表达菌株的验证
利用一步法克隆试剂盒将ERG3和pYES2质粒连接成重组质粒,转化到野生型S. cerevisiaeBY4741中,构建过表达菌株Bs-2。从构建成功的过表达菌株中,提取pYES2质粒DNA,用HindⅢ酶切验证,得到2 个条带,分别为1 097 bp的ERG3基因条带和5 900 bp的线性化pYES2质粒DNA条带(图4)。
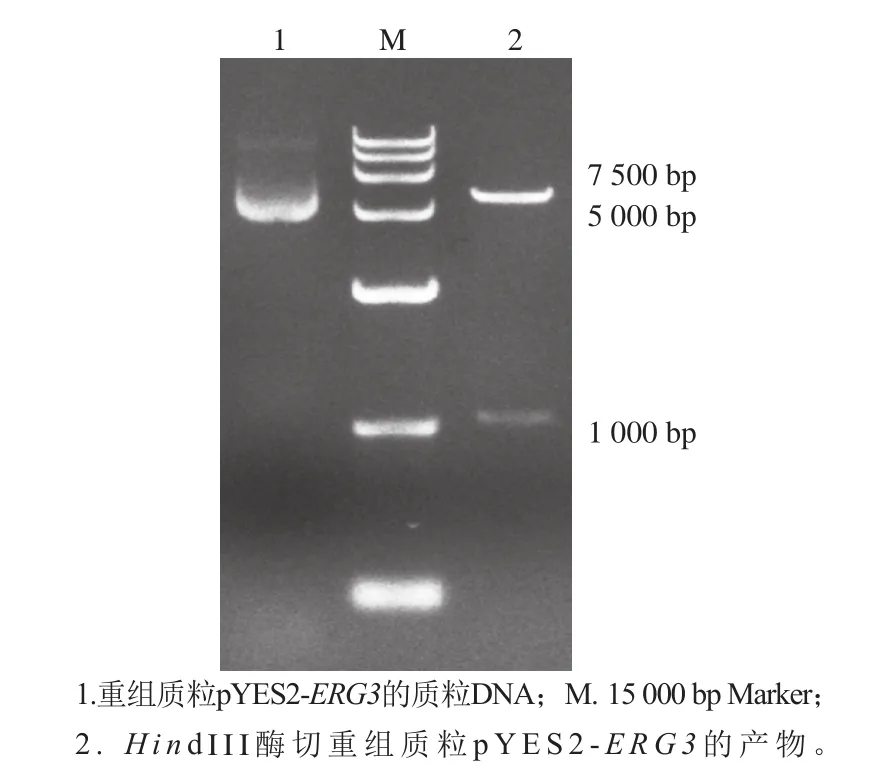
图 4 过表达菌株的PCR验证Fig. 4 PCR validation of overexpressing strains
2.2 菌株的耐盐性平板验证
如图5a所示,在YPG平板上,3 个菌株的生长状态良好且各稀释梯度的菌落大小基本相同。在60 g/L NaCl-YPG培养基中,BY4741、Bs-2均生长良好,但Bs-1的生长状态较差且随稀释梯度菌落生长不明显;在80 g/L NaCl-YPG培养基中,BY4741和Bs-2均能生长,但Bs-1基本不生长,在高稀释倍数下几乎观察不到菌落。由此可见,Bs-1的耐盐性与野生菌株BY4741相比,耐盐性能明显下降。Bs-2与野生菌株BY4741相比,在所有盐质量浓度条件下生长状态基本一致。

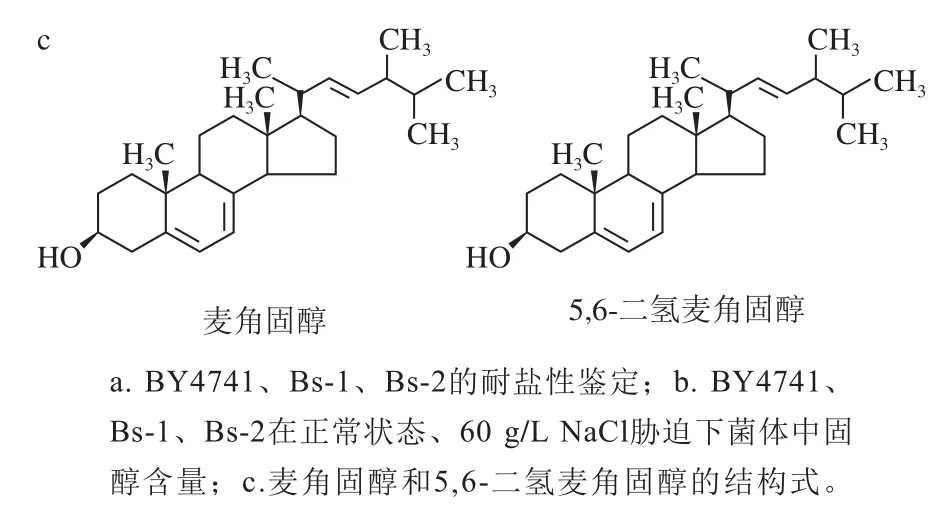
图 5 构建菌株的进一步验证Fig. 5 Further verification of the constructed strain
2.3 固醇分析
用GC-MS测定各菌株中固醇含量,如图5b所示,从这些菌株中主要检测出了两种固醇麦角固醇和5,6-二氢麦角固醇。Bs-1中没有产生麦角固醇,却产生了新固醇5,6-二氢麦角固醇,结构如图5c所示。上述结果主要因为ERG3是麦角固醇合成过程中关键的去饱和酶,ERG3基因的敲除导致麦角固醇的前体物质粪固醇的C-5和C-6不能脱氢形成双键,只能生成中间物5,6-二氢麦角固醇。在60 g/L NaCl-YPD下,Bs-1菌株合成5,6-二氢麦角固醇的量为(6.30±0.40)μg/mg,略高于无胁迫条件下(5.89±0.04)μg/mg。BY4741在YPD和60 g/L NaCl-YPD中,产生的麦角固醇量相当,为(3.50±0.50)μg/mg(图5b)。Bs-2菌株在YPD下,产生的麦角固醇量为(3.30±0.10)μg/mg,和BY4741相当。工程菌株Bs-1敲除了ERG3基因,不能合成麦角固醇,其耐盐性明显下降。由此可见,酵母的耐盐特性可能主要与固醇种类相关。
2.4 菌株的生理特性
由于工程菌Bs-2与BY4741在耐盐性方面的表现相似,所以后期只取BY4741和耐盐能力减弱的工程菌Bs-1在YPD和60 g/L NaCl-YPD中摇瓶发酵,检测其代谢特性。如图6所示,BY4741在YPD中的最大OD600nm为13.90±0.02,在60 g/L NaCl-YPD中的最大OD600nm为10.19±0.13,它在无胁迫条件下的最大OD600nm是盐胁迫条件下的1.36 倍,表明盐胁迫会使菌株的生长能力变弱,菌株需要消耗自身生长的部分能量用于对抗盐胁迫。在60 g/L NaCl-YPD和YPD条件下,BY4741的乙醇产量都随生长曲线的趋势而增加,至稳定期不再增加,保持稳定。但BY4741在YPD中的乙醇最高产量为(10.75±0.25)g/L,在60 g/L NaCl-YPD中的乙醇最高产量为(6.50±0.00)g/L,它在无胁迫下的最高乙醇产量是盐胁迫条件的1.65 倍。在YPD培养基中,BY4741的乙酸产量与糖耗趋势保持一致,葡萄糖7 h耗完,乙酸产量也在第7小时不再下降,保持稳定。在60 g/L NaCl-YPD条件下,BY4741 13 h葡萄糖基本耗完,耗时比在YPD中多1 倍,而乙酸产量保持在0.48~0.75 g/L范围内波动。在盐胁迫下,BY4741的生长明显变缓慢,糖耗减慢,生长周期延长,乙醇产量降低,生长受到抑制。
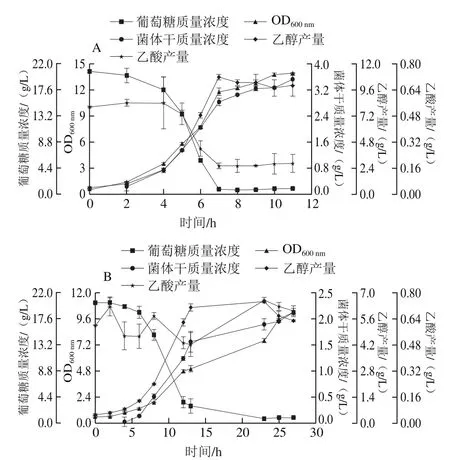
图 6 BY4741在YPD(A)和60 g/L NaCl-YPD(B)培养基中生理特性Fig. 6 Physiological characteristics of BY4741 when cultured in YPD (A) and YPD (B) with 60 g/L NaCl
Bs-1菌株在YPD培养基中的最大OD600nm为11.4±0.14,在60 g/L NaCl-YPD培养基中的最大OD600nm为5.56±0.30,它在无胁迫条件下的最大OD600nm是盐胁迫的2.06 倍。进一步证明,Bs-1比BY4741的耐盐性能差,并且应对盐胁迫的滞后期更长。Bs-1在有或无盐胁迫条件下,乙醇产生的趋势也与生长趋势一致。Bs-1在YPD中的最高乙醇产量为(5.90±0.10)g/L,在60 g/L NaCl-YPD中的最高乙醇产量为(4.20±0.00)g/L,Bs-1在无盐胁迫下的最高乙醇产量均低于盐胁迫下BY4741的最高乙醇产量,表明ERG3的敲除对酿酒酵母的乙醇产量也有一定的影响。在无胁迫条件下,Bs-1的乙酸产量与糖耗趋势一致。在盐胁迫条件下,Bs-1的乙酸产量在0.52~0.77 g/L范围内波动,没有明显的增加或减少趋势,如图7所示。Bs-1在YPD中的生长状态相比于BY4741有所减弱,乙醇产量明显降低;Bs-1在60 g/L NaCl-YPD中的生长状态更差,相比于YPD中,生物量降低一半,乙醇产量进一步降低。
野生菌株BY4741和工程菌株Bs-1在60 g/L NaCl-YPD中时,生长均受到抑制。在60 g/L NaCl-YPD中,BY4741的最大OD600nm为10.19±0.13,Bs-1的最大OD600nm为5.56±0.30,BY4741的最大OD600nm是Bs-1的1.83 倍;BY4741的最高乙醇产量为(6.50±0.00)g/L,Bs-1的最高乙醇产量为(4.20±0.00)g/L,BY4741的最高乙醇产量是Bs-1的1.55 倍;BY4741的乙酸产量保持在0.48~0.75 g/L范围内,Bs-1的乙酸产量在0.52~0.77 g/L范围内。
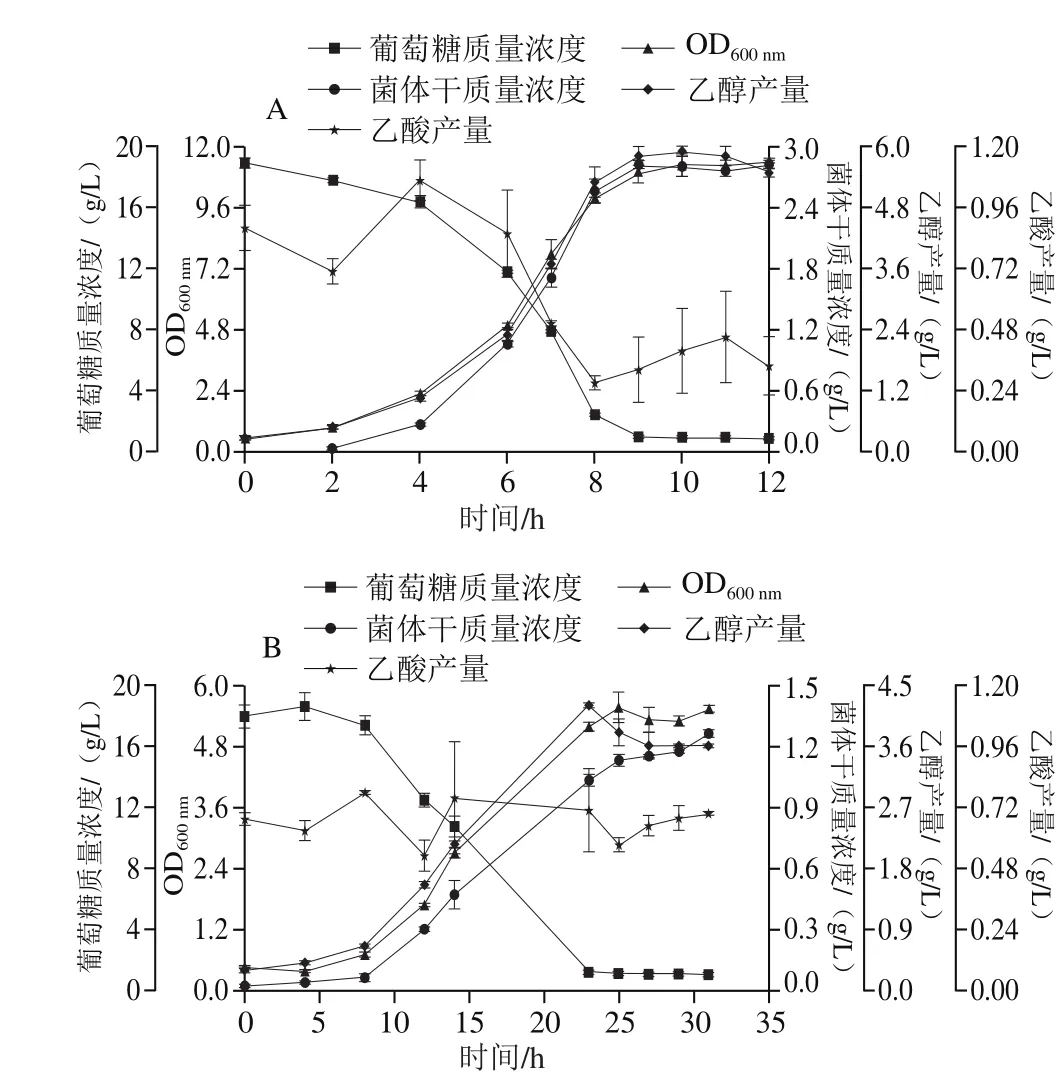
图 7 Bs-1在YPD(A)和60 g/L NaCl-YPD(B)培养基中的生理特性Fig. 7 Physiological characteristics of Bs-1 when cultured in YPD (A) and YPD (B) with 60 g/L NaCl
2.5 甘油的积累和保留
甘油是酵母应对盐胁迫产生的主要的渗透调节物,它能保持胞内水平衡、稳定酶系统正常代谢功能以及恢复正常细胞容积。Herrera等[21]研究发现汉逊酵母主要通过产生甘油作为渗透调节物和将Na+隔离在液泡中两种策略应对盐胁迫。在盐胁迫下,为确保高浓度的胞内渗透调节物,酵母细胞会采取调整细胞周期,限制氧化还原元素和能耗的方式实现。测定酵母在YPD和60 g/L NaCl-YPD中胞内外比甘油产率(图8)。在YPD中,BY4741在指数期和稳定期产生的胞内比甘油产率分别为(0.015 4±0.000 1)mmol/g和(0.007 0±0.000 8)mmol/g;BY4741在指数期和稳定期产生的胞外比甘油产率分别为(0.110 0±0.002 0)mmol/g和(0.064 0±0.002 0)mmol/g。在YPD中,Bs-1在指数期和稳定期产生的胞内比甘油产率分别为(0.008 0±0.001 8)mmol/g和(0.011 8±0.000 1)mmol/g;Bs-1在指数期和稳定期产生的胞外比甘油产率分别为(1.260 0±0.060 0)mmol/g和(1.250 0±0.010 0)mmol/g。在无盐胁迫条件下,BY4741和Bs-1产生的胞外比甘油产率均高于胞内比甘油产率,因此酿酒酵母对甘油的保留能力较差,大部分甘油都被外排到培养基中。在YPD培养基中,BY4741产生的总比甘油产率在指数期约为0.125 0 mmol/g,稳定期约为0.071 0 mmol/g;Bs-1产生的总比甘油产率在指数期约为1.268 0 mmol/g,稳定期约为1.260 0 mmol/g。由此可见,Bs-1在无盐胁迫条件下产生的甘油量比BY4741高。
在60 g/L NaCl-YPD中,BY4741在指数期和稳定期的胞内比甘油产率分别为(0.228 0±0.009 0)mmol/g和(0.165 0±0.005 0)mmol/g;BY4741在指数期和稳定期产生的胞外比甘油产率分别为(8.900 0±1.100 0)mmol/g和(6.750 0±0.250 0)mmol/g。在60 g/L NaCl-YPD中,Bs-1在指数期和稳定期产生的胞内比甘油产率分别为(0.200 0±0.040 0)mmol/g和(0.076 0±0.010 0)mmol/g;Bs-1在指数期和稳定期产生的胞外比甘油产率分别为(24.500 0±3.500 0)mmol/g和(13.100 0±0.100 0)mmol/g。在盐胁迫下,BY4741和Bs-1产生比YPD中更多的甘油响应盐胁迫;在指数期和稳定期,Bs-1产生的总比甘油产率比BY4741更多,但大部分为胞外,胞内甘油浓度低于BY4741。
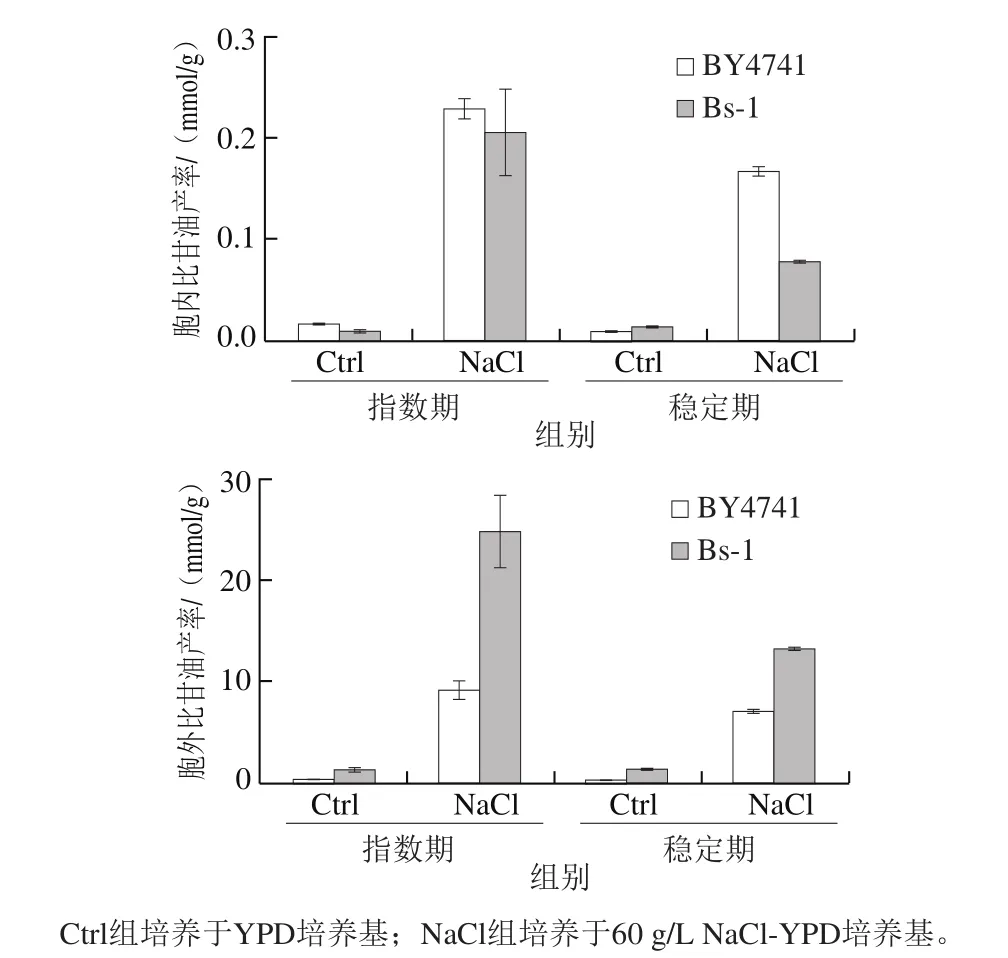
图 8 菌株胞内外比甘油产率Fig. 8 Ratio between intracellular and intracellular glycerol production
3 讨 论
本研究主要探索酵母麦角固醇与其耐盐性之间的关系,构建了2 个工程菌株Bs-1(敲除菌株)和Bs-2(过表达菌株)。测定菌株的固醇种类和含量,发现Bs-2和BY4741的固醇种类和含量相近,Bs-1不能合成麦角固醇,却合成了新固醇5,6-二氢麦角固醇。前期研究普遍认为麦角固醇合成最后几步反应为图1所示的线性过程[22],近年来也有证据表明其中某些反应可能不是严格线性进行的[5,23]。因此,构建的ERG3缺失突变株Bs-1通常会被认为积累上位固醇或其“上游”产物粪固醇,并阻断“下游”酶ERG5和ERG4的功能[24]。但实际结果却是ERG3的敲除并没有影响酶ERG5和ERG4的活性,最后生成并积累了新的产物5,6-二氢麦角固醇。这可能是因为相关酶的底物特异性相对较弱,导致麦角固醇最后几步合成具有了很高的灵活性。
对3 个菌株(BY4741、Bs-1、Bs-2)的耐盐性进行鉴定,发现Bs-1的耐盐性明显变差。研究表明细胞膜中固醇的比例、种类、结构都会影响细胞膜的流动性[25],敲除菌株Bs-1细胞膜中固醇种类发生了变化,导致细胞膜流动性的改变,影响菌株对盐胁迫的耐受性。
酵母盐胁迫适应性与细胞代谢过程密切关联,其中氧化还原平衡是关键因素之一。在盐胁迫条件下,胞外渗透压的升高会引起S. cerevisiae胞质中NADH含量增加,乙醇减少,乙醛增加,导致酵母通过HOG途径提高甘油生成量[26-27]。测定BY4741和Bs-1菌株在YPD和60 g/L NaCl-YPD中的生理性状,发现60 g/L的NaCl对BY4741和Bs-1的生长都造成了影响,但Bs-1受到的胁迫影响最大。在YPD培养基中,BY4741的生长状态优于Bs-1,菌体干质量浓度、乙醇产量都比Bs-1高,糖耗数率也较快。BY4741在60 g/L NaCl-YPD中的生长状态与Bs-1在YPD培养基中的生长状态相似。Bs-1在60 g/L NaCl-YPD中的生长严重受到胁迫,生物量、乙醇产量都较低。盐胁迫条件下,BY4741和Bs-1乙酸含量无明显变化。进一步测定BY4741和Bs-1在YPD和60 g/L NaCl-YPD中指数期和稳定期胞内外比甘油产率,发现在YPD中,BY4741和Bs-1产生的比甘油产率不高,大部分甘油被外排到培养基中,甘油保留能力差。在盐胁迫下,Bs-1在指数期和稳定期都比BY4741产生更多的甘油,并将大部分甘油排出胞外,导致BY4741的胞内比甘油产率高于Bs-1,这可能是BY4741比Bs-1更耐盐的原因。甘油的保留能帮助细胞在面对盐胁迫时阻止胞内水分外流,但甘油是一种脂溶性物质,它有透过脂膜的趋势,能通过被动扩散穿过生物膜,所以保留甘油是一种生物调节过程。细胞膜的流动性是影响甘油保留的重要因素之一,而构成细胞膜组成成分和比例又决定了膜的流动性[28],ERG3基因的敲除使细胞膜的主要固醇种类由麦角固醇转变为5,6-二氢麦角固醇,这种改变增加了膜的流动性,使甘油通透性增强,Bs-1虽在盐胁迫条件下合成了大量的甘油,但胞外甘油量比野生菌株BY4741多。此外,通过特定的转运蛋白运输甘油进入细胞是甘油保留另外一种途径。主要分为两种形式:低亲和性转运系统(协助运输)和高亲和性质子同向转运系统(主动运输),但它们的活性常会被高浓度盐抑制[29-30]。因此,菌株Bs-1在盐胁迫条件下虽然产生了大量甘油,但对甘油的保留能力减弱,导致细胞耐盐能力降低。
4 结 论
本实验通过构建酿酒酵母麦角固醇C-5去饱和酶ERG3的基因缺失突变株、耐盐性平板验证、固醇分析、生理特性测定,结果发现,突变株的盐胁迫抗性减弱,不能合成麦角固醇,而合成了5,6-二氢麦角固醇,且盐胁迫条件下甘油合成总量增加,胞内甘油含量降低,乙醇合成减少,乙酸合成增多,滞后期延长,生长状态减弱。综上所述,ERG3的敲除导致菌株质膜的固醇组成改变,影响包括甘油保留在内的一系列菌株表型特征,致使菌株盐胁迫抗性减弱。由此可见,C-5去饱和酶ERG3与酵母细胞膜固醇组分和菌株耐盐性息息相关,证明了固醇在酵母细胞应对盐胁迫环境中所起的重要作用,并为工程化固醇组分提高工业酵母菌株鲁棒性提供了理论支持。
