大豆种子分泌物中蛋白质鉴定及其对大豆疫霉的趋化作用
2020-04-24文景芝赵钰琦高新颖张卓群吴羚阁贾梦瑱
文景芝,赵钰琦,高新颖,张卓群,吴羚阁,贾梦瑱
(东北农业大学农学院,哈尔滨 150030)
大豆疫霉(Phytophthora sojaeKauf.&Gerd.)是大豆(Glycine maxL.)生产中最具破坏性的植物病原生物之一,引起大豆疫霉根腐病,严重限制大豆产业发展并产生巨大损失[1]。大豆疫霉是土传病原卵菌,寄主范围窄,自然条件下仅侵染大豆,其他条件下也侵染羽扇豆(Lupinus micranthusGuss)[2]。防治大豆疫霉根腐病最有效方法是选育抗病品种,因此了解大豆抗病机制尤为重要。
种子分泌物在种子际中发挥重要作用。种子分泌物瞬时释放在很大程度上控制种子际病原物群落动态变化,对种子际病原物生长和发育产生重要影响[3]。种子分泌物是天然的生物活性化合物,由复杂的混合物组成,包括糖类、氨基酸类、黄酮类、酚酸类,还有一些肽类和蛋白质等。研究表明,种子分泌物中的营养物质如氨基酸和糖为病原物生长和孢子萌发提供能量,促进病原物侵染寄主[4]。而其中一些肽类、蛋白质和次生代谢物质抑制土传病原物活性从而阻止其侵染,与植物抗病性有关[5]。
种子分泌物对病原物的抑制作用研究较多,如羽扇豆种子分泌物中几丁质酶可有效抑制病原真菌生长[6];豇豆(Vigna unguiculata)种子分泌物中鉴定得到抗真菌蛋白如β-1,3 葡聚糖酶、胱蛋白、豌豆球蛋白和脂转移蛋白[7];大豆分泌大量蛋白酶抑制剂和其他蛋白质,在大豆防御病原物过程中有潜在作用。已报道大豆种子分泌物中蛋白质包括凝集素、胰蛋白酶抑制剂和脂氧合酶等对南方根结线虫(Meloidogyne incognita)有防御活性[5]。但大豆种子分泌物中蛋白质对大豆疫霉防御作用尚不清楚。
本试验将利用LC/MS-MS技术鉴定大豆抗、感品种接种前后种子分泌物中蛋白质种类,重点比较大豆疫霉接种后诱导表达的差异蛋白。通过测定大豆抗、感品种接种前后种子分泌物中蛋白质对大豆疫霉游动孢子趋化性、成囊、萌发的影响,明确其防御活性。本研究有助于了解大豆种子分泌物中蛋白质在大豆疫霉防御中的作用,鉴定抗病相关蛋白,为利用寄主抗病性防治大豆疫霉根腐病提供理论依据。
1 材料与方法
1.1 材料
增强型绿色荧光蛋白标记大豆疫霉菌株Eps597-3,致病型为1a, 3c, 7。大豆感病品种Sloan,不含任何已知抗大豆疫霉根腐病基因,可被大豆疫霉任何生理小种侵染;大豆抗病品种Williams 82,含有Rps1k基因,对供试菌株Eps597-3表现抗病。
1.2 游动孢子悬浮液制备
参照文景芝等方法[8]。
1.3 收集种子分泌物
接种前收集种子分泌物:选取饱满、无破损的2个供试品种种子各10 g,具体操作参照文景芝等方法[8]。
接种后收集种子分泌物:方法与接种前大致相同,但在25 ℃黑暗条件下吸胀12 h 后补加游动孢子悬浮液(浓度为1 g 种子对应1 mL 游动孢子悬浮液),继续在黑暗条件下浸泡36 h,移出种子,期间补加超纯水至10 mL,收集种子分泌物溶液并过滤除菌。
1.4 种子分泌物中蛋白质提取
采取硫酸铵沉淀法提取蛋白质[9],蛋白质沉淀经过透析除盐后测定活性。采用MWCO3500 透析袋,透析48 h(4 ℃)。
1.5 种子分泌物中蛋白质对大豆疫霉游动孢子趋化性的影响
趋化性试验参照Suo等方法[10]。取充满2 μL蛋白质溶液(10 mL 种子分泌物中提取出的蛋白质沉淀,回溶于50 mL超纯水中,使其相对浓度为1:5)的毛细管插入趋化性测定室一端,另一端插入充满2 μL 超纯水的毛细管为对照。记录5、15、25 min时两只毛细管中游动孢子数量,观察大豆疫霉游动孢子对种子分泌物中蛋白质的趋化性。试验时室内温度25 ℃,各处理3次技术重复,试验3次生物学重复。
1.6 种子分泌物中蛋白质对大豆疫霉游动孢子成囊的影响
取新鲜孢子悬浮液300 μL 加入离心管中,向离心管中加入蛋白质溶液200 μL(10 mL 种子分泌物中提取蛋白质沉淀回溶于20 mL超纯水中,使其相对浓度为1:2)混合均匀。取100 μL 加入凹玻片中,以等量超纯水为空白对照。记录0.5、1、2 h时各处理游动孢子成囊率。各处理3 次技术重复,试验3次生物学重复。
1.7 种子分泌物中蛋白质对大豆疫霉孢囊萌发的影响
孢囊萌发试验参照文景芝等方法[8]。向游动孢子悬浮液中加入蛋白质溶液250 μL(终浓度与试验1.6 相同),以等量超纯水为空白对照。分别记录8、9、10 h时各处理孢囊萌发率。各处理3次技术重复,试验3次生物学重复。
1.8 LC-MS/MS质谱鉴定
1.8.1 酶解
蛋白质酶解参考Katayama等方法[11]。
1.8.2 质谱操作及数据库检索
Nano-RPLC Buffer A 溶解多肽样品。在线Nano-RPLC 液相色谱在Eksigent nanoLC-UltraTM2D系统(AB SCIEX)完成,2 μL·min-1流速上样C18预柱上(100 μm×3 cm,C18,3 μm,150 Å),保持流速冲洗脱盐10 min。分析柱为C18反相色谱柱(75 μm×15 cm C18-3 μm 120 Å, ChromXP Eksigent),试验所用梯度为90 min 内流动相B 由5%升至35%。质谱采用TripleTOF5600 系统(AB SCIEX)结合纳升喷雾III 离子源(AB SCIEX,USA),喷雾电压为2.5 kV,气帘气压为30 PSI,雾化气压为5 PSI,加热器温度为150 ℃,质谱扫描方式为信息依赖采集工作模式(IDA,Information Dependent Analysis),一级TOF-MS单张图谱扫描时间为250 ms,每次循环时间固定为2.5 s,碰撞室能量设定适用于所有前体离子碰撞诱导解离(CID),动态排除设置为18 s。数据处理采用Mascot 2.3 软件(Matrix Science),数据库为NCBI 数据库,允许最大漏切位点为2;固定修饰为:Carbamidomethyl(C);可变修饰为:Acetyl(Protein N-term)、Deamidated(NQ)、Dioxidation(W)、Oxidation(M)、Phospho(ST)和Phospho(Y);MS 容差为±15 ppm,MSMS 容差为±0.15 u,Protein score C.I.%大于95%为鉴定成功。
1.9 数据处理与统计分析
采用Excel 2016(Microsoft Corporation,Washington D.C,USA)和SPSS 25.0 处理数据并统计分析。各试验3次生物学重复数据作平均值及方差分析。
2 结果与分析
2.1 大豆种子分泌物中蛋白质对大豆疫霉游动孢子的趋化作用
接种前大豆感病品种Sloan 种子分泌物中蛋白质显著吸引大豆疫霉游动孢子,接种后却转而排斥大豆疫霉游动孢子。大豆抗病品种WillIams 82接种前后种子分泌物中蛋白质均对大豆疫霉游动孢子产生排斥作用,且接种后排斥作用更强,但差异不显著(见图1A)。
2.2 大豆种子分泌物中蛋白质对大豆疫霉游动孢子成囊的影响
大豆感病品种Sloan 接种前后种子分泌物中蛋白质均促进大豆疫霉游动孢子成囊,且接种后促进作用显著增强,特别是处理0.5 h 时,促进指数高达9.3,显著高于其他时段。大豆抗病品种Williams 82 接种前后种子分泌物中蛋白质均抑制游动孢子成囊,且接种前后无明显差异(见图1B)。
2.3 大豆种子分泌物中蛋白质对大豆疫霉游动孢子萌发的影响
大豆抗病品种Williams 82 接种前后种子分泌物中蛋白质均抑制大豆疫霉游动孢子萌发,且接种前后萌发促进指数在处理8 和9 h 时差异显著。大豆感病品种Sloan 接种前后种子分泌物中蛋白质对游动孢子萌发的影响不同,接种前促进而接种后抑制游动孢子萌发,且抑制强度显著高于抗病品种Williams 82。接种前感病品种Sloan 种子分泌物中蛋白质对游动孢子萌发的促进作用在处理10 h时骤然减弱,其萌发促进指数趋近于0(见图1C)。
2.4 大豆种子分泌中蛋白质种类数量
经LC-MS/MS鉴定,大豆抗病品种Williams 82接种后种子分泌物中蛋白质种类较接种前有所减少;大豆感病品种Sloan 接种后种子分泌物中蛋白质种类较接种前增加26种。大豆感病品种Sloan接种前种子分泌物中蛋白质种类多于抗病品种(见图2A、B、C)。
2.5 大豆抗、感品种接种前种子分泌物中差异蛋白
LC-MS/MS 鉴定结果表明,与抗病品种Williams 82相比,大豆感病品种Sloan接种前种子分泌物中存在191种差异蛋白,其中68个蛋白质有注释功能。根据蛋白质功能分为14类:催化活性(14种);水解酶活性(7种);抗氧化活性(2 种);新陈代谢(9 种);氧化还原活性(1 种);贮藏蛋白(1种);细胞分裂及分化(4种);酶调节活性(13种);信号转导(2 种);转录因子(1 种);启动因子(2种);转运蛋白(3种);抗逆性(6种);防御活性(3种)。其中紫色酸性磷酸酶具有多种功能,影响植物抗逆境、抗衰老、细胞发育和代谢等过程[12];大豆基因组中发现编码NDPKⅠ的片段,其参与植物生长发育、感病应激、非生物胁迫和激素响应[13]。此外,鉴定出3 种与植物防御活性相关的蛋白质:类葡聚糖β-1,3-葡萄糖苷内切酶5、类β-葡糖苷酶18和多聚半乳糖醛酸酶抑制剂蛋白(见表1)。
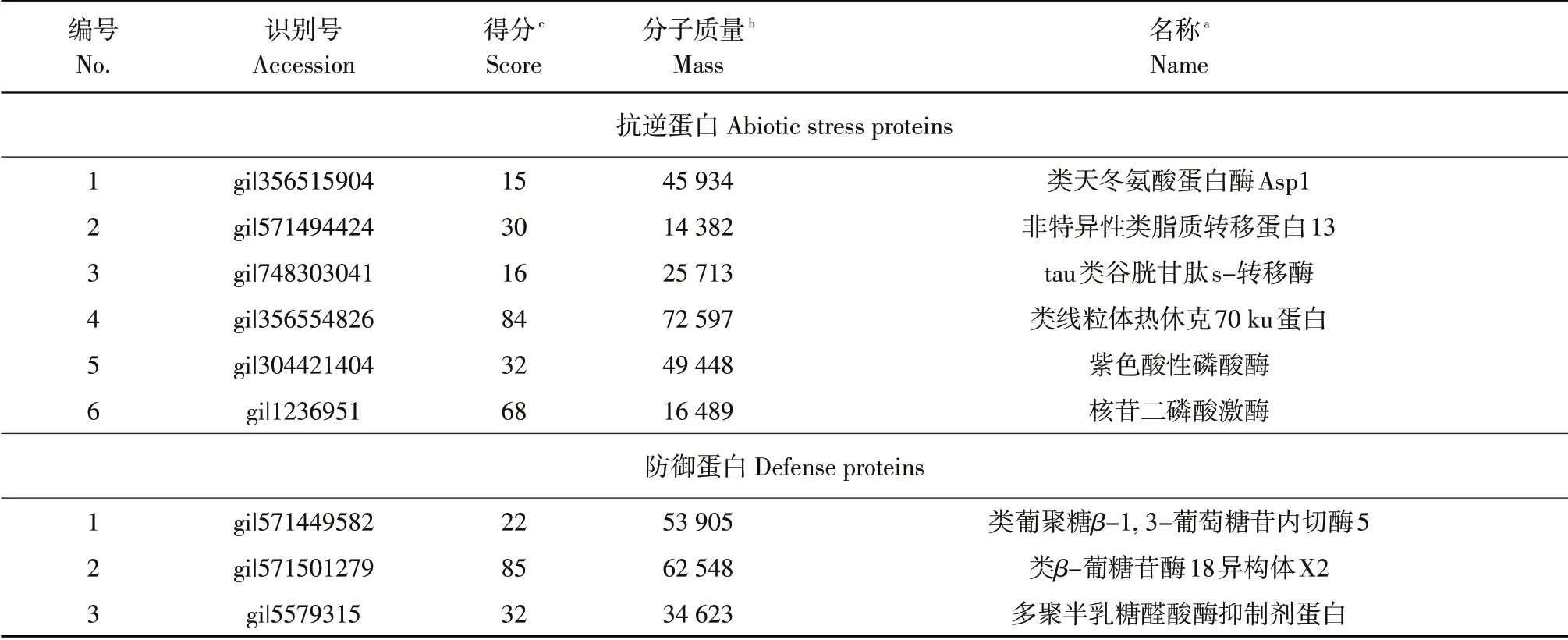
表1 大豆感病品种Sloan接种前种子分泌物中蛋白质与抗病品种Williams 82差异蛋白(抗逆蛋白和防御蛋白)Table 1 Differential proteins in the seed exudates of soybean susceptible cultivar Sloan compared with resistance cultivar Williams 82 before inoculation with Phytophthora sojae(Abiotic stress proteins and defense proteins)
与大豆感病品种Sloan 相比,大豆抗病品种Williams 82接种前种子分泌物中共鉴定出144种差异蛋白,其中46 种功能已知。根据蛋白质功能分为10类:催化活性(3种);水解酶活性(8种);抗逆性(8种);信号转导(1种);新陈代谢(4种);转运蛋白(1 种);防御活性(14 种);酶调节活性(2种);贮藏蛋白(3 种);AAI_LTSS 蛋白质(2 种)。14种具有防御活性的蛋白质包括:链A,1种皮过氧化物酶、类葡聚糖β-1,3-葡萄糖苷内切酶8、类葡聚糖β-1, 3-葡萄糖苷内切酶3、类kiwellin 蛋白、半胱氨酸蛋白酶、Bowman-Birk型蛋白酶抑制剂、类vicilin抗菌肽2、类葡聚糖β-1,3-葡萄糖苷内切酶1、类葡聚糖β-1,3-葡萄糖苷内切酶3异构体、类过氧化物酶20、类过氧化物酶10、GDSL酯酶/脂肪酶、脂氧合酶1。大豆抗病品种Williams 82差异蛋白中具有防御活性的蛋白质种类多于感病品种(见表2)。
2.6 大豆抗病品种Williams 82接种前后种子分泌物中差异蛋白
经LC-MS/MS鉴定,与接种前相比,大豆抗病品种Williams 82接种后种子分泌物中存在141种差异蛋白,其中42个功能已知。根据功能分为10类:水解酶活性(4 种);转录因子(4 种);转运蛋白(1种);抗逆性(3种);新陈代谢(7种);氧化还原活性(3种);防御活性(9种);RNase活性(1种);信号转导(4种);酶调节活性(6种)。抗逆性蛋白γ-谷氨酰半胱氨酸合成酶和谷胱甘肽还原酶均与植物适应非生物胁迫有关[15]。鉴定出9种与植物防御有关的蛋白质,包括超氧化物歧化酶、类非洲奇异果蛋白、类TMV 抗性蛋白N、类枯草杆菌蛋白酶、环核苷酸门控离子通道、酸性几丁质酶、β-1,3-葡聚糖内切酶、PR-4、胚胎发育后期丰富蛋白(见表3)。
2.7 大豆感病品种Sloan接种前后种子分泌物中差异蛋白
LC-MS/MS 质谱鉴定大豆感病品种Sloan 接种后种子分泌物中蛋白质与接种前存在173种差异蛋白,经查证其中59 种蛋白质有文献表明其功能。根据蛋白质功能分为15类:水解酶活性(6种);贮藏蛋白(4 种);新陈代谢(10 种);转酰基作用(2种);转运蛋白(1种);信号转导(5种);酶调节活性(2 种);细胞器RNA 调控(4 种);氧化还原活性(1种);转录因子(2种);抗逆性(7种);启动因子(1种);防御活性(8种);抗氧化活性(1种);催化活性(5 种)。大豆疫霉接种后诱导出8 种具有防御活性的差异蛋白,包括kiwellin 蛋白、类葡聚糖β-1,3-葡萄内切糖苷酶、类α-淀粉酶/枯草杆菌蛋白酶抑制剂、β-1,3-葡聚糖酶、类枯草杆菌蛋白酶、类PR-5、类UDP-半乳糖/UDP-葡萄糖转运体、外囊复合体组分。此外,磷脂酶dα1影响盐胁迫和脱落酸耐受性[16];半胱氨酸蛋白酶抑制剂参与植物对逆境胁迫的应答、衰老、细胞程序化死亡等生理过程[17](见表4)。
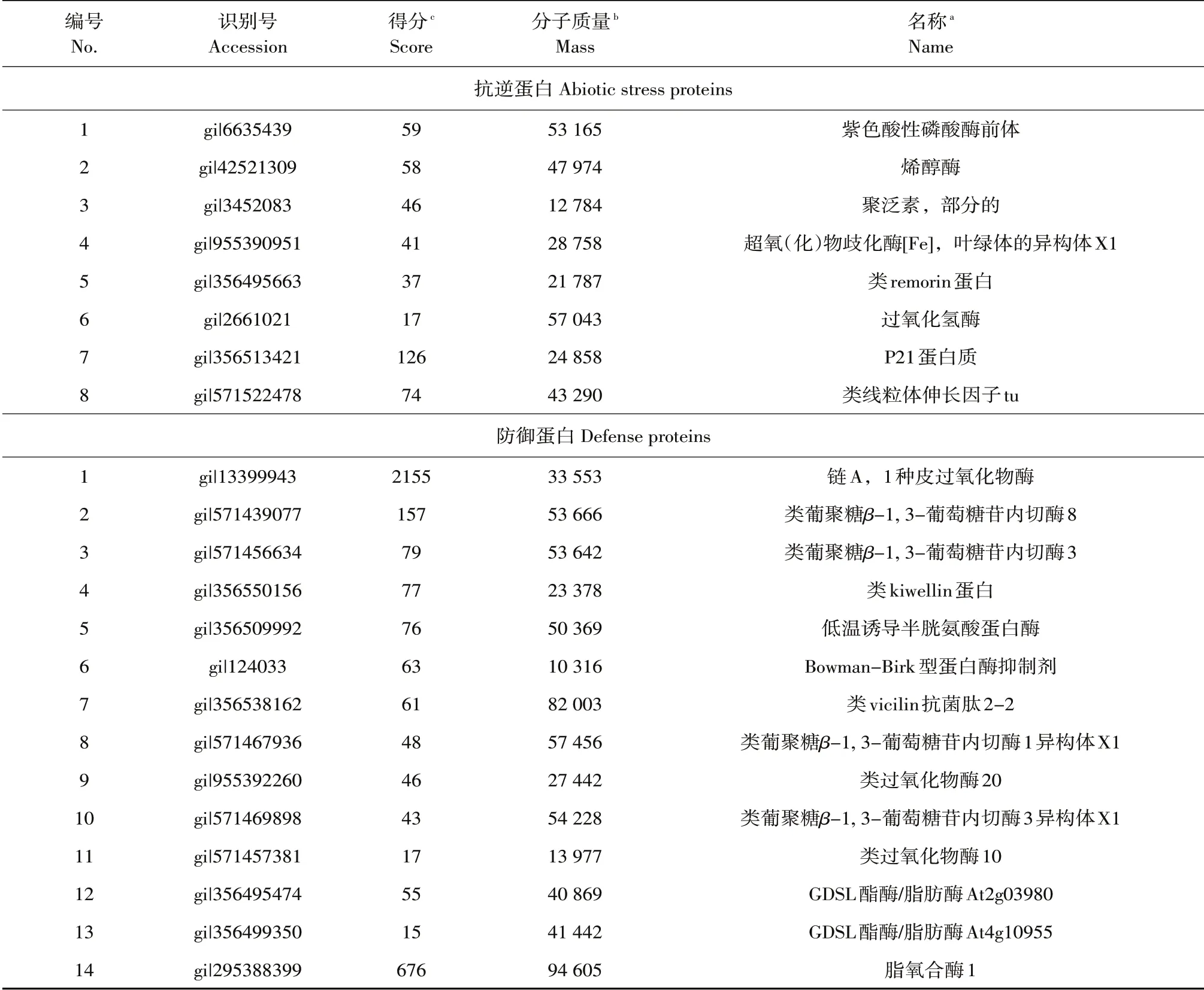
表2 大豆抗病品种Williams 82接种前种子分泌物中蛋白质与感病品种Sloan差异蛋白(抗逆蛋白和防御蛋白)Table 2 Differential proteins in the seed exudates of soybean resistance cultivar Williams 82 compared with susceptible cultivar Sloan before inoculation with Phytophthora sojae(Abiotic stress proteins and defense proteins)
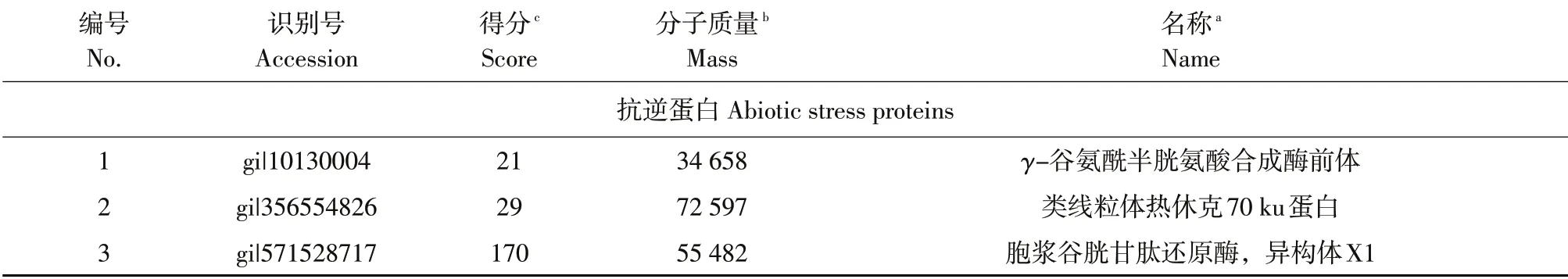
表3 大豆抗病品种Williams 82接种前后种子分泌物中差异蛋白(抗逆蛋白和防御蛋白)Table 3 Differential proteins in the seed exudates of soybean resistance cultivar Williams 82 after inoculation compared with pre-inoculation with Phytophthora sojae(Abiotic stress proteins and defense proteins)
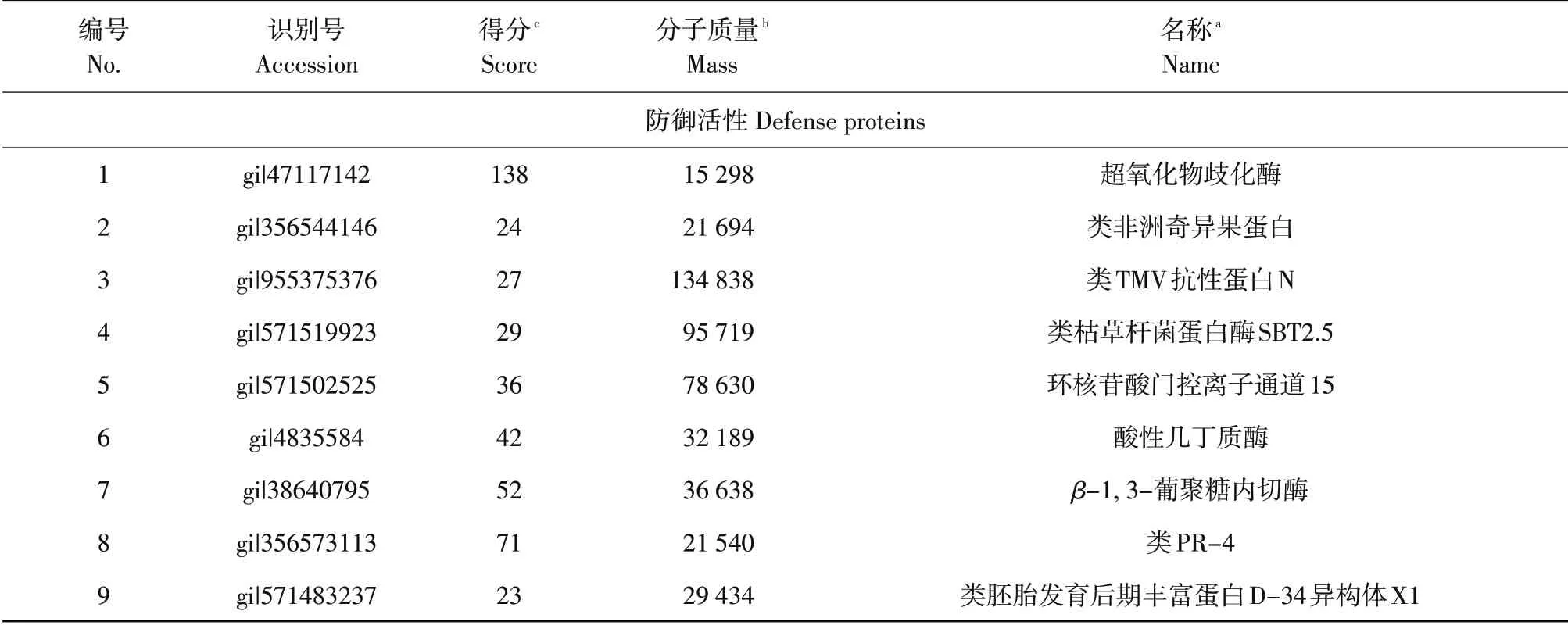
续表
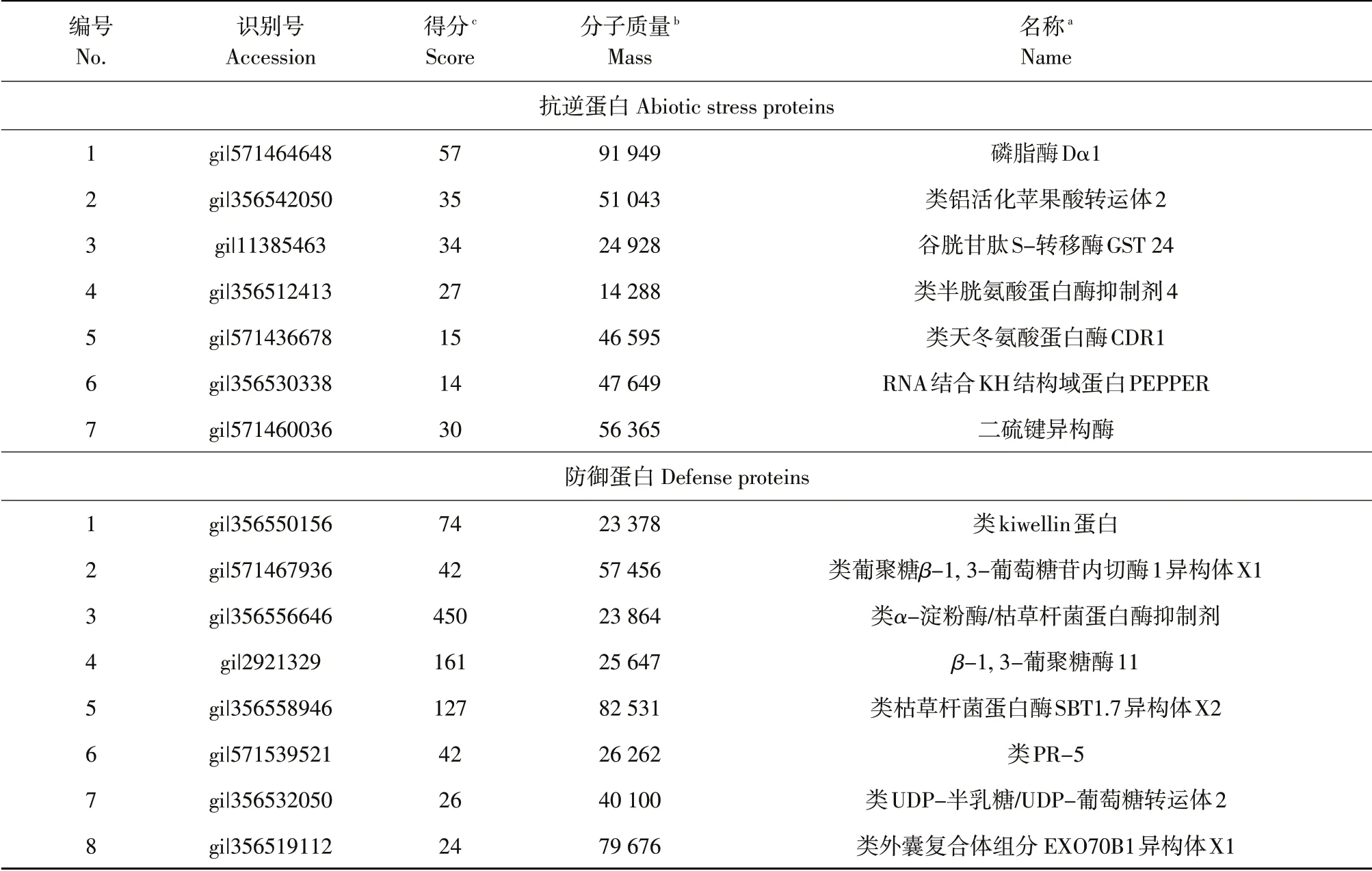
表4 大豆感病品种Sloan接种前后种子分泌物中差异蛋白(抗逆蛋白和防御蛋白)Table 4 Differential protein in the seed exudates of soybean susceptible cultivar Sloan after inoculation compared with pre-inoculation with Phytophthora sojae(Abiotic stress proteins and defense proteins)
3 讨论与结论
目前,对于植物防御机制,国内外学者研究较深入。但对种子在微生物密集土壤中发芽和生存的机制了解有限。大豆抗、感品种种子分泌物均有效吸引大豆疫霉游动孢子,而抗病品种Williams 82种子分泌物显著抑制大豆疫霉卵孢子形成及萌发和孢囊萌发[8],说明大豆种子分泌物中存在防御大豆疫霉的物质。为了解大豆种子分泌物在植物防御中的作用,本试验重点研究大豆种子分泌物中蛋白质特性及其对大豆疫霉游动孢子的影响。
种子分泌物中蛋白质对真菌生长的体外抑制作用已被证实[18]。大豆抗、感品种种子分泌物中蛋白质对大豆疫霉游动孢子的趋化性影响存在差异。感病品种Sloan 接种前种子分泌物中蛋白质吸引大豆疫霉游动孢子,接种后排斥游动孢子;接种前后均促进游动孢子成囊,接种前促进孢囊萌发,接种后抑制孢囊萌发,说明感病品种Sloan 种子分泌物中存在对游动孢子有趋化作用的蛋白质,接种后诱导防御活性更强的蛋白质。抗病品种Williams 82 接种前后种子分泌物中蛋白质均排斥游动孢子,接种后排斥作用更强,均抑制游动孢子成囊和孢囊萌发,说明接种后可能诱导种类更多、含量更高、活性更强的与植物防御有关的蛋白质。
感病品种Sloan 接种后诱导8 种已知具有植物防御活性的差异蛋白。其中kiwellin 蛋白可抵抗真菌诱导的宿主代谢干扰,阻断真菌效应酶的酶活性[19];PR-5 主要参与防御病原物感染的植物防御系统,如抑制真菌孢子萌发或菌丝生长。因此,诱导蛋白质可能通过排斥游动孢子和抑制孢囊萌发参与大豆种子对大豆疫霉的防御机制。
抗病品种Williams 82接种后诱导出9种已知与植物防御相关的差异蛋白。其中PR-4通过直接抑制内切壳多糖酶和水解酶保护宿主,致使几丁质酶、葡聚糖酶和过氧化物酶表达;类枯草杆菌蛋白酶诱导植物和病原物互作过程中的PCD 和HR,具有病原物抗性和免疫激发作用,说明这些差异蛋白可能在抗病品种Williams 82 防御大豆疫霉的过程中发挥重要作用。
大豆抗、感品种接种前种子分泌物中共鉴定出17 种具有植物防御活性的差异蛋白,抗病品种多于感病品种。大豆种子中胰蛋白抑制剂抑制植物病原微生物各种酶[20]。抗病品种Williams 82中存在Bowman-Birk型蛋白酶抑制剂,可能参与大豆对大豆疫霉的防御过程。此外,过氧化物酶、脂氧合酶均与植物对病原物反应有关。
综上所述,大豆种子对蛋白质的选择性分泌可能有助于对大豆疫霉的防御机制,且接种后诱导的蛋白质防御活性更强,因此认为大豆分泌蛋白在植物对土壤病原物的防御中发挥关键作用。后续应研究具体的防御蛋白,了解其对大豆疫霉的生理活性,为大豆抗病机制和抗病育种研究提供理论依据。
