H2O2对体外培养视网膜色素上皮细胞中BMP-6及其相关受体的影响△
2020-04-22刘明杨晓岗马波陈丽
刘明 杨晓岗 马波 陈丽
年龄相关性黄斑变性(age-related macular degeneration,AMD)是50岁以上人群视力丧失的重要原因,已成为全球失明的主要原因之一,因此,AMD的防治具有举足轻重的意义[1]。目前认为,AMD的发病机制是由于氧化应激、细胞老化、炎症等因素综合作用所致的,而氧化应激可能是各种因素的共同作用机制[2]。视网膜色素上皮(retinal pigment epithelium,RPE)细胞是位于视网膜最外层的单细胞层,在AMD的发病机制中起着重要作用,是其发病的中心环节[3]。有研究证明,铁代谢异常与AMD的发病密切相关[4]。而在肝脏中,骨形态发生蛋白(bone morphogenetic protein,BMP)-6可调节铁调素进而维持铁的平衡[5]。这些研究均提示,BMP-6可能与AMD的发病有关,在保护RPE细胞方面可能发挥着重要的调控作用。此外,我们既往研究发现,H2O2可引起RPE细胞铁调素水平的下降[6],而BMP-6是调节铁调素的关键因子[5]。因此,本研究利用细胞培养和分子生物学等技术,在细胞层面观察氧化应激对RPE细胞的损伤作用和对BMP-6及其相关受体的影响,探讨RPE细胞氧化应激损伤的分子机制,为AMD的防治寻找新的靶点。
1 材料与方法
1.1 材料
1.1.1 实验细胞及分组RPE细胞(美国ATCC公司),常规培养,随机分为对照组、H2O2组、实验组。其中对照组RPE细胞正常培养;H2O2组RPE细胞加入200 μmol·L-1H2O2培养;实验组RPE细胞先加入0.1 ng·L-1BMP-6培养1 h后,再加入200 μmol·L-1H2O2继续培养。
1.1.2 试剂与仪器DMEM培养基(Gibco,美国);胎牛血清(Hyclone,美国);过氧化氢(沪试货号10011208);BMP-6(PeproTech,美国);流式细胞仪(型号CytoFLEX,BECKMAN,美国);酶标仪(Thermo,美国);细胞凋亡试剂盒(上海翊圣,中国);活性氧(reactive oxygen species,ROS)试剂盒、DAPI(碧云天,中国);PCR仪(ABI,美国);兔多抗GAPDH(杭州贤至,中国);鼠多抗BMP、兔多抗BMPR1A、兔多抗BMPR1B、兔多抗尤文素(Hemojuvelin,HJV)(Affinity,美国);HRP标记的羊抗兔二抗(武汉博士德,中国)。
1.2 方法
1.2.1 细胞培养RPE细胞常规DMEM/F12培养,次日贴壁生长后更换为无血清培养液培养24 h,取生长状态良好的细胞,制备单细胞悬液,细胞计数板计数,按每孔5×105个细胞接入6孔板,在含体积分数5% CO2的饱和湿度条件下,37 ℃培养细胞密度至70%。按实验设计处理各组细胞。
1.2.2 流式细胞仪检测RPE细胞ROSH2O2组RPE细胞加入200 μmol·L-1H2O2处理12 h后,将对照组与H2O2组用不含EDTA的2.5 g·L-1胰蛋白酶消化细胞,终止消化后EP管收集,1200 r·min-1离心3 min,去上清,加PBS重悬,用PBS将细胞润洗2次后1200 r·min-1离心3 min,按照DCFH-DA细胞ROS检测试剂盒操作说明,去PBS,用无血清培养基11000稀释DCFH-DA,每管加入1 mL,对照加不含DCFH-DA的无血清培养基;37 ℃培养箱孵育20 min,每隔3 min混匀一次;用无血清培养基洗涤细胞3次;流式细胞仪上机检测。
1.2.3 实时荧光定量PCR检测BMP-6及相关受体mRNA按照RNA提取试剂盒说明书,用Trizol法提取对照组和H2O2组mRNA,-80 ℃冰箱保存备用;按逆转录反应体系,反应条件25 ℃ 5 min,50 ℃ 15 min,85 ℃ 5 min,4 ℃ 10 min逆转录合成cDNA;再按实时荧光定量 PCR反应体系,反应条件50 ℃ 2 min,95 ℃ 10 min,95 ℃ 30 s,60 ℃ 30 s,共40 个循环。 BMP-6和GAPDH引物序:GAPDH上游引物为5’-TCAAGAAGGTGGTGAAGCAGG-3’,下游引物为5’-TCAAAGGTGGAGGAGTGGGT-3’;BMPR1A上游引物为5’-GGAGATGGCTCGTCGTTGTA-3’,下游引物为5’-AGTCTGGAGGCTGGATTGTG-3’;BMPR1B上游引物为5’-CCACCACCCTAGACGCTAAA-3’,下游引物为5’-TGCCAACTCGAGTGTTAGGT-3’;HJV上游引物为5’-GATCCCAACTTTACCGTGGC-3’,下游引物为5’-CCACAGAACAAAGAGCCCAG-3’,绘制溶解曲线,最终数据以2-△△Ct进行分析。
1.2.4 TUNEL染色检测细胞凋亡H2O2组和实验组细胞培养12 h后,与对照组一起进行离心收集细胞,PBS清洗1次,重悬,加载在铺好的多聚赖氨酸载玻片上,自然干燥,在40 g·L-1多聚甲醛室温中固定30 min,PBS清洗3遍,每次5 min;将爬好细胞的玻片浸入40 g·L-1的多聚甲醛(pH 7.4)溶液中室温固定25 min,随后用PBS洗涤3次,每次5 min;将细胞爬片浸入用PBS配制的体积分数0.1% TritonX-100溶液中10 min(冰上操作),随后用PBS洗涤2次,每次5 min;用PBS溶液润洗样本,轻轻去掉多余液体,并用滤纸小心吸干载玻片上样本周围的液体,处理后的样本放在湿盒中以保持样本湿润;按15的比例用去离子水稀释5×Equilibration Buffer,每个样本滴加100 μL 1×Equilibration Buffer使其全部覆盖待检样本区域,室温孵育10~30 min,或者将载玻片放入一个含有1×Equilibration Buffer的缸中,保证缓冲液没过样本,在平衡细胞的同时在冰上解冻Alexa Fluor 647-12-dUTP Labeling Mix;在平衡后的区域周围用吸水纸洗掉100 μL 1×Equilibration Buffer中的大部分,然后在组织上加入TdT孵育缓冲液;把塑料盖玻片盖在组织上以保证试剂平均分布,在湿盒的底部放上用水浸湿的纸巾,将载玻片置于湿盒内,37 ℃孵育60 min;将湿盒用铝箔纸包裹以避光;然后用PBS洗涤3次,每次5 min ;复染核:滴加DAPI避光孵育5 min,对标本进行染核,PBST 5 min×4次洗去多余DAPI;用吸水纸擦干切片上的液体,用含抗荧光淬灭剂的封片液封片,然后在荧光显微镜下观察采集图像。
1.2.5 Weatern blot检测BMP-6及其受体蛋白水平表达应用组织裂解液裂解细胞提取总蛋白,按照BCA蛋白定量试剂盒通过标准曲线计算出样品的蛋白浓度,对照组、H2O2组、实验组蛋白均取等量(30 μg),加入上样缓冲液,97 ℃加热6 min变性,冷却后取样,进行SDS-PAGE凝胶电泳,采用电转仪将蛋白从分离胶转移至PVDF膜上,将PVDF膜放入封闭液(TBST+50 g· L-1脱脂奶粉)中,室温封闭30 min。加入一抗(BMP-6、BMPR1A、BMPR1B及HJV的单克隆抗体)并用封闭液稀释,室温孵育过夜。用1×TBST漂洗5~6次,每次5 min。加入适当比例稀释的二抗,室温孵育2 h。 用1×TBST漂洗5~6次,每次5 min。ECL试剂盒化学荧光法显色,用BandScan分析胶片灰度值对Western blot结果作半定量分析。三组Western blot法测定均实施了3次,测定结果稳定。
1.3 统计学分析所有结果均采用SPSS17.0统计学软件进行分析处理,计量资料以均数±标准差表示,整体比较采用独立样本t检验或单因素方差分析,组间比较如具有方差齐性采用LSD法,如不具有方差齐性则采用Tamhane法。检验水准:α=0.05。
2 结果
2.1 H2O2对RPE细胞ROS的影响对照组细胞内ROS水平为(70.55±7.71)%,H2O2组细胞内ROS水平为(99.25±0.28)%,两组相比差异有统计学意义(P<0.05)。见图1。

图1 流式细胞仪检测对照组和H2O2组ROS水平
2.2 H2O2对RPE细胞内BMP-6的影响H2O2组内BMP-6 mRNA水平(0.27±0.05)%相对于对照组(0.95±0.06)%为(0.25±0.12)%,与对照组相比差异有统计学意义(P<0.05)。在蛋白水平上,H2O2组(0.18±0.05)相对于对照组(0.54±0.07) BMP-6的表达水平明显降低(P<0.05),见图2。
2.3 BMP-6对H2O2环境下RPE细胞的影响TUNEL染色结果显示,对照组的染色阳性细胞数比例为(8.25±1.06)%,H2O2组为(51.22±8.51)%,与对照组相比差异有统计学意义(P<0.05);实验组的染色阳性细胞数为(27.63±5.37)%,与H2O2组相比差异有统计学意义(P<0.05)。见图3。
2.4 H2O2对BMP受体mRNA及蛋白水平的影响Weatern blot检测结果显示,H2O2组BMP的BMPR1A、BMPR1B及HJV受体水平均低于实验组与对照组,实验组各受体水平与对照组和H2O2组比较,差异均有统计学意义(均为P<0.05)。见图4。

图2 H2O2对RPE细胞中BMP-6 mRNA及蛋白水平的影响 与对照组比较,*P
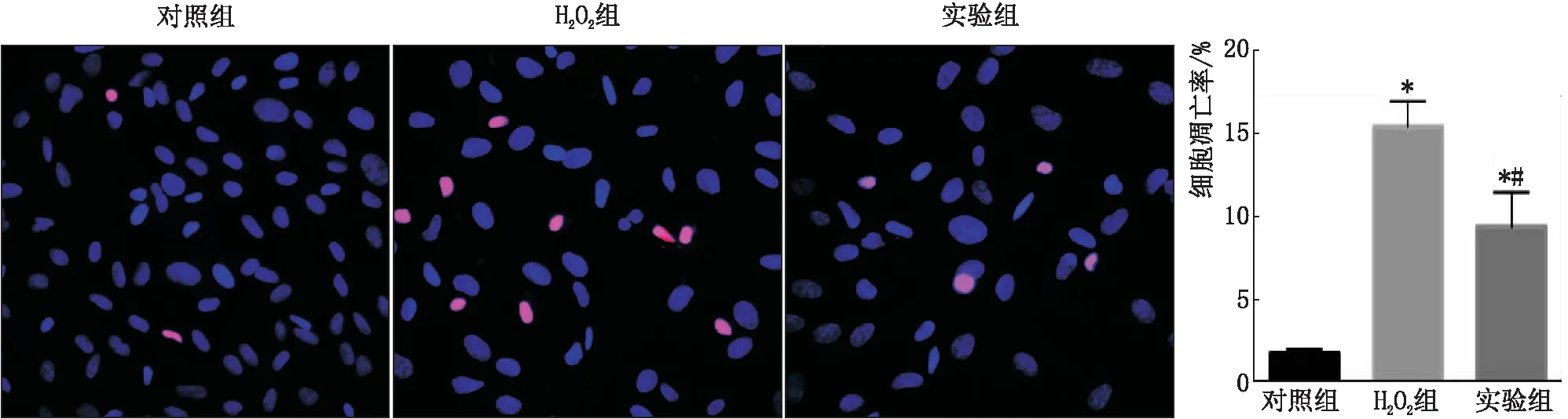
图3 TUNEL检测各组RPE细胞凋亡率(×400;红色为凋亡细胞,蓝色为细胞核) 与对照组比较,*P2O2组比较,#P
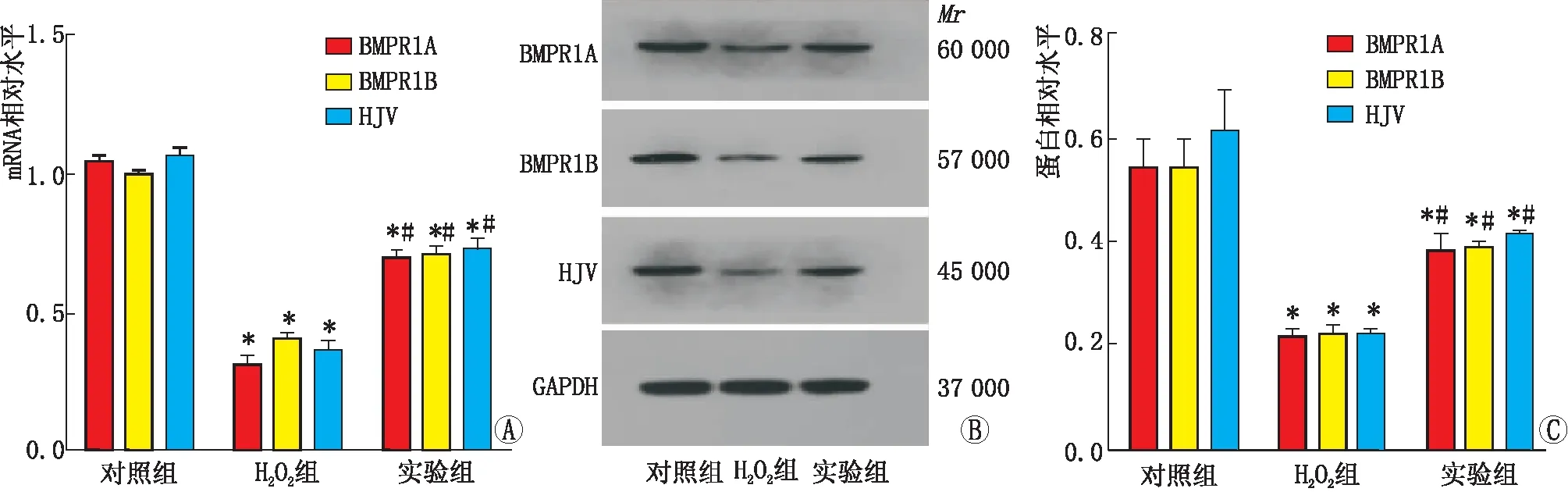
图4 H2O2对BMP-6相关受体mRNA及蛋白水平的影响 A:氧化应激对受体mRNA水平的影响;B:Western blot检测结果图;C:氧化应激对受体蛋白水平的影响。与对照组比较,*P2O2组比较,#P
3 讨论
ROS是反映细胞内氧化应激水平的直接指标,ROS增多可导致脂质氧化、蛋白质破碎、交联与聚集,同时还可导致DNA碱基氧化,进一步启动细胞凋亡[7]。人RPE细胞暴露于烟雾环境中可产生大量ROS,同时抗氧化剂水平下降,导致线粒体功能损害,最后引起RPE细胞凋亡[8]。我们研究发现,H2O2可以显著提高RPE细胞内ROS的水平,起到促进氧化应激损伤的作用。既往研究发现,氧化应激可以影响铁调素的水平[9],而在肝脏中,BMP-6已被证实是铁调素的主要调节因子[10]。我们拟进一步观察氧化应激是否可以影响BMP-6的水平,结果显示,相对于对照组,H2O2组BMP-6 mRNA水平及蛋白水平均明显降低,证实了氧化应激可以通过抑制BMP-6起到氧化损伤的作用。
尽管BMP信号通路在动物胚胎发育、组织分化和细胞增殖中发挥关键作用[11],但有关BMP信号通路在AMD发病中扮演的角色还有待阐明。我们运用TUNEL染色法观察BMP-6预处理后再添加H2O2处理后细胞凋亡的变化,结果显示,BMP-6可以保护RPE细胞对抗氧化应激损伤,显著降低氧化应激导致的RPE细胞的凋亡。
BMPs可以激活Smad依赖的和多个Smad非依赖的信号通路,直接影响下游基因的转录,它们通过与细胞表面受体结合并形成由两种I型和II型丝氨酸/苏氨酸激酶受体组成的异四聚体复合物来启动信号转导级联反应[12]。 12种BMP有五种已知的BMPI型受体:激活素受体样激酶1(ACVRL1或ALK1);1A型激活素受体(ActR-1A或ALK2);BMP受体1A型(BMPR1A,也称ALK3 );活化素受体1B型(ACVR1B或ALK-4)和BMP受体1B型(BMPR-1B或ALK-6)[13]。HJV是一种BMP共受体,在青少年血色素沉着症中被破坏时,会导致铁调素严重缺乏和组织铁过表达[14]。HJV选择性结合 BMP受体,作为BMP的共受体可以激活 BMP/Smad 信号通路和铁调素的表达[15]。BMP6-HJV-BMP受体复合物启动磷酸化信号级联,Smad1/5/8 被磷酸化并与 Smad4 结合,形成 Smad 复合物进入细胞核,从而激活铁调素的转录。最新研究表明,肝细胞核因子4α通过灭活肝癌细胞中骨形态发生蛋白途径,特别是通过BMP1A起到抑制Hepcidin的作用[16]。Castoldi等[17]发现,通过抑制miR-122可增加BMPR1A及HJV等控制全身铁水平的基因。氧化应激可下调BMP-6,而添加BMP-6可减轻氧化应激所致的细胞凋亡,因此,我们拟进一步观察氧化应激是通过何种与铁调控相关的BMP受体起到促进细胞凋亡的作用。荧光定量PCR结果显示,H2O2可抑制BMP受体的活性(BMP1A受体、BMPR1B受体及HJV受体),而添加了BMP-6后可对抗氧化应激对其相关受体的抑制作用。
本研究发现,氧化应激可对RPE细胞起到氧化损伤作用,氧化应激可以下调BMP-6的水平促进细胞凋亡,而BMP-6预处理RPE细胞则可以对抗氧化应激损伤;进一步观察发现,氧化应激可以抑制BMPR1、BMPR1B及HJV受体,而BMP-6则可以对抗这种抑制作用,进一步验证了BMP-6在氧化应激损伤RPE细胞中的作用。但我们实验仅初步探索了氧化应激对RPE细胞造成损伤的机制以及BMP-6对抗氧化应激损伤的结果。氧化应激损伤RPE细胞的具体分子机制以及BMP-6对抗氧化应激损伤的作用仍需进一步的研究。
