糖尿病黄斑缺血患者黄斑中心凹下脉络膜厚度特征分析△
2020-04-22侯军军陈松谢娟侯佳常欣
侯军军 陈松 谢娟 侯佳 常欣
糖尿病黄斑缺血(diabetic macular ischemia,DMI)是糖尿病视网膜病变(diabetic retinopathy,DR)中继糖尿病黄斑水肿之后影响视功能的主要并发症之一,其特征为黄斑区视网膜毛细血管狭窄或闭塞[1],影像学表现为黄斑中心凹无血管区扩大,拱环破坏,黄斑区毛细血管丢失[2-3]。因其不可逆性及无有效治疗方法,严重威胁患者视功能[4-5]。自1985年糖尿病脉络膜病变首次被提出以来[6],DR发展过程中脉络膜的变化已受到广泛关注[7-11]。糖尿病黄斑水肿对脉络膜厚度的影响亦有相关报道[8-13],但对DMI时脉络膜的变化研究甚少。OCT增强深度成像技术(enhanced depth imaging-OCT,EDI-OCT)可清晰显示黄斑区脉络膜结构,并可准确测量脉络膜厚度[14]。本研究采用EDI-OCT观察一组DMI患者黄斑区脉络膜厚度变化情况,现将结果报告如下。
1 资料与方法
1.1 一般资料回顾性病例对照研究。收集2018年5月至2019年2月在山西省眼科医院临床检查确诊的DR伴DMI患者37例47眼为DMI组,同时收集DR不伴DMI患者43例55眼为NDMI组。所有患者均行最佳矫正视力(best corrected visual acuity,BCVA)、非接触式眼压、裂隙灯显微镜联合前置镜、眼底彩色照像(color fundus photograph,CFP)、荧光素眼底血管造影(fundus fluorescein angiography,FFA)、EDI-OCT检查。参考ETDRS关于DMI分级标准[3],对所有患者FFA结果进行评价,确定存在DMI者纳入DMI组,所有入选患眼均经3位临床经验丰富的眼底病医师讨论确定。选取同期同时间段年龄、性别匹配的无DR的2型糖尿病患者33例50眼作为对照组(NDR组),患者充分散瞳后由3位临床经验丰富的眼底病医师通过裂隙灯显微镜联合前置镜检查确诊无DR。因FFA为侵入性检查,所有NDR组入选眼均未进行FFA检查。
1.2 纳入及排除标准纳入标准:(1)2型糖尿病患者;(2)血压<150/90 mmHg(1 kPa=7.5 mmHg);(3)屈光度<+2.00 D或>-2.00 D;(4)EDI-OCT检查时间为下午3点至5点;(5)DMI判定标准为患者FFA动静脉期图像显示黄斑区拱环明确破坏中断者[3]。排除标准:(1)存在有临床意义的糖尿病黄斑水肿者[15];(2)眼压>21 mmHg或有青光眼病史者;(3)合并前部缺血性视神经病变、视网膜静脉阻塞、年龄相关性黄斑变性、葡萄膜炎等其他视网膜脉络膜疾病者;(4)有眼部外伤史或内眼手术史者;(5)曾行眼底视网膜激光光凝或眼内抗VEGF治疗者;(6)存在睫状视网膜动脉者;(7)屈光间质混浊或配合欠佳影响眼底成像者。本研究符合赫尔辛基宣言并经医院伦理委员会批准,取得所有患者知情同意并签署知情同意书。
1.3 方法所有患眼均采用德国Heidelberg Spectralis HRA+OCT激光诊断仪行黄斑区OCT检查。EDI-OCT模式的8.9 mm扫描线单线水平扫描黄斑中心凹位置,通过设备自带的“eye tracking”眼球自动追踪技术叠加100张获取图像。该设备会自动识别并显示黄斑中心凹处内界膜至视网膜色素上皮(retinal pigment epithelium,RPE)层强反射线外缘间的视网膜厚度,即黄斑中心凹厚度(central macular thickness,CMT)。利用设备自带测量工具手工测量黄斑中心凹下RPE层强反射线外缘至巩膜强反射线内缘的垂直距离,即为黄斑中心凹下脉络膜厚度(subfoveal choroidal thickness,SFCT)。所有患眼均由两位经验丰富的眼科医师讨论确定脉络膜巩膜分界线,剔除分界不清者,由同一位医师重复测量3次,取平均值作为该患眼的SFCT值。
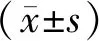
2 结果
2.1 一般结果DMI组中男23例31眼、女14例16眼,年龄32~70(50.55±9.43)岁;NDMI组中男23例30眼、女20例25眼,年龄32~69(51.16±9.19)岁;NDR组中男20例29眼、女13例21眼,年龄34~71(52.66±6.88)岁。三组间年龄、性别比较差异均无统计学意义(F=0.784,P=0.459;χ2=1.412,P=0.494)。三组患者的典型FFA和EDI-OCT图像见图1、图2和图3。
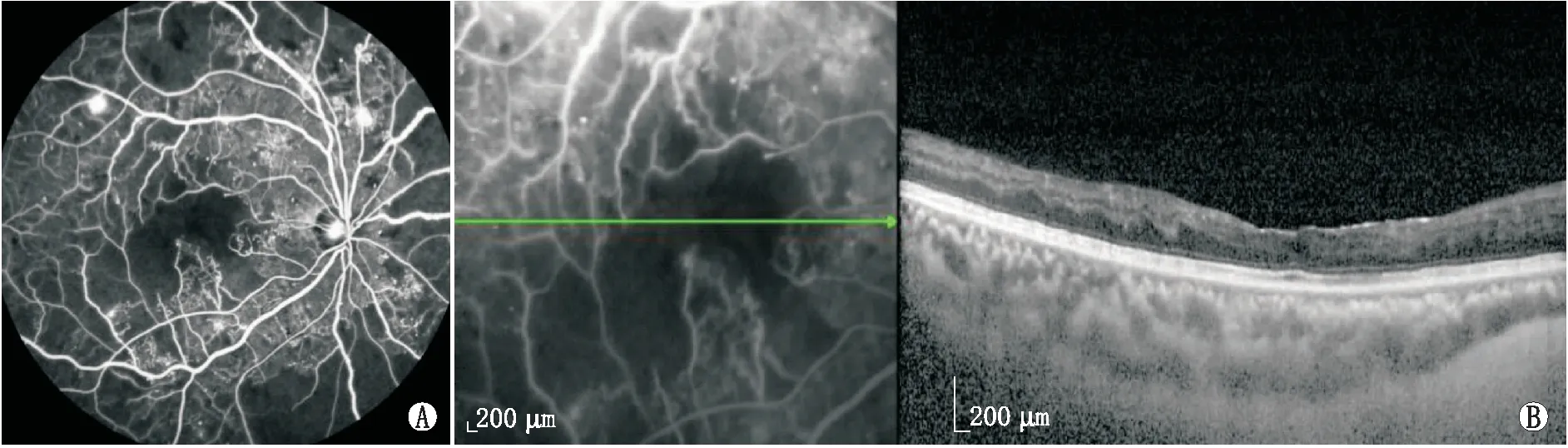
图1 DMI组患眼典型FFA像及EDI-OCT像 A:FFA示黄斑区拱环破坏,无血管区扩大;B:EDI-OCT示黄斑区视网膜及脉络膜结构
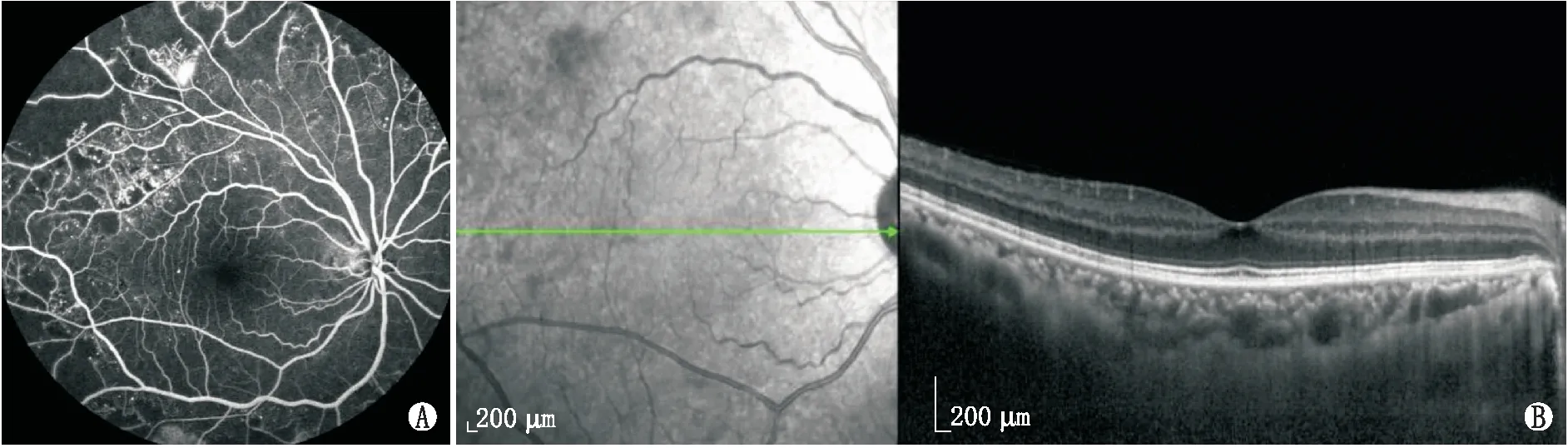
图2 NDMI组患眼典型FFA像及EDI-OCT像 A:FFA示黄斑区拱环完整;B:EDI-OCT示黄斑区视网膜及脉络膜结构
图3 NDR组眼典型FFA像及EDI-OCT像 A:FFA示视网膜未见出血渗出等DR表现;B:EDI-OCT示黄斑区视网膜及脉络膜结构
2.2 DMI组与NDMI组FFA结果比较DMI组中增生型糖尿病视网膜病变 (proliferative diabetic retinopathy,PDR)38眼,其中男25眼,女13眼,年龄(50.08±9.37)岁,中或重度非增生型糖尿病视网膜病变(non-proliferative diabetic retinopathy,NPDR)9眼。NDMI组中PDR 45眼,其中男22眼,女23眼,年龄(51.13±8.16)岁,中重度NPDR 10眼。DMI组与NDMI组间PDR、NPDR眼数分布相比,差异无统计学意义(χ2=0.016,P=0.900)。DMI组与NDMI组PDR患者性别、年龄比较,差异均无统计学意义(χ2=2.396,P=0.122;t=0.534,P=0.595)。
2.3 三组间EDI-OCT结果比较DMI组、NDMI组及NDR组CMT相比差异无统计学意义(P=0.348),SFCT相比差异有统计学意义(P=0.003;见表1)。组间两两比较结果显示,与NDMI组比较,DMI组SFCT明显增厚,差异有统计学意义(t=3.308,P=0.001);与NDR组比较,NDMI组SFCT明显变薄,差异有统计学意义(t=2.568,P=0.011);DMI组与NDR组SFCT比较,差异无统计学意义(t=0.765,P=0.446)。DMI组及NDMI组内PDR眼SFCT分别为(357.84±101.38)μm、(293.16±81.66)μm,两者相比差异有统计学意义(t=3.219,P=0.002);因两组中NPDR眼数较少,故未进行统计学分析。Pearson相关性分析结果显示,DMI组、NDMI组及NDR组各组内CMT与SFCT均无显著相关性(r=0.033、-0.060、0.144,P=0.827、0.664、0.318)。
表1 3组患眼CMT、SFCT比较
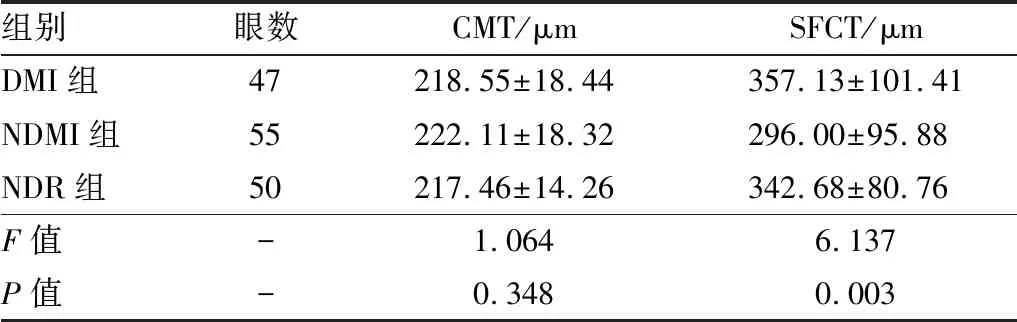
组别眼数CMT/μmSFCT/μmDMI组47218.55±18.44357.13±101.41NDMI组55222.11±18.32296.00±95.88NDR组50217.46±14.26342.68±80.76F值-1.0646.137P值-0.3480.003
3 讨论
脉络膜血流丰富,约占眼球内血流的95%[16],是外层视网膜和黄斑区血供的主要来源,黄斑区脉络膜厚度可以间接反映脉络膜血流情况。既往关于DR不同分期脉络膜厚度变化的研究报道结果并不一致,增厚[7,10]、变薄[8-9]、不变[11]、早期变薄晚期增厚[12]均有报道。糖尿病黄斑水肿对脉络膜厚度的影响亦有不同的报道结果[8,10]。所有研究均未区分是否存在黄斑缺血。Birol等[17]研究表明,视网膜深层毛细血管网(deep capillary plexus,DCP)参与外层视网膜血供,其在恒河猴动物模型中的研究表明,DCP参与光感受器10%~15%的血供。临床上发现急性黄斑神经视网膜病变(acute macular neuroretinopathy,AMN)患者DCP缺血后外丛状层及光感受器层受累,也证明DCP参与视网膜外层供血[18],这意味着DCP与脉络膜共同参与黄斑区外层视网膜血供。本研究就黄斑区发生黄斑缺血后DCP对外层视网膜血供减小,这是否会对脉络膜供血发生影响进行探讨。
本研究结果显示,DMI组患眼较NDMI组患眼SFCT明显增厚。排除DR不同分期对SFCT的影响,仅分析两组间PDR患眼SFCT,统计结果仍显示,DMI组较NDMI组SFCT明显增厚。上述结果表明,DMI是造成黄斑区脉络膜增厚的原因。Poukens等[19]研究发现,后极部脉络膜及巩膜,尤其黄斑中心凹处富含非血管性的收缩细胞,神经元细胞通过控制这些收缩细胞进行脉络膜厚度的调节。Sim等[20]研究发现,DR患者发生黄斑缺血后黄斑区脉络膜增厚,尤其是脉络膜大血管层明显扩张,他们认为脉络膜神经元细胞通过释放NO使细胞收缩,进而使黄斑区脉络膜血管扩张。我们推测,DMI患者黄斑拱环破坏后,黄斑区外层视网膜血供受到一定程度影响,因为DCP与脉络膜共同参与黄斑区外层视网膜血供[17-18],继而脉络膜会代偿性地增加对其的供血,通过释放NO使脉络膜血管发生代偿性扩张,故EDI-OCT上表现为脉络膜厚度增加。
本研究发现,NDMI组患眼较NDR组患眼SFCT明显变薄,提示2型糖尿病患者发生DR后脉络膜变薄。可能与发生DR患眼较未发生DR患眼其糖尿病脉络膜病变相对较重,发生脉络膜毛细血管萎缩、闭塞等病理性改变程度较重有关[21-22]。DMI组与NDR组SFCT相比差异均无统计学意义(均为P>0.05),分析可能与上述导致脉络膜增厚及变薄的病理机制间作用相互抵消有关。
本研究纳入研究对象时排除了糖尿病黄斑水肿者,避免其对脉络膜厚度影响造成的误差[8,10]。DMI组、NDMI组和NDR组间CMT相比差异均无统计学意义(均为P>0.05),并且相关性分析结果表明,各组内CMT与SFCT均无显著相关性,提示在无黄斑水肿的情况下,视网膜厚度对脉络膜厚度无明显影响。
有研究表明,脉络膜厚度存在昼夜节律变化[23],本研究SFCT测量时间均为下午3点到5点,以减小误差。本研究排除存在睫状视网膜动脉者,避免脉络膜视网膜血管交通对研究结果的干扰。OCTA是近年来使用的一项全新的无创影像学技术,可通过探测血流信号来显示黄斑区血管形态。但有学者研究发现OCTA对DMI诊断有限[24],FFA仍是目前诊断DMI的金标准。
综上所述,本研究结果提示,当DR患者发生DMI后,脉络膜将会代偿性增厚、扩张。但因本研究为回顾性病例对照,且纳入研究的样本量较小,未设立健康对照组,仅研究SFCT、未对整个黄斑区脉络膜体积进行分析等局限性,其结果尚需大样本前瞻性研究进一步验证。
