Mfn2在TGF-β2诱导的晶状体上皮细胞上皮-间质转化中的作用△
2020-04-22于童张劲松
于童 张劲松
白内障是一种常见的致盲性眼病,发病率不断上升,目前手术是其唯一有效的治疗方法。白内障超声乳化吸出术虽然能在很大程度上改善患者的视觉质量,但是术中残留的人晶状体上皮细胞(human lens epithelial cells,HLECs)在白内障术后发生的上皮-间质转化(epithelial-mesenchymal transition,EMT)会导致后发性白内障发生。YAG激光后囊切开术虽可对后发性白内障进行有效的治疗,但其导致的多种并发症如眼内炎、视网膜脱离、人工晶状体(intraocular lens,IOL)偏位等影响患者的生活质量[1]。1982年Greenburg等[2]通过将LECs在胶原凝胶中培养发现,上皮细胞具有间质细胞的形态,由此提出了EMT的概念,其在胚胎发育、多种纤维化疾病及癌症转移中均起重要作用。在EMT的过程中,原本紧密相连的上皮细胞的细胞间黏附分子,如E-钙黏蛋白(E-Cadherin)的表达减少,丧失了与基底膜的连接并逐渐失去上皮细胞表型,而间质细胞迁移与侵袭能力增强,同时波形蛋白(Vimentin)表达增加,从而逐渐获得间充质特征。转化生长因子β2(transforming growth factor β2,TGF-β2)可以成功诱导LECs发生EMT,且经过TGF-β2处理的LECs可以作为EMT的细胞模型[3]。线粒体融合蛋白基因2(mitofusin 2,Mfn2)是存在于线粒体外膜上高度保守的GTP酶,是参与线粒体外膜融合的重要蛋白之一,并与细胞及细胞器多种生物学功能密切相关,它除了参与调控线粒体形态结构外,还与细胞代谢、增殖、凋亡、内质网应激、自噬等有关[4]。有关Mfn2与LECs发生EMT的关系的报道尚少。本研究通过分别检测TGF-β2作用下HLECs内Mfn2的表达差异和Mfn2过表达对HLECs的影响,来探讨Mfn2对TGF-β2诱导的LECs发生EMT的作用。
1 材料与方法
1.1 材料HLECs细胞系(SRA01/04)由中国医科大学附属第四医院眼科晶状体实验室提供;人TGF-β2(Human TGF-β2-Mammalian)、山羊抗兔二抗(美国PeproTech公司);pEGFP-Mfn2质粒合成(武汉金开瑞生物工程有限公司合成);RNAiso(美国Invitrogen公司);PrimerScriptTMRT 5酶混合液、SYBRPremix Ex Taq II(日本Takara公司);兔抗人Mfn2、Vimentin、E-Cadherin抗体(英国Abcam公司);ABI 7500实时荧光定量PCR系统(美国Applied Biosystems公司);荧光显微镜(日本Olympus公司)。
1.2 方法将TGF-β2作用24 h的HLECs作为TGF-β2处理组,转染pEGFP-Mfn2的HLECs作为转染组,自然生长不做处理的HLECs作为对照组。
1.2.1 细胞培养和处理将冻存的HLECs SRA01/04复苏后接种于含体积分数10%胎牛血清、100 U·mL-1青霉素和100 μg·mL-1链霉素的培养基中,置37 ℃、含体积分数5%CO2培养箱中培养,待细胞长到90%融合时用含2.5 g·L-1EDTA的胰蛋白酶消化传代。传代三次以上后取同代且生长状态良好的细胞进行实验。分别用浓度为10 ng·mL-1、50 ng·mL-1、100 ng·mL-1的TGF-β2作用于HLECs 24 h作为TGF-β2处理组,用于后续实验。
1.2.2 实时荧光定量PCR检测RNAiso plus试剂提取细胞内总RNA,Nano drop检测RNA浓度。利用RT 5酶混合液反转录获得cDNAs,以GAPDH作为内参。Mfn2引物序列:上游引物:5’-TCAGAGCCCGAGTACATGGA-3’,下游引物:5’-CGTTGAGCACCTCCTTAGCA-3’;E-Cadherin引物序列:上游引物:5’-GAAAGCGGCTGATACTGACC-3’,下游引物:5’-CGTACATGTCAGCCGCTTC-3’;Vimentin引物序列:上游引物:5’-GAGAACTTTGCCGTTGAAGC-3’,下游引物:5’-TCCAGCAGCTTCCTGTAGGT-3’;GAPDH引物序列:上游引物:5’-CGGATTTGGTCGTATTGGG-3’,下游引物:5’-TGCTGGAAGATGGTGATGGGATT-3’,反应体系20 μL。采用ABI 7500进行实时荧光定量PCR反应,经过3次独立实验,采用 2-ΔΔCt法定量分析TGF-β2处理组、转染组、对照组的Mfn2、E-cadherin和Vimentin的mRNA相对表达量,Graphpad prism 5作图并进行统计学分析。
1.2.3 细胞转染转染前1 d将HLECs按后续实验需要分别接种于6孔板和24孔板,并分为转染组和对照组。6孔板细胞铺板于2 mL含血清、不含抗生素的培养基中;24孔板细胞铺板于500 μL含血清、不含抗生素的培养基中。细胞达到50%融合时,6孔板转染组每孔加入10 μL Lipofectamine2000和4 μg pEGFP-Mfn2进行转染;24孔板转染组每孔加入2 μL Lipofectamine2000和0.8 μg pEGFP-Mfn2进行转染。6 h后,更换为含有血清的全培养基,在37 ℃、含体积分数5%CO2培养箱中培养48~72 h后检测转染水平进行后续实验。
1.2.4 免疫荧光细胞化学检测实验前将细胞铺板爬片并进行所需处理,实验第1天在培养板中将已爬好细胞的玻片用PBS清洗后,用40 g·L-1多聚甲醛固定15 min。体积分数0.5%TritonX-100室温通透20 min,再用PBS清洗3次,滴加山羊血清封闭30 min。滴加稀释好的兔抗人一抗4 ℃孵育过夜。实验第2天滴加稀释好的荧光山羊抗兔二抗,避光20~37 ℃孵育1 h。滴加DAPI避光孵育5 min,PBST清洗后用含抗荧光淬灭剂的封片液封片,在荧光显微镜下观察并采集图像。检测TGF-β2处理组、转染组与对照组的Mfn2、E-Cadherin和Vimentin蛋白表达变化。
1.3 统计学方法采用SPSS 17.0统计学软件对数据进行分析。数据用均数±标准差表示。两样本比较采用t检验。检验水准:α=0.05。
2 结果
2.1 TGF-β2处理组和对照组HLECs中Mfn2表达变化
2.1.1 TGF-β2处理组和对照组HLECs中Mfn2 mRNA表达变化实时荧光定量PCR检测结果显示,不同浓度TGF-β2(10 ng·mL-1、50 ng·mL-1、100 ng·mL-1)处理HLECs 24 h后,TGF-β2处理组Mfn2 mRNA表达量较对照组(0 ng·mL-1TGF-β2)均升高,差异均有统计学意义(均为P<0.001)。其中当TGF-β2浓度为100 ng·mL-1时,Mfn2 mRNA表达量升高最明显,见图1。因此,选取100 ng·mL-1TGF-β2作为后续实验的细胞最佳处理浓度。
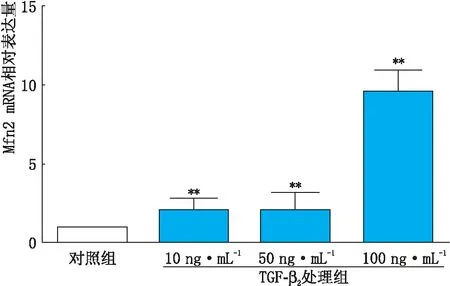
图1 TGF-β2处理组和对照组HLECs中Mfn2 mRNA TGF-β2浓度表达量变化 与对照组比较,**P
2.1.2 TGF-β2处理组和对照组HLECs中Mfn2蛋白表达变化免疫荧光细胞化学检测结果显示,细胞内Mfn2(红色)荧光亮度增强,数量增加,反映经最佳浓度100 ng·mL-1TGF-β2处理后,TGF-β2处理组Mfn2蛋白表达较对照组增加,见图2。
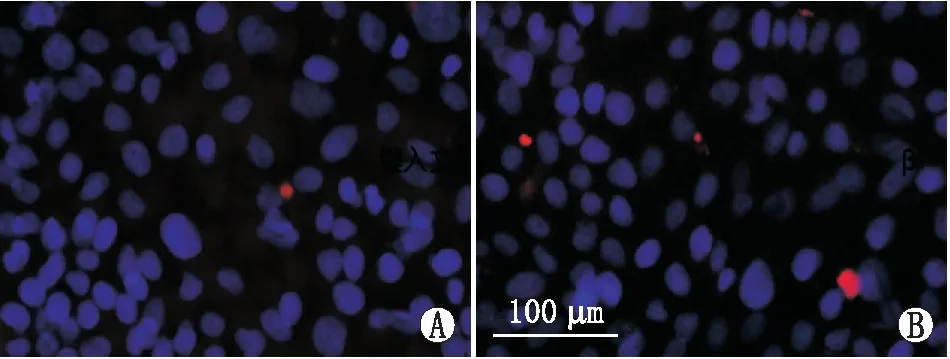
图2 TGF-β2处理组和对照组HLECs中Mfn2蛋白表达变化 HLECs核呈蓝色荧光(DAPI),Mfn2蛋白呈红色荧光。A:对照组;B:TGF-β2处理组
2.2 TGF-β2处理组和对照组HLECs中上皮标志物变化
2.2.1 TGF-β2处理组和对照组HLECs中E-Cadherin和Vimentin的mRNA表达变化实时荧光定量PCR检测结果显示,100 ng·mL-1TGF-β2处理组处理细胞24 h后,TGF-β2处理组与对照组相比E-Cadherin mRNA表达量下降,差异有统计学意义(P<0.001),Vimentin mRNA表达量升高,差异有统计学意义(P<0.001),见图3。说明在100 ng·mL-1TGF-β2作用细胞24 h后,在mRNA表达水平HLECs发生了EMT。
2.2.2 TGF-β2处理组和对照组HLECs中E-Cadherin和Vimentin的蛋白表达变化免疫荧光细胞化学检测结果显示,100 ng·mL-1TGF-β2处理组处理细胞24 h后,细胞内E-cadherin(绿色)荧光亮度降低,数量减少,反映了TGF-β2处理组E-Cadherin蛋白表达较对照组下降,Vimentin(红色)荧光亮度增强,数量增加,说明TGF-β2处理组较对照组Vimentin蛋白表达增加,见图4。即100 ng·mL-1TGF-β2作用24 h,在蛋白水平HLECs发生了EMT。
2.3 Mfn2转染后转染组和对照组HLECs上皮标志物变化
2.3.1 Mfn2转染后转染组和对照组E-Cadherin和Vimentin mRNA表达变化实时荧光定量PCR检测结果显示,pEGFP-Mfn2转染HLECs后,转染组Mfn2 mRNA表达量较对照组明显升高,差异具有统计学意义(P<0.001)。从mRNA水平证明pEGFP-Mfn2转染使Mfn2成功过表达,见图5。转染组E-Cadherin mRNA表达量较对照组下降,Vimentin mRNA表达量较对照组升高,差异均有统计学意义(均为P<0.001),见图6。从mRNA水平证明了过表达Mfn2可使HLECs发生EMT。
2.3.2 Mfn2转染后转染组和对照组HLECs中E-Cadherin和Vimentin蛋白表达变化免疫荧光细胞化学检测结果显示,细胞内Mfn2(红色)较对照组荧光亮度增强,数量增加,在蛋白水平反映了pEGFP-Mfn2转染HLECs后,转染组与对照组相比Mfn2蛋白成功过表达。且与对照组相比,转染组E-Cadherin(绿色)荧光强度减弱,表达明显减少,Vimentin(红色)荧光亮度增强,表达明显增加,见图7。说明在蛋白表达水平,过表达Mfn2可使HLECs发生EMT。
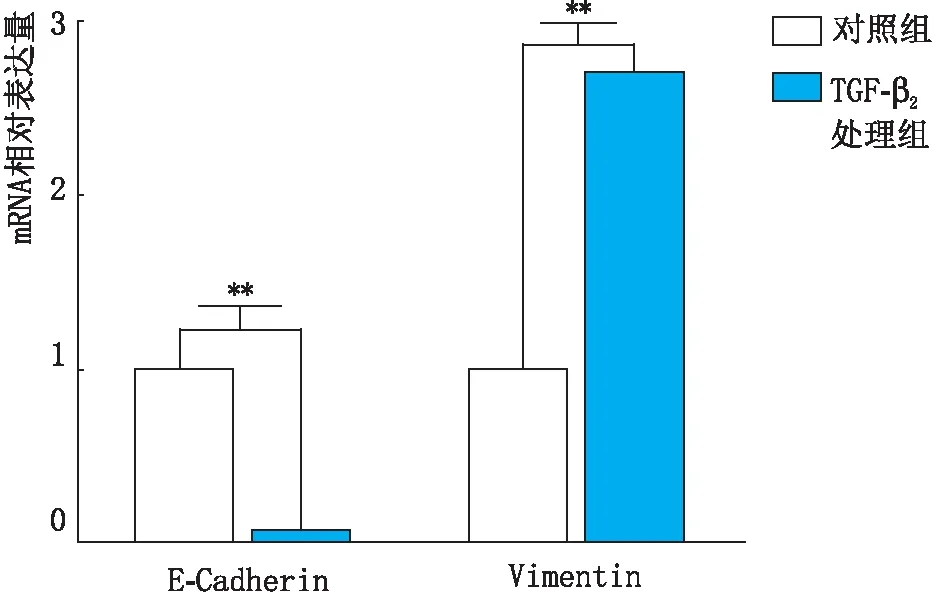
图3 TGF-β2处理组和对照组HLECs中E-Cadherin和Vimentin mRNA表达量变化 两组间比较,**P

图4 TGF-β2处理组和对照组HLECs中E-Cadherin和Vimentin的蛋白表达变化 HLECs核呈蓝色荧光(DAPI),E-Cadherin呈绿色荧光,Vimentin呈红色荧光
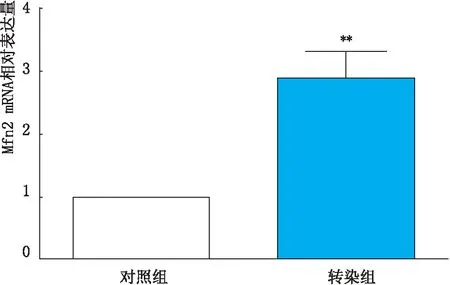
图5 pEGFP-Mfn2转染HLECs后转染组与对照组Mfn2 mRNA表达变化 与对照组比较,**P
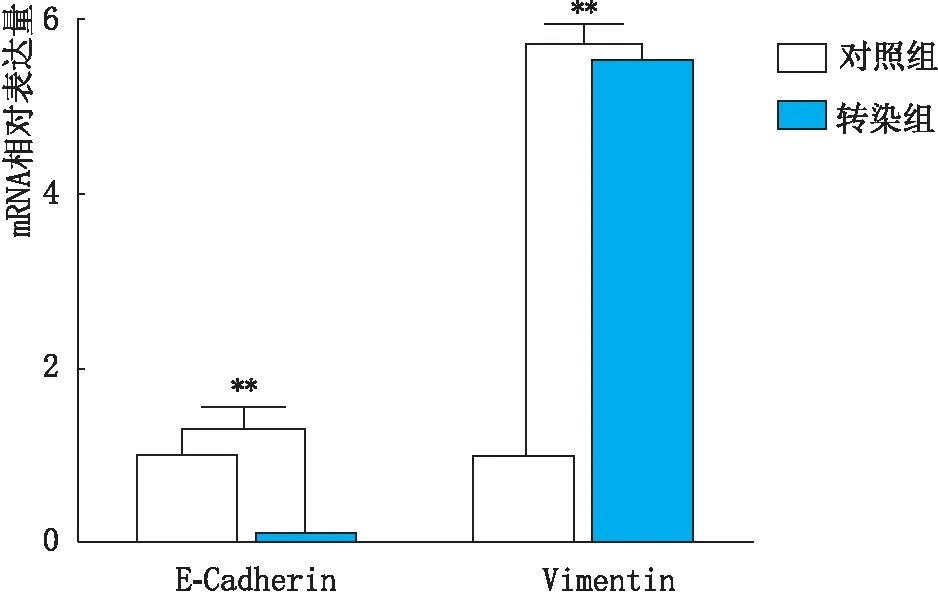
图6 pEGFP-Mfn2转染HLECs后转染组与对照组E-Cadherin和Vimentin的mRNA表达变化 两组间比较,**P
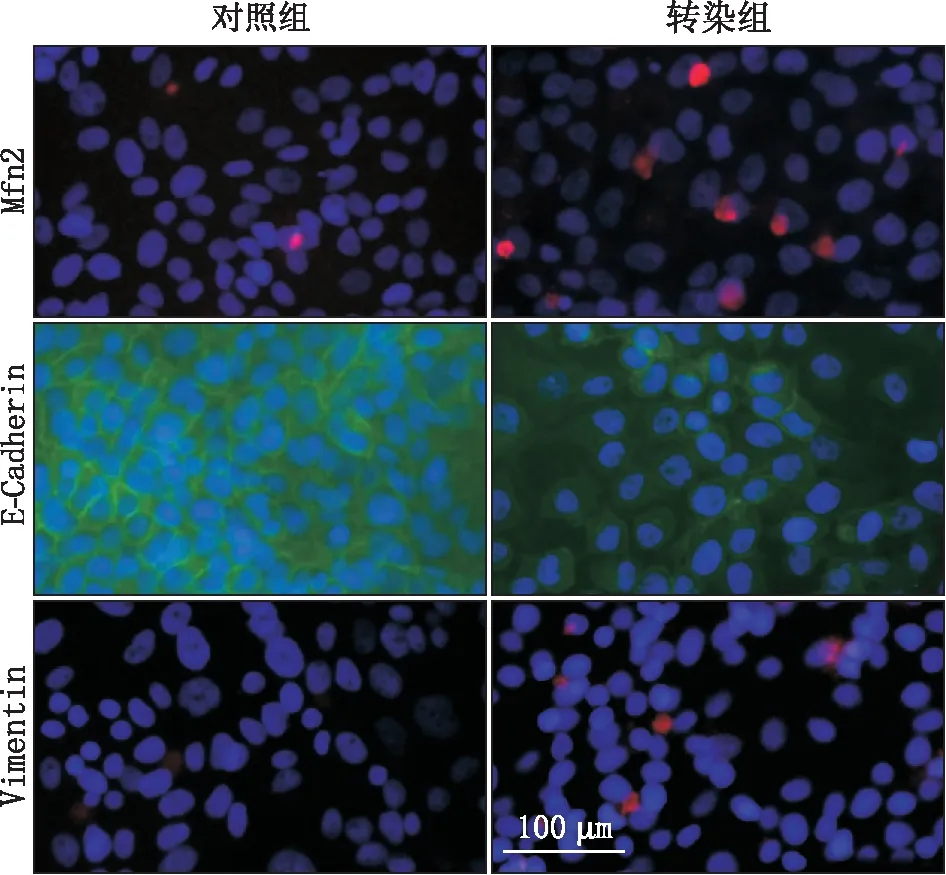
图7 pEGFP-Mfn2转染HLECs后转染组与对照组Mfn2、E-Cadherin和Vimentin的蛋白表达变化 HLECs核呈蓝色荧光(DAPI),Mfn2和Vimentin呈红色荧光,E-Cadherin呈绿色荧光
3 讨论
Mfn2是参与线粒体外膜融合的重要蛋白之一,Mfn2与细胞及细胞器多种生物学功能均存在着密切的关系。随着研究的不断深入,Mfn2在多种疾病的发生发展中发挥的作用也越来越受到关注。已有研究表明,在肾间质纤维化过程中,Mfn2 mRNA的表达量明显升高[5]。同时,Mfn2还参与调节了间质性膀胱炎的EMT过程,且表达上调[6]。EMT是上皮细胞通过特定的程序转化为具有间质表型细胞的生物学过程,也是白内障术后后发性白内障形成的重要原因。E-Cadherin是一种主要存在于表皮组织中的同亲型结合、钙依赖的细胞黏着糖蛋白,Vimentin是中间丝的其中一种蛋白质,上皮细胞发生EMT时的主要特征为细胞间黏附分子E-Cadherin表达减少、以细胞角蛋白细胞骨架转化为以Vimentin为主的细胞骨架及形态上具有间充质细胞的特征改变。研究表明,多种因素均参与了LECs发生EMT的过程,如结缔组织生长因子[7]、白细胞介素6等[8]细胞因子,miR-181a[9]、miR-26b[10]等非编码RNA及组蛋白去乙酰化酶(HDAC)[11-12]、缺氧诱导因子-1[13]、晚期糖基化终末产物AGE[14]等。
本研究发现,在TGF-β2的作用下,HLECs发生了EMT,将其作为后发性白内障的模型,与对照组相比,TGF-β2处理组中Mfn2 mRNA表达量明显升高,且蛋白表达增加,提示Mfn2参与了HLECs发生EMT的过程。pEGFP-Mfn2转染HLECs使Mfn2成功过表达后,与对照组相比,转染组上皮标志物E-Cadherin mRNA表达量下调,Vimentin mRNA表达量上调。E-Cadherin蛋白表达减少,Vimentin蛋白表达增加。进一步证明了Mfn2参与HLECs的EMT过程,而且过表达Mfn2会诱发HLECs发生EMT,但其具体作用机制有待进一步探究。
综上所述,Mfn2在后发性白内障的发病过程中起到了重要作用且表达上调,通过过表达Mfn2可诱发HLECs发生EMT,从而促进后发性白内障的形成。随着进一步深入研究,Mfn2有望作为后发性白内障生物治疗的新靶点,从新的角度为后发性白内障的预防和治疗提供思路。
