miRNA簇基因在山羊组织和不同时期的C2C12细胞的表达分析
2020-04-22任航行王高富孙晓燕
李 杰,任航行,王高富,蒋 婧,孙晓燕,周 鹏
(重庆市畜牧科学院草食牲畜研究所,重庆 荣昌 402460)
【研究意义】骨骼肌的形成是一个高度复杂且有序的生物学过程,主要包括成肌决定,成肌细胞增殖,细胞周期的退出,肌肉特异性基因的表达,肌细胞融合形成多核肌管,多核肌管再经过一系列发育变化, 最后分化成为具有功能的成熟肌纤维[1-2]。这些复杂过程的顺利进行不仅受许多编码蛋白的因子调节,如成肌调节因子家族(MRFs),肌细胞增强子因子2家族(MEF2)和对框基因(Pax)家族,而且还受到非编码RNAs的调控,如microRNAs (miRNAs)。【前人研究进展】miRNAs 是一类新发现的非编码小分子 RNA,长约22nt(核苷酸),通过与靶mRNA特异性的碱基互补配对,引起靶mRNA降解、稳定性下降或者抑制其翻译,从而调控基因的转录后表达水平[3]。研究表明,miRNAs参与了增殖、分化、凋亡、发育从细胞到个体的整个生命过程及肿瘤发生过程[4]。miR-665,miR-127-3p/5p,miR-136-3p/5p, miR-432-3p/5p和miR-433同位于山羊21号染色体,形成一个特殊的miRNA簇。笔者前期用高通量测序(RNA-Seq)法对Texel 羊(MSTN突变型)与乌珠穆沁羊(MSTN野生型)胎儿骨骼肌miRNA进行转录组测序,发现miR-127-3p与miR-1/206/133在两品种羊骨骼肌中在骨骼肌高表达miRNAs,且miR-127-3p在2个品种羊骨骼肌中差异表达[5]。Li 等的研究发现miR-127-3p在波尔山羊肌肉组织表达量高于巫山黑山羊,同时miR-127-3p 在增殖的C2C12细胞的表达量高于分化时期的细胞[6]。【本研究切入点】而位于同一个miRNA簇的miR-665,miR-127-5p,miR-136-3p,miR-136-5p,miR-432-5p,miR-432-3p和miR-433在山羊组织和细胞的表达模式目前尚未见相关的文献报道。本研究首先以波尔山羊体组织为试验材料,检测在不同组织中miRNA簇基因(miR-665,miR-127-5p,miR-136-3p,miR-136-5p,miR-432-5p,miR-432-3p和miR-433)的表达情况,接着分别检测C2C12细胞增殖与分化不同生肌时间点第0、2、4、6、8 天中miRNA簇基因动态表达模式。【拟解决的关键问题】为阐明miRNA簇基因在骨骼肌的生长发育的调控作用提供一定的理论依据。
1 材料与方法
1.1 试验材料
在巫山县振兴农牧科技开发有限公司随机选取3只成年的波尔山羊,屠宰后立即采集样品,DEPC水清洗后装管置于液氮中,用于肌肉组织RNA提取。C2C12细胞为本实验室保存。TRIzol Reagent购自invitrogen公司(美国);miScript Π RT Kit与miScript SYBR Green PCR Kit 均购自QIAGEN公司(德国);DMEM培养基购自gibco公司(北京);胎牛血清(FBS)、马血清(HS)和青链霉素购自HyClone公司(新西兰);其他化学试剂均为国产分析纯。
1.2 细胞培养
C2C12细胞生长培养基(GM)为含10 %胎牛血清的DMEM培养基。当细胞融合度达到85 %左右时更换为分化培养基(DM)为含2 %马血清的DMEM培养基,GE和DM中均需均加入1 %的双抗, 隔天更换一次培养基。分别在增殖和分化阶段的0、2、4、6、8 d收集细胞,用于提取细胞的miRNA。
1.3 miRNA的提取与反转录
组织提前用液氮充分研磨,细胞吸弃培养基后,用PBS清洗2~3次,加入 TRIzol 提取 RNA。组织和细胞的总RNA按照TRIzol Reagent(Invitrogen,美国)提取试剂盒的操作步骤提取。RNA完整性用1 %琼脂糖凝胶电泳检测,浓度和纯度采用 NanoDrop 2000 超微量分光光度计(Thermo,美国) 检测。经检测完整性良好的RNA用miScript Π RT Kit(QIAGEN,德国)反转录合成cDNA。其中反应体系为 20 μl,包含3 μl(400 ng/μl),5×miScript HiSpec Buffer 4 μl,10×miScript Nucleics Mix 2 μl,miScript Reverse Transcriptase Mix 2 μl,RNase ddH2O 9 μl。合成产物-20 ℃保存备用(表1)。

表1 miRNA 簇基因引物序列信息Table 1 Primer information of miRNA cluster genes
1.4 RT-qPCR
按照miScript SYBR Green PCR Kit(QIAGEN, 德国)试剂盒说明书,对组织与细胞进行荧光定量检测分析,U6作为内参基因。反应体系(20 μl):模板cDNA 1 μl,2×QuantiTect SYBR Green PCR Master Mix 10 μl,10×miScript Universal Primer和引物各1 μl,RNase ddH2O 7 μl。反应程序: 95 ℃ 预变性 15 min,94℃ 变性 15 s,55 ℃ 退火30 s,70 ℃延伸30 s, 共40个循环。每个样品重复3次,所有反应在7900HT Fast Real-Time PCR System(Applied Biosystems,美国)中进行。
1.5 数据分析
RT-qPCR中miRNA相对表达量用 2-ΔΔCT法计算,结果以平均值±标准误(mean±SE) 表示。
2 结果与分析
2.1 miRNA簇基因在山羊染色体的位置分布
由图1可知,miRNA簇基因分布于山羊21号染色体,miR-665位置较前,而其他miRNA在染色体的位置相对集中,依次为miR-433、miR-127-5p、miR-432-3p/5p, 最后是miR-136-3p/5p。miR-433与miR-127-5p所处的位置有部分重叠基因位点。通过BLAST (http://www. ncbi. nlm. nih.gov/) 比较分析miRNA簇基因成熟序列,发现其在哺乳动物中有较高的保守性。
Chromosome 21-NC_030828.1图1 miRNA簇基因在山羊染色体的位置Fig.1 miRNA cluster genes in the position of goat chromosome

图2 miRNA簇基因在波尔山羊体组织的相对表达量Fig.2 Relative expression of miRNA cluster genes in Boer goats tissues
2.2 miRNA簇基因在山羊体组织的表达分析
采用qRT-PCR方法检测波尔山羊的心、肝、脾、肺、肾和背最长肌组织中miRNA簇基因(miR-665,miR-127-5p,miR-136-3p,miR-136-5p,miR-432-5p,miR-432-3p和miR-433)的表达量。由图2 可知,miRNA簇基因(miR-665,miR-127-5p,miR-136-3p,miR-136-5p,miR-432-5p,miR-432-3p和miR-433)在山羊不同组织中均广泛表达。miR-127-5p,miR-136-3p, miR-432-5p,miR-432-3p和miR-433在肌肉中高表达,miR-136-5p和miR-665在肌肉表达量低。
2.3 miRNA簇基因在C2C12细胞不同生肌时间点的动态表达分析
培养C2C12成肌细胞,分别收集增殖和分化不同阶段的细胞样品,采用qRT-PCR分别检测在不同生肌时间点细胞中miRNA簇基因(miR-665,miR-127-5p,miR-136-3p,miR-136-5p,miR-432-5p,miR-432-3p和miR-433)的表达模式。由图3可知,miR-136-3p表达量随肌细胞增殖和分化逐渐增加,在培养的第8天中表达最高。miR-127-5p,miR-432-3p,miR-432-5p,miR-433和miR-136-5p表达量呈现先升高后降低的趋势,miR-127-5p和miR-433在增殖与分化的第6天的表达最高;miR-432-3p在增殖的第2天与分化的第6天表达最高;miR-432-5p在增殖的第4天与分化的第8天表达最高;miR-136-5p在增殖与分化的第2天表达最高。miR-665随C2C12细胞增殖和分化表达逐渐降低。
3 讨 论
通常miRNA与其宿主基因转录表达的同时会受到多种因子的调控,miRNA却往往表现出一定的组织和时空的特异性。miR-1/miR-206 /miR-133仅在肌肉组织中特异表达,而miR-127-3p在动物的多个组织广泛表达,且在肌肉、皮肤和脾脏中表达较高[6-7]。本研究采用qRT-PCR法对波尔山羊组织中miRNA簇基因的表达量进行检测,发现miRNA簇基因(miR-665,miR-127-5p,miR-136-3p,miR-136-5p,miR-432-5p,miR-432-3p和miR-433)在山羊不同组织中均广泛表达。miR-127-5p,miR-136-3p,miR-432-5p,miR-432-3p和miR-433在肌肉中高表达,miR-136-5p和miR-665在肌肉表达量低。揭示了miRNAs的组织表达特征,确定了miRNA簇基因与山羊肌肉表型的关系。骨骼肌的生长发育主要表现为肌细胞数量的增加和体积的增大,这两方面的顺利进行依赖于成肌细胞的增殖和分化[8]。miRNAs在转录后水平调控基因表达,在成肌细胞增殖和分化过程中发挥着重要的作用[9]。笔者近期研究发现 miR-127-3p 表达量随 C2C12 肌细胞分化逐渐增高,暗示 miR-127-3p 参与骨骼肌细胞分化的调控[6]。体外培养C2C12成肌细胞,采用qRT-PCR法分别检测在C2C12增殖和分化不同生肌时间点细胞中miRNA簇基因的表达水平。研究发现miR-136-3p表达量随肌细胞增殖和分化逐渐增加。miR-127-5p,miR-432-3p,miR-432-5p,miR-433和miR-136-5p表达量呈现先升高后降低,miR-665在C2C12增殖和分化的过程中表达逐渐降低。该研究首次确定miRNA簇基因在山羊体组织的表达水平,并分析C2C12细胞增殖和分化阶段的动态表达模式。
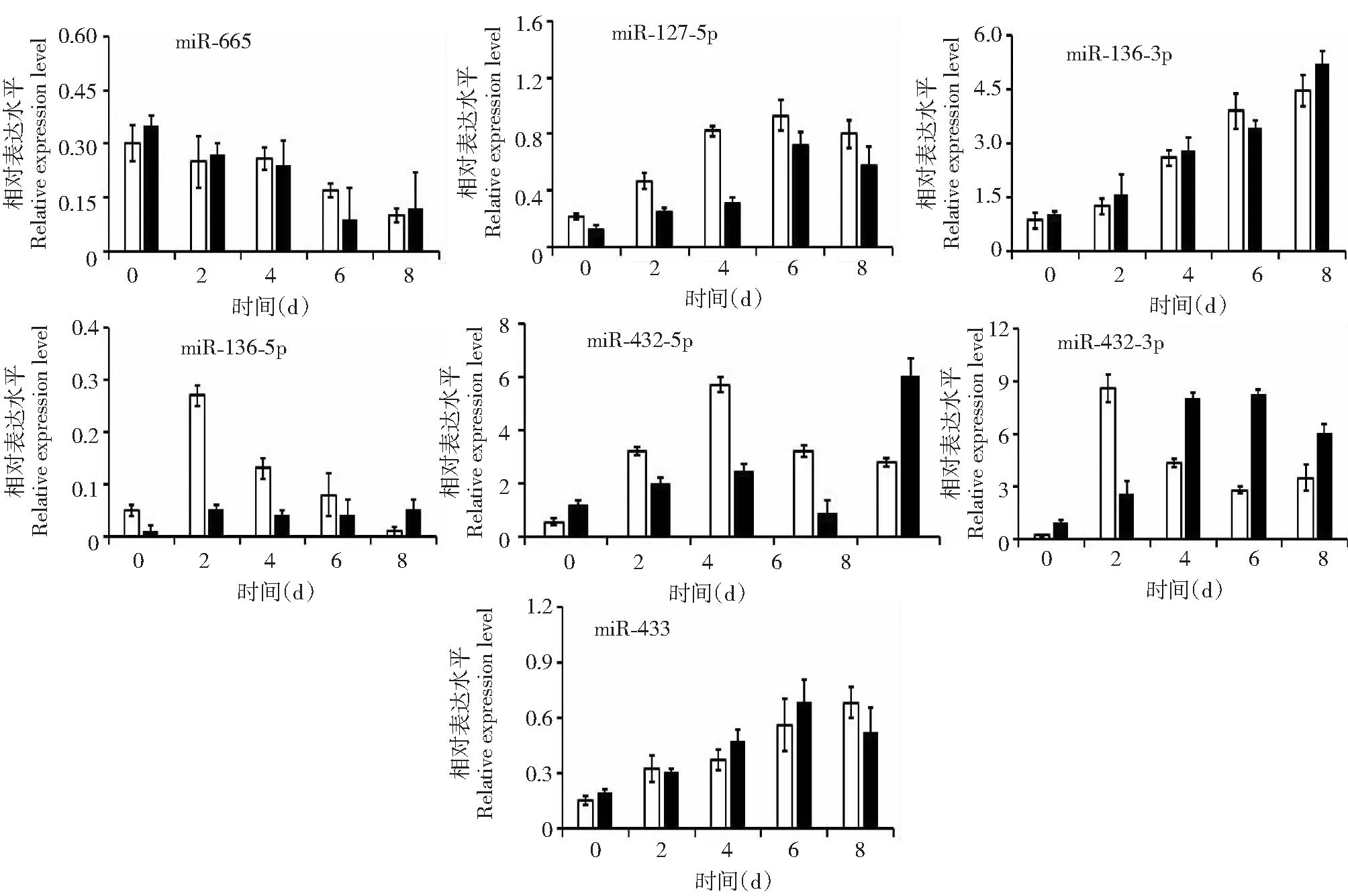
图3 miRNA簇基因在C2C12细胞增殖和分化的不同阶段的相对表达量Fig.3 Relative expression of miRNA cluster genes during C2C12 myoblast proliferation and differentiation
本研究发现miR-127-5p在山羊组织中广泛表达,其在增殖的C2C12细胞的表达量高于分化时期,这与笔者等[6]的研究确定miR-127-3p在山羊体组织广泛表达,其在增殖的肌细胞的表达量高于分化时期的结果是一致。但文献报道miR-127在桐城猪组织的表达高于长白猪,而且miR-127主要在胚胎发育的中后期保持较高的表达水平,在发育的早期和出生后表达相对低[7]。这显然不同于miR-127在猪上的研究报道。分析原因可能是miR-127 基因在经pre-miR-127剪辑后生成两种形式的成熟的miRNA:miR-127-3p 和miR-127-5p,而该研究仅是检测miR-127-5p的表达水平。miR-433在肌肉组织和C2C12细胞高表达,其与miR-127来自于同一个重叠基因位点,暗示miR-433可能也在成肌增殖与分化过程中发挥着重要的作用。但目前研究多集中报道miR-433抑制乳腺癌增长[10],食管癌的增殖与侵袭[11]以及人骨肉瘤细胞凋亡[12]等医学方面。miR-432基因在经pre-miR-432剪辑后生成两种形式的成熟的miRNA:miR-432-3p 和miR-432-5p。miR-432-3p在肌肉组织高表达,在增殖的C2C12细胞的表达量高于分化时期,暗示miR-432-3p可能参与骨骼肌肌细胞的生成,与肌肉生长发育密切相关。这与Ma等[13]发现miR-432在小鼠的组织与细胞的表达是一致的。但是Ma主要分析了细胞前期中的miR-432的表达,该研究检测miR-432-3p增殖与分化过程中不同时间点的表达。miR-432-5p在肌肉组织和C2C12细胞高表达,需要进一步的深入研究其在成肌细胞生成过程中的调控功能。miR-136-3p在波尔山羊肌肉组织中高表达,其表达量随着肌细胞增殖和分化逐渐增加。Lu等[14]高通量测序(RNA-Seq)法分析发现在猪骨骼肌miR-136表达量高。之前利用高通量测序(RNA-Seq)法对胚胎期和出生的简洲大耳羊的背最长肌miRNA进行转录组测序,发现miR-136-5p是骨骼肌高表达miRNA[15]。该研究主要分析成年山羊miR-136-5p的表达水平,可能是由于miR-136-5p在山羊的早期发育高表达,而成年后表达量减少。进一步揭示了miR-136对哺乳动物骨骼肌的生长发育起重要作用。研究报道miR-665抑制卵巢癌细胞的增长和迁移[16],同时MiR-665还抑制髓核细胞的增殖和基质降解[17]。miR-665在C2C12细胞增殖和分化的过程中表达逐渐降低。暗示可能其在C212细胞中是具有相同的抑制作用。
通过体内和体外研究分析miRNA簇基因(miR -665,miR-127-5p,miR-136-3p,miR-136-5p,miR-432-5p,miR-432-3p和miR-433)表达模式,确定在个体与细胞水平miRNAs的表达水平,系统阐述了miRNA簇基因表现出一定的组织和时空的特异性,揭示其对肌肉生长发育调控的分子机理,不但对将来畜禽基因工程育种,也对人类肌肉疾病的发病机理的研究与治疗提供参考。
4 结 论
体内组织检测发现,miRNA簇基因(miR-665,miR-127-5p,miR-136-3p,miR-136-5p,miR-432-5p,miR-432-3p和miR-433)在山羊不同组织中均广泛表达。miR-127-5p, miR-136-3p, miR-432-5p,miR-432-3p和miR-433在肌肉中高表达,miR-136-5p和miR-665在肌肉表达量低。体外细胞检测发现,miR-136-3p表达量随肌细胞增殖和分化逐渐升高;miR-127-5p,miR-432-3p,miR-432-5p,miR-433和miR-136-5p表达量呈现先升高后降低的趋势;miR-665在随C2C12细胞增殖和分化表达逐渐降低。综上,推测miRNA簇基因可能参与骨骼肌细胞增殖与分化的过程。下一步将通过构建过表达、干扰载体,转染卫星细胞或成肌细胞,系统阐述miRNA簇基因对骨骼肌生长发育的调控功能。
