易感线虫番茄品种Rutgers遗传转化体系的建立
2020-04-22吴文涛邓人可薛美静
吴文涛,董 莹,邓人可,薛美静,张 靖,王 扬
(云南农业大学植物保护学院,云南 昆明 650201)
【研究意义】番茄(Solanumlycopersicon)又称为西红柿、番柿,属茄科(Solanaceae),起源于热带和亚热带地区的经济作物。其营养丰富,味道独特,逐渐成为主要的蔬菜作物被世界各国广泛种植。另外,番茄作为一种重要的模式经济作物,与其他模式作物相比,除了具有基因组较小、遗传学基础雄厚等特点外,还具有独特的生物学现象(果实的发育、成熟过程等)[1-2]。因此,对番茄的遗传转化进行研究具有极其重要的意义。 根结线虫(Meloidogynespp.)是世界上分布最广、危害最重的植物寄生线虫,已引起广泛的关注,也是中国最主要的农作物病原线虫[3-5]。【前人研究进展】1932年中国首次报道了南方地区番茄发生根结线虫病,随后全国范围内10余个省(区)都有根结线虫病的爆发和危害,其蔓延迅速并逐年加重,一般每年造成10 %~15 %的经济损失,严重的达30 %~40 %,甚至绝产[6-7]。【本研究切入点】番茄是中国广泛种植的蔬菜作物,但大多数番茄品种对根结线虫均缺乏抗性。因此通过选育抗性品种加强对番茄根结线虫病的防控具有重要的现实意义[8]。Rutgers是国际上公认的易感线虫病的番茄品种,也被作为线虫抗感性评定的标准品种[9]。【拟解决的关键问题】因此选择Rutgers作为受体材料,建立其遗传转化体系,为番茄的抗根结线虫转基因育种奠定基础。
1 材料与方法
1.1 供试材料
以感病番茄品种Rutgers为实验材料。
1.2 载体、工程菌株和遗传转化方法
所用植物表达载体质粒为pCAMBIA1304,质粒上带有植物抗性筛选标记潮霉素磷酸转移酶基因Hyg;农杆菌菌株为EHA105;采用叶盘法作为遗传转化方法[10]。
1.3 培养基
1.3.1 种子萌发培养基 种子萌发培养基:1/2MS培养基+蔗糖30 g/L+琼脂8 g/L,pH值5.8。
1.3.2 诱导愈伤培养基 诱导愈伤培养基:MS培养基+ZT 2 mg/L + IAA 0.2 mg/L+蔗糖30 g/L+琼脂8 g/L,pH 5.8。其中IAA和ZT要在灭菌后添加。
1.3.3 共培养基 愈伤组织与农杆菌共培养的培养基:MS培养基+蔗糖20 g/L+葡萄糖10 g/L+琼脂8 g/L+乙酰丁香酮(Acetosyringone,AS)100 μmol/L 。
1.3.4 筛选培养基 愈伤组织与农杆菌共培养后,筛选农杆菌侵染成功的愈伤组织采用的培养基:MS+ ZT 2 mg/L+IAA 0.2 mg/L +蔗糖30 g/L+琼脂8 g/L+Cef 600 mg/L,分别加入 Hyg的浓度为10、20、30、50 mg/L。
1.3.5 芽诱导培养基 愈伤组织诱导再生芽的培养基:MS培养基+蔗糖 30 g/L+琼脂 8 g/L+6-BA+IAA,pH5。设计6-BA的浓度为 1.0、1.5、2.0、2.5 mg/L,IAA的浓度为0.05、0.1、0.15、0.2 mg/L,两者相互组合。灭菌后在培养基中加入Cef (200 mg/L) 和 Kana(50 mg/L)。
1.3.6 生根培养基 生根的培养基:1/2MS培养基+琼脂8 g/L+Kana 50 mg/L+IBA,设计IBA的浓度分别为 0.05、0.1、0.15、0.2 mg/L。上述各种培养基所用到的激素和抗生素均在灭菌后添加。
1.4 遗传转化方法
1.4.1 无菌苗的获得 将Rutgers番茄种子先用75 %的乙醇摇晃30 S,无菌水冲洗3~4次;用5 %的NaCIO溶液摇晃20 min至种子变白,再用无菌水冲洗5~6次后将番茄种子放于灭过菌的干燥滤纸上晾干,将晾干的番茄种子置于1/2MS培养基上,在26 ℃光照下萌发种子。
1.4.2 最佳苗龄测定实验 将5、7、9和11 d的无菌苗的子叶切下,接种于MS+ ZT 2 mg/L+ IAA 0.2 mg/L+蔗糖30 g/L+琼脂8 g/L的诱导愈伤组织培养基中,培养20 d左右,观察所选不同苗龄愈伤组织的生长情况,从而确定出最适合组织培养的番茄的苗龄[11]。
1.4.3 愈伤组织的培养 取9~11 d苗龄的番茄幼叶,将子叶切下,然后子叶顶端切去 1 mm,将剩余部分横切一刀分为2块大小相同的子叶块,子叶叶片均匀放在诱导愈伤培养基上,最后放到光照培养间25 ℃光照培养。
1.4.4 农杆菌悬浮液的准备 从平板上挑取含有pCAMBIA1304载体的单菌落,接种于5 mL YM液体培养基(加入Rif 20 mg/L和Kana 50 mg/L)中,28 ℃,180 r/min过夜培养。次日按照1∶50的比例接种到新鲜的YM液体培养基当中,28 ℃,180 r/min培养5~6 h至OD600值为0.6~0.8。将培养液5000 r/min,4 ℃离心12 min,去上清后加入重悬液,重悬至OD值达到0.3左右,最后加入100 μmol/L浓度的AS(乙酰丁香酮)混匀备用。重悬液为液体培养基,是在MS基础培养基中附加20 g/L D-葡萄糖和10 g/L蔗糖,117 ℃高温灭菌20 min(因含有葡萄糖,灭菌温度太高葡萄糖容易碳化)。
1.4.5 愈伤组织的侵染和共培养 将用来做转化的愈伤组织放到无菌三角瓶里,倒入适量重悬后加了AS的菌液,能没过材料高3 mm左右即可,放到摇床中100 r/min,20 ℃摇晃30 min。30 min后,在超净台中把材料倒在灭过菌、铺了滤纸的玻璃培养皿中晾干,然后将浸染好的愈伤组织放在铺放无菌滤纸的共培养基上,18 ℃ 暗培养 2 d。
1.4.6 侵染后愈伤组织的筛选 将共培养之后的愈伤组织接种到含有不同浓度Hyg的筛选培养基中,然后放在光照培养箱中培养。约15 d左右更换1次筛选培养基,共更换2次培养基,观察愈伤组织的成活率。
1.4.7 番茄再生芽诱导筛选 将筛选得到的长出芽点的愈伤组织转移到含有不同浓度的细胞分裂素(6-BA)和生长素(IAA)的芽诱导筛选培养基上,在25 ℃光照条件下培养,约2周左右继代1次,观察出芽情况。
不定芽的诱导率(%) = (分化不定芽的外植体数/接种外植体数) ×100[12]
1.4.8 转基因番茄苗的生根和移栽 先将筛选得到的番茄芽放入芽诱导培养基中生长至2 cm左右后,再放入含有不同浓度IBA的生根培养基中,在25 ℃光照下培养,观察番茄苗的生根情况。当转基因番茄苗生根以后,洗去根部培养基后移栽到土中。
1.4.9 目的基因的PCR检测 取长势良好的番茄植株,采用CTAB法[13]提取转基因番茄植株与普通植株的DNA,使用潮霉素抗性基因Hyg的特异性引物进行PCR特异性检测,Hyg上下游特异性引物为hyg(+):ACGGTGTCGTCCATCACAGTTTGCC, hyg(-):GGAAGTGCTTGACATTGGGGA。
2 结果与分析
2.1 不同苗龄对番茄愈伤组织诱导的影响
选取苗龄5、7、9和11 d番茄的子叶接种于诱导愈伤培养基中,苗龄5 d的番茄子叶接种7 d 后有 60 %子叶边缘发黑,另外40 %的子叶明显膨大,但并没有愈伤组织生成(图1A);苗龄7 d的番茄子叶接种 7 d 后有70 %子叶明显膨大,20 d后有少数膨大子叶分化出愈伤组织(图1B)。苗龄9和11 d的番茄子叶在接种7 d后有90 %子叶明显膨大,外植体颜色加深; 接种15 d后子叶切口处均产生大量愈伤组织,培养20 d左右,在愈伤组织上可见浅黄色的小突起,即为潜在的芽点(图1C、D)。所以应选取苗龄9~11 d的子叶作为最适宜的外植体。
2.2 不同浓度的Hyg对农杆菌侵染后愈伤组织分化的影响
将与农杆菌共侵染后的愈伤组织放入含有不同浓度Hyg的筛选培养基中可以发现,在含有10 mg/L Hyg的筛选培养基上愈伤组织的存活率最高,开始有芽点生成(图2A);在20 mg/L Hyg的筛选培养基上愈伤组织基本不能存活(图2B);Hyg的浓度越高,番茄愈伤组织的存活率越低,当Hyg浓度达到50 mg/L(图2D)。时,番茄愈伤组织几乎全部褐变死亡。因此,Hyg的浓度大约在10 mg/L时可以有效的筛选转基因的抗性芽。
2.3 不同激素浓度配比对愈伤组织诱导不定芽的影响
含有不同浓度的6-BA和IAA的再生芽诱导培养基对愈伤组织的芽诱导率差异明显(表1)。6-BA 2.0 mg/L+ IAA 0.1 mg/L处理番茄愈伤组织芽诱导率最高为55 %,6-BA 1.0 mg/L+ IAA 0.05 mg/L处理番茄愈伤组织芽诱导率最低为10 %。因此6-BA 2.0 mg/L+ IAA 0.1 mg/L为最理想的芽诱导培养基。

A:苗龄5 d番茄诱导的愈伤组织;B:苗龄7 d番茄诱导的愈伤组织;C:苗龄9 d番茄诱导的愈伤组织;D:苗龄11 d番茄诱导的愈伤组织A:5 days tomato seedling-induced callus; B:7 days tomato seedling-induced callus; C:9 days tomato seedling-induced callus; D:11 days tomato seedling-induced callus图1 不同苗龄子叶诱导愈伤的发育情况Fig.1 Development of cotyledon-induced callus in different seedling ages
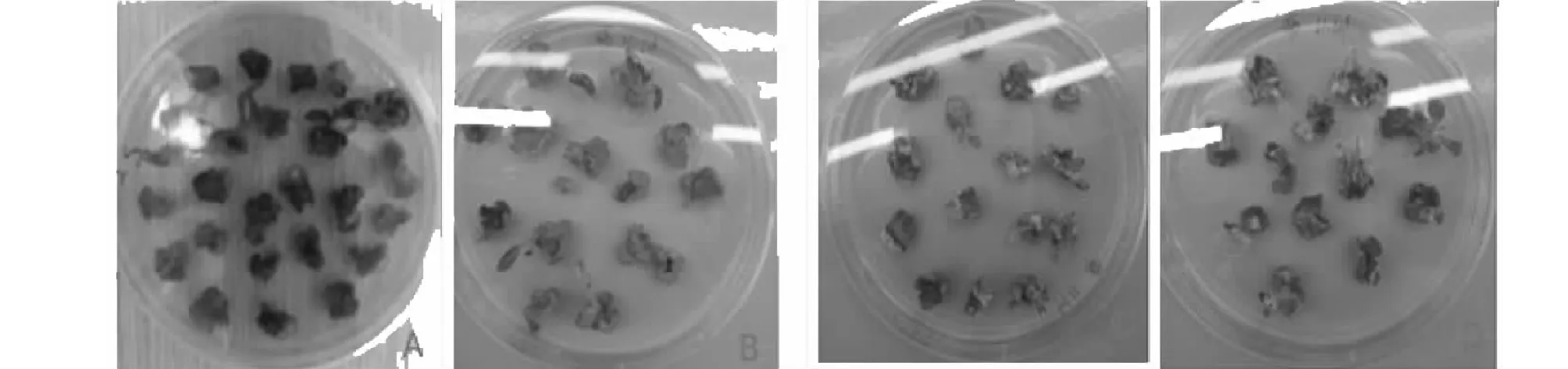
A:Hyg浓度为10 mg/L的筛选培养基;B:Hyg浓度为20 mg/L的筛选培养基;C:Hyg浓度为30 mg/L的筛选培养基;D:Hyg浓度为50 mg/L的筛选培养基A:Screening medium with a Hyg concentration of 10 mg/L; B:Screening medium with a Hyg concentration of 20 mg/L; C:Screening medium with a Hyg concentration of 30 mg/L; D:Screening medium with a Hyg concentration of 50 mg/L图2 不同浓度Hyg下愈伤组织的筛选Fig.2 Screening of callus under different concentrations of Hyg
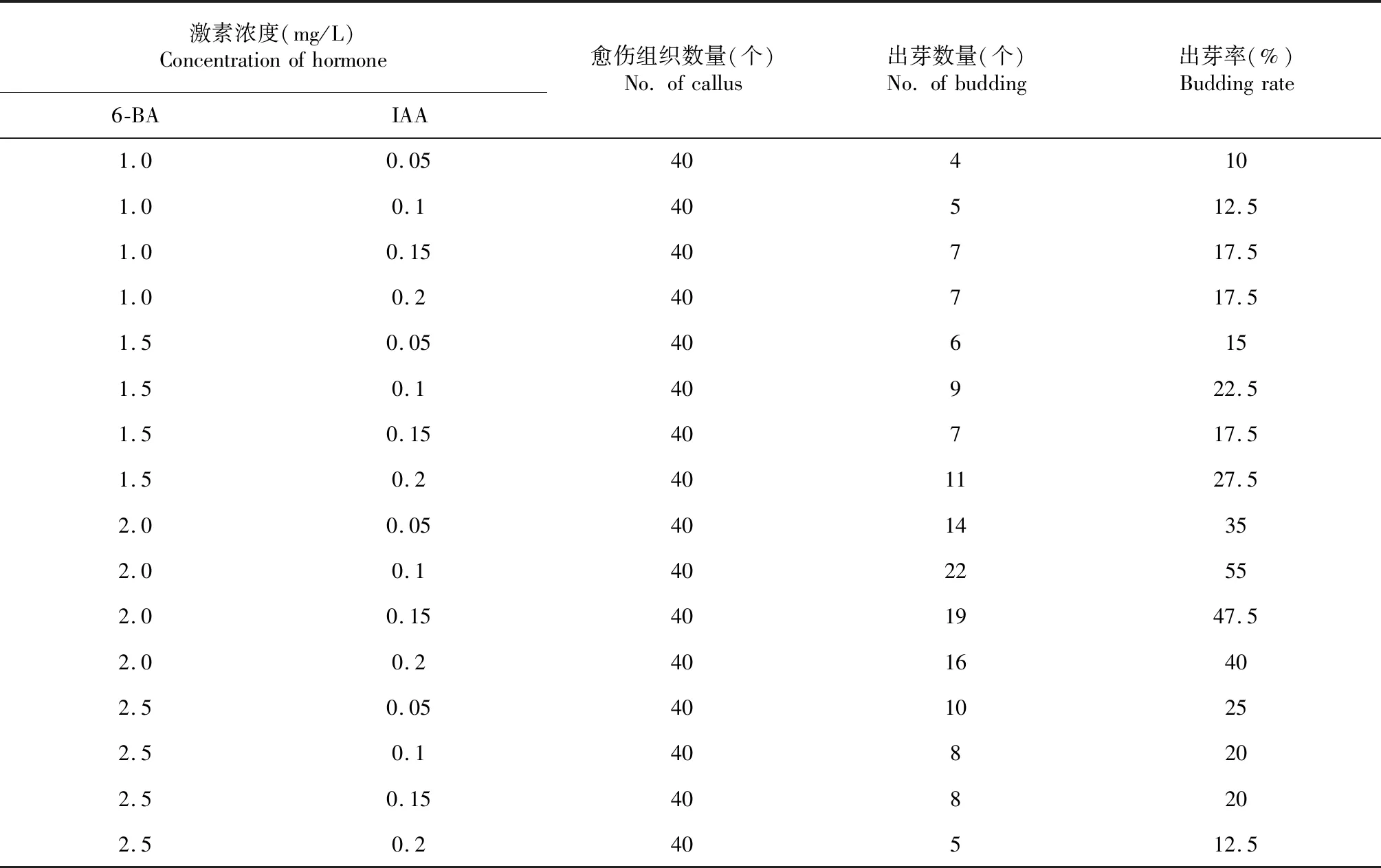
表1 不同浓度的6-BA和IAA的组合对番茄愈伤组织的芽诱导的影响Table 1 Effect of different concentrations of 6-BA and IAA on shoot induction of tomato callus
2.4 不同浓度IBA对番茄不定芽生根的影响
对转基因番茄不定芽进行生根诱导时发现,在生根培养基中添加0.1 mg/L IBA时,转基因番茄苗的生根率最高、生根时间最短,根生长状况最好。
2.5 转基因植株的获得
将生根的T0植株直接移入腐殖土中,在温室自然光照下生长,最终获得转基因抗性苗。图3显示了番茄遗传转化过程中的分化、生根和移栽的全过程。
2.6 目的基因的PCR分子检测
为了证明Hyg基因已经被整合到番茄基因组当中,对T0代转基因番茄做PCR检测,检测结果如图4,选取的3个转基因植株均扩增出280 bp的Hyg基因片段,而对照组的普通植株没有检测到Hyg基因,说明采取的试验方法可以获得Rutgers番茄品种的转基因植株。
3 讨 论
针对不同苗龄对番茄愈伤组织诱导影响,研究表明,Rutgers番茄品种苗龄9~11 d的叶片更容易分化出愈伤组织,分化率高于90 %。而苗龄低的叶片分化率极低,究其原因是苗龄较低的叶片修复能力较差,对其切割后影响其生理代谢功能和细胞的全能性发挥。而苗龄9~11 d的叶片自身的修复能力较强,生理代谢更为活跃,切割后更容易分化出愈伤组织、并成芽[14]。因此愈伤组织分化时应选择合适苗龄的无菌苗。

表2 不同浓度IBA对番茄不定芽生根的影响Table 2 Effects of IBA on root induction of processing tomato

A:无菌苗的培养阶段;B:子叶在诱导愈伤培养基上诱导分化愈伤组织阶段;C:农杆菌侵染番茄后的共培养阶段;D:愈伤组织在筛选培养基诱导不定芽阶段;E:生根培养基生根阶段;F:转基因苗生长阶段A: The culture stage of the sterile seedling; B: The cotyledon inducing the differentiation callus stage on the induced callus medium; C: The co-cultivation stage after the Agrobacterium infects the tomato; D:Induction of adventitious bud stage of the callus in the screening medium; E: Rooting stage of rooting medium; F: Stage of growth of transgenic seedlings图3 Rutgers番茄遗传转化的不同生长阶段Fig.3 Different development stages of transgenic Rutgers
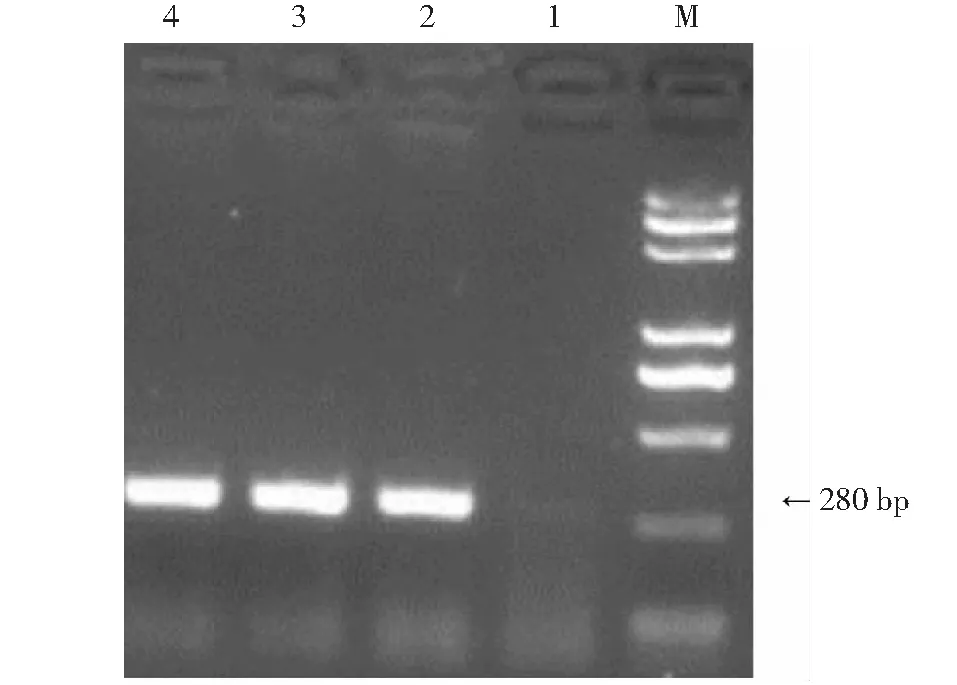
M:DNA标样; 1:普通番茄植株; 2~4:转基因番茄植株M: DNA standard; 1: Common tomato plants; 2-4: Transgenic tomato plants图4 转基因植株的PCR检测Fig.4 PCR detection of transgenic plants
细胞分裂素和生长素的浓度配比决定了番茄遗传转化体系中愈伤组织的出愈率、不定芽的诱导率和不定芽生根等各个环节。以番茄Rutgers为材料,不定芽诱导的最佳激素浓度配比为6-BA 2 mg/L+IAA 0.1 mg/L,与Carolina Cortina 等[15]研究在优化番茄M82的再生体系时发现不定芽诱导的最佳激素浓度配比为ZT 0.5 mg/L+ IAA 0.5v、张丽华等[16]研究加工番茄BO2和BO4的诱导芽培养基的最佳激素浓度配比为ZT 1.0 mg/L+ IAA 0.05 mg/L存在差异,究其原因与番茄的品种和基因型存在很大关联[17-20]。因此针对不同品种的番茄建立遗传转化体系,探索其诱导芽培养基的激素配比是尤为重要的方向。
不同番茄品种所用的生根培养基也大有不同,罗素兰等[21]在研究T79和T151番茄再生体系过程中认为最佳的生根培养基为MS+IAA 0.1 mg/L+蔗糖20 g/L,何秀霞等[22]得到的生根培养基为1/2MS+蔗糖3 %+琼脂0.7 %+IBA 1.0 mg/L,而番茄Rutgers的生根培养基为1/2MS基本培养基+8 g/L琼脂+0.1 mg/L。
4 结 论
目前报道有许多番茄的遗传转化方法和体系,如陈双臣等[23]建立了Micro-Tom番茄的遗传转化体系、乔亚红等[24]建立了加工番茄红番3号的遗传转化体系。但未见有关Rutgers易感线虫番茄品种遗传转化体系的报道,而利用转基因抗病品种解决番茄根结线虫病又是近年来最受关注的育种策略。因此以番茄Rutgers为研究材料,首次建立其遗传转化体系为后续番茄的抗根结线虫转基因育种奠定基础。
