棉花胞质雄性不育细胞形态学观察及生理生化特性的研究
2020-04-22李玉青王清连韦春艳陈全家周瑞阳
李玉青,王清连,韦春艳,董 涛,陈全家,周瑞阳
(1.新疆农业大学农学院,新疆 乌鲁木齐 830000;2.河南科技学院/现代生物育种河南省协同创新中心,河南 新乡 453003;3.广西大学农学院,广西 南宁 530004)
【研究意义】陆地棉是异源四倍体,世界上最重要的经济作物和油料作物,也是研究多倍体作物的模型[1-2]。随着经济和社会的发展,人们对棉花育种的综合优良品质提出了更高的要求,培育高产是植棉效益的基础,也是棉花育种的主要目标[3]。【前人研究进展】细胞质雄性不育(Cytoplasmic male sterility,CMS)为提高作物产量提供了一个优越的育种系统,CMS作为质-核互作雄性不育能通过“三系”杂交育种应用于生产,农作物通过杂种优势可以大型商业化生产F1杂交种子[4-5]。冀FRH3018、中棉所83的选育都是通“三系法”协同改良筛选出符合育种目标的棉花新品种[6-7]。【本研究切入点】本试验以细胞质雄性不育系C2P5A、保持系C2P5B为材料,观察不育系C2P5A雄性败育发生的时期和特点;测定生理生化指标的含量。【拟解决的关键问题】探寻C2P5A细胞质雄性不育系败育的原因,为棉花杂种优势的利用提供理论依据。
1 材料与方法
1.1 供试材料
不育系C2P5A,保持系C2P5B。2018年种植于河南科技学院棉花研究试验田地,按照常规方法进行田间管理。
1.2 试验方法
1.2.1 花器官观察以及花粉粒活力测定 在C2P5A不育株和可育株盛花期时,观察各株的花器官,在扫描仪上观察并拍照,花粉粒活力测定采用TTC染色,对两系进行育性鉴定。
1.2.2 细胞形态学观察 取花药的不同发育时期:小孢子母细胞时期(花蕾纵径3~4.0 mm)、四分体时期(花蕾纵径4.1~5.5 mm)、单核时期(花蕾纵径5.6~6 mm)、双核时期(花蕾纵径6.1~8 mm),成熟的花粉粒时期 (花蕾纵径8.1~10 mm), 花蕾纵径(从蜜腺到花蕾顶端的长度,mm)。用FAA固定液固定,石蜡切片分析花药的细胞形态学,按照常规程序进行石蜡切片,切片厚度8~10 μm,番红-固绿双重染色,生物学显微镜下观察并拍照。
1.2.3 生理生化指标测定 取花蕾、花朵和叶片进行测定。花蕾的3个时期:小孢子母细胞时期、四分体时期、双核时期,所测样品均以鲜重计。可溶性糖、可溶性蛋白、丙二醛(MDA)测定参考高俊风主编的植物生理学实验指导[8],过氧化氢酶(CAT)、过氧化物酶(POD)、脯氨酸测定参照王三根植物生理学实验教程[9];改良半叶片法测定光合速率[10],所有指标均设置3个重复,生理生化指标含量利用酶标仪TECHSPARK10M测定。
2 结果与分析
2.1 花器形态特征及花粉粒TTC活力测定
不育株与保持株花器形态上有很明显的差异,主要表现为不育系的整个花朵较保持系的小(图1-A)。包叶片小,花瓣小(图1-B)。不育系花柱裸露(图1-C)。不育系花丝明显比保持系短,没有花粉,在生长发育过程中可能出现褐化死亡(图1-D)。花粉粒经过2 % TTC染色,不育系的花粉粒干瘪,形态大小不均匀,多数不着色或着色浅,活力明显弱于保持系;保持系花粉粒饱满,大小均匀,染色着色深(图1-E)。

图1 细胞质雄性不育系和保持系花器形态结构及花粉粒活力Fig.1 The morphological structure and pollen grain vigor of CMS line and its maintainer

A~E为保持系花药,F~J为不育系花药。A、F为小孢子母细胞时期×400;B、G为四分体时期×400;C、H为小孢子单核时期×200;D、I为双核时期×200;E、J为成熟的花粉粒时期×200。MMC为小孢子母细胞;T为绒毡层; ML为中层;EN为药室内壁;E为表皮层;Tds为四分体;DMMC为降解的小孢子母细胞;Ms为小孢子;CDMMC为完全降解的小孢子母细胞;DT为降解的绒毡层;ET为完整的绒毡层; CT为致密的绒毡层;AAs为败育的花粉囊;AS为败育的花药;Pg为花粉粒;MPg为成熟的花粉粒图2 细胞质雄性不育系及其保持系不同时期花药观察Fig.2 Observed anthers from CMS line and its maintainer at different developmental stages
2.2 花药不同发育时期的显微结构
2.2.1 小孢子母细胞时期 保持系花药壁从外到内依次是表皮、药室内壁、中层、绒毡层4层组成,排列规则,能清晰观察到中层细胞核,绒毡层细胞核大染色深;4层细胞围绕在小孢子母细胞周围(图2-A)。不育系花药壁也有4层组成,但是它们的形状差别不大,特别是绒毡层细胞,体积及着色与其它药壁细胞相差不明显(图2-F)。
2.2.2 四分体时期 小孢子母细胞减数分裂形成四分体,保持系四分体时期的四层细胞有了显著差异,中层的细胞变得窄小,绒毡层细胞再进行发育,体积变大,细胞核变大、染色加深,并紧密围绕在小孢子四分体周围(图2-B)。不育系绒毡层没有发育还是整体在一起,并且与其它层紧密粘在一起,不育系小孢子母细胞开始解体(图2-G)。
2.2.3 小孢子单核时期 保持系绒毡层分泌胼胝质酶,降解围绕四分体周围的胼胝质,释放出单核小孢子,此时,绒毡层也开始解离提供营养(图2-C)。不育系小孢子母细胞完全解体与绒毡层连在一起,并形成致密的绒毡层(图2-H)。
2.2.4 双核及花粉粒成熟时期 保持系绒毡层降解(图2-D),被释放的单核小孢子作为营养吸收,单核小孢子发育成双核的花粉粒,并且成熟的花粉粒表面有刺突,绒毡层完全降解(图2-E)。不育系绒毡层薄壁细胞扩增,填充花粉囊,最终花粉囊内没有花粉粒的产生(图2-I)。
2.3 生理生化指标测定结果比较与分析
2.3.1 雄性不育系与保持系可溶性糖、可溶性蛋白、脯氨酸含量的比较 可溶性糖为花药发育及各物质合成提供能量和原料。从随着花药的发育,不育系和保持系花药中的可溶性糖含量都逐渐递增(3-A),且在花朵中都达到最高值,另外在花药发育的各时期中,保持系花药中的可溶性糖含量都高于不育系花药,在四分体时期、双核时期达到显著差异,花朵中二者的可溶性糖含量达到极显著差异。
可溶性蛋白质含多种氨基酸,为细胞发育提供保护。从图3-B中看出,不育系可溶性蛋白质的含量在花药发育各时期、花朵及叶片中都低于保持系,在花药的四分体时期、双核时期都达到极显著差异,花朵中达到显著差异。
脯氨酸(Pro)参与植物体内应激反应,是作物育种的一个重要生理指标,在逆境胁迫条件下,脯氨酸可以大量积累来对抗逆境胁迫如干旱、盐渍、寒冷等。脯氨酸的含量在保持系花药发育时期、花期一直递增(图3-C),在双核时期、花朵中二者含量的差异达到极显著差异,叶片中的含量二者达到显著差异。
2.3.2 雄性不育系与保持系CAT活性、POD活性、MDA含量及光合速率的比较 过氧化氢酶(CAT)可以清除生物体内的过氧化氢(H2O2),避免遭受H2O2的毒害。从图4-A看出,随着花药的发育, CAT活性在不育系、保持系中均呈现下降的趋势,且在花朵中达到最低值;在小孢子母细胞时期,CAT活性都达到最高值,保持系高于不育系,差异达到极显著水平;在四分体时期、双核时期CAT活性不育系高于保持系分别达到极显著差异、显著差异;叶片中CAT活性不育系高于保持系差异达到极显著水平。
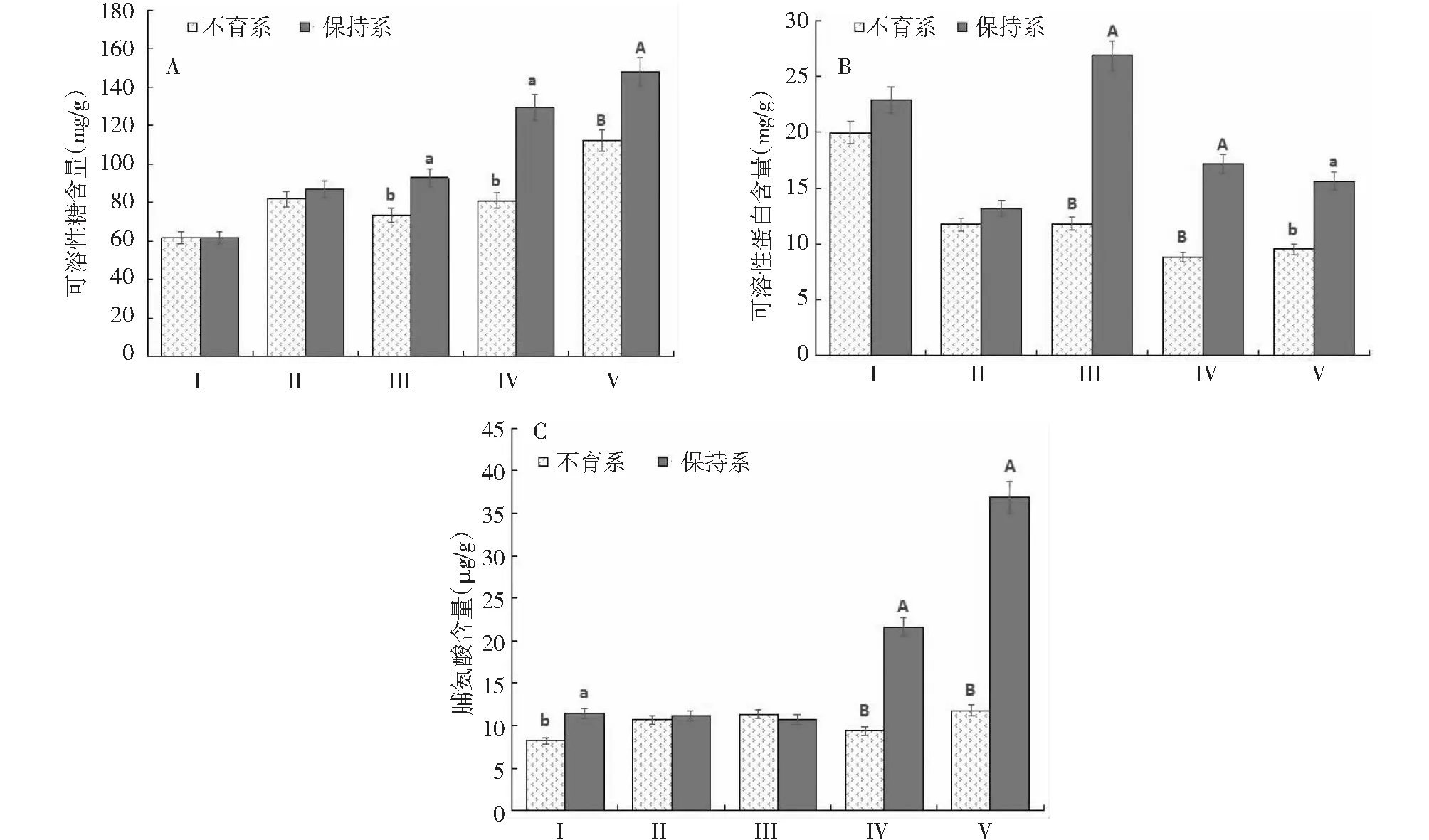
I、Ⅱ、Ⅲ、Ⅳ和Ⅴ分别表示叶片、小孢子母细胞时期、四分体时期、双核时期、花朵。下图相同注释。各图中小写字母代表0.05下差异,达到显著水平;大写字母代表0.01下差异,达到极显著水平;没有字母标记代表差异小,不显著图3 细胞质雄性不育系及保持系叶片、花药发育、花中可溶性糖(A)、可溶性蛋白含量(B) 及脯氨酸含量(C)Fig.3 CMS lines and maintainer lines leaves, anther development stage and flowers of soluble sugar content(A),soluble protein content(B) and proline content (C)
作为膜脂过氧化的产物丙二醛(MDA),它能加剧细胞膜的损伤,所以了解膜系统受损程度以及植物的抗逆性可以测定MDA。从图4-B可以看出,花药发育过程中,在不育系、保持系中MDA含量都逐步降低,但在同时期不育系的含量始终高于保持系;叶片中MDA含量不育系低于保持系。
过氧化物酶(POD)具有消除过氧化氢和酚类、胺类、醛类、苯类毒性的双重作用。图4-C显示,花药发育时期,不育系的POD活性总体呈现下降趋势;在小孢子母细胞时期及叶片中不育系的POD活性高于保持系,差异达到极显著水平,而在花朵中不育系的POD活性低于保持系,达到显著差异。
光合速率是植物光合效率的重要指标,光合速率越高,碳水化合物产生的越多。图4-D显示,在同等条件下,不育系的光合速率极显著低于保持系的光合速率。
3 讨 论
3.1 雄性不育系败育时期
研究[11-13]表明棉花不育系的败育时期主要发生在小孢子母细胞减数分裂时期,在减数分裂过程中解体。刘记等[14]研究新型光敏不育系,花药的败育主要发生小孢子单核后期;吴元龙[15]在研究不育系1355A观察到败育在小孢子时期,小孢子萎缩变形,花粉外壁没有棘突。
本试验石蜡切片观察到不育系的绒毡层细胞在小孢子母细胞时期较之保持系着色浅,在四分体时期较之保持系没有进行发育,导致不育系小孢子母细胞在进行减数分裂时没有得到绒毡层营养的供给,不能进行正常减数分裂,开始解体。
3.2 雄性不育与花药部分物质代谢的关系
小孢子发育过程中需要大量的蛋白质、氨基酸和糖类等营养物质作为生长发育的基础,周国昌等[16]花药发育过程中提出“物质亏损”,认为营养供应不足,导致小孢子异常发育。
本实验研究表明随着花药的发育,可溶性糖含量在不育系中都低于同时期的保持系,光合速率显著低于保持系,二者相吻合,即保持系产生的碳水化合物糖类高于不育系;花药发育时期,可溶性蛋白质的含量在不育系中都低于同时期的保持系,特别在四分体时期、双核时期含量极显著低于保持系,表明营养供应不足,是导致雄性不育的重要原因之一;脯氨酸含量在不育系中几乎都低于同时期的保持系,特别在双核时期、花朵中都达到极显著差异,这也是导致不育系花药发育瘦弱,褐化死亡,抗逆性差的原因,这些生理代谢异常都是造成小孢子母细胞败育的原因。
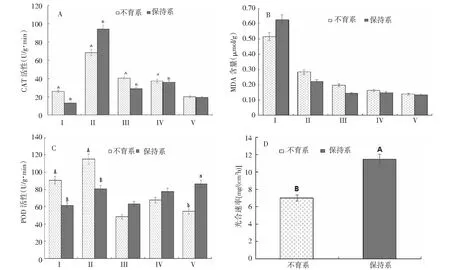
各图中小写字母代表0.05下差异,显著水平;大写字母代表0.01下差异,极显著水平;没有字母标记代表差异小,不显著图4 细胞质雄性不育系及保持系叶片、花药发育、花期CAT活性(A)、MDA含量(B)、POD活性(C)及光合速率(D)Fig.4 CMS lines and maintainer lines leaves,anther developments tage and flowers of CAT activity(A),MDA content(B),POD activity(C) and Photosynthetic rate (D)
3.3 雄性不育系与花药抗氧化系统中关键酶活性的关系
刘莉等[17]在水稻上的研究表明,在败育前期, CAT酶活性降低,不能及时清除体内产生的有害自由基,造成自由基累积,致使膜脂过氧化作用加剧,这与本试验结果一致,在败育前, CAT活性不育系显著低于保持系,对细胞造成毒害作用。
本试验POD活性不育系在败育前比保持系高,这与周仲华等[18]对棉花不育系的研究相一致,植物体内POD活性升高会促使生长素氧化分解,花药所需要的营养物质不能满足,另外造成花序中乙烯大量积累,造成细胞衰老,引起花药败育。
MDA在生物有机内活性氧毒害的指标,周仲华等研究表明植物体内含有较高的MDA是造成膜脂过氧化增强,造成败育的重要原因[18]。本试验不育系花药中膜脂过氧化产物的MDA含量高于保持系,活性氧毒害的程度较高,使细胞膜系统受到破坏或损伤,造成细胞内生理代谢紊乱,引起棉花雄性败育。
4 结 论
棉花细胞质不育系C2P5A与对照保持系比较,在花药石蜡切片中观察到不育系败育可能有以下两个原因,一绒毡层发育异常,不能及时提供营养给小孢子母细胞,造成败育;二绒毡层内部的薄壁细胞径向伸长,填充整个花药,花粉粒不能形成,造成败育。
测定生理生化指标,找出不育系形成败育的原因,其一可溶性糖、可溶性蛋白在不育系中的含量比同时期保持系低,造成不育系营养供应不足,使小孢子母细胞分化受阻,此分析与石蜡切片不育系绒毡层没有发育,营养供应不足造成败育相一致;其二MDA在不育系中的含量比同时期保持系高,活性氧对不育系的细胞膜造成伤害;在败育前,CAT活性过低,不能及时清除体内产生的有害自由基,致使活性氧毒害作用加剧,以上都是造成不育系败育的原因。
