黄花蒿离体再生体系优化研究
2017-04-26杨正修张学文罗莎龙炎杏赵燕
杨正修+张学文+罗莎+龙炎杏+赵燕


摘要:为优化黄花蒿(Artemisia annua Linn)离体再生体系,并建立黄花蒿遗传转化途径,选用黄花蒿常规品种428-A为材料,以子叶、幼嫩叶片、顶芽作为外植体,设计不同植物生长调节剂组合的培养基配方。结果表明,黄花蒿子叶适宜作为组织培养的外植体,MS+1.5 mg/L 6-BA+0.05 mg/L NAA培养基有利于诱导愈伤组织形成和分化,其出愈率及出芽率分别高达89.0%、85.7%,1/2MS+0.05 mg/L NAA+0.05 mg/L IAA培养基有利于再生植株不定根的诱导,生根诱导率达94.0%。
关键词:黄花蒿(Artemisia annua Linn);外植体;子叶;植株再生体
中图分类号:Q78 文献标识码:A 文章编号:0439-8114(2017)06-1161-04
DOI:10.14088/j.cnki.issn0439-8114.2017.06.042
Abstract: In order to optimize Artemisia annua Linn in vitro regeneration system and establish transformation way,the conventional varieties 428-A of Artemisia annua Linn as material was chose. Cotyledon,young leaves, crown were used as explant,the simple and effective regeneration system of Artemisia annua Linn was set up,by using different types and different concentrations of plant growth regulator of the formula. The results indicated that the young leaves is the best material for the tissue culture of explant. The best solid medium of callus formation and differentiation is MS+1.5 mg/L 6-BA+0.05 mg/L NAA,the rate of callus formation is 89.0% and the rate of budding is 85.7%. The most useful solid medium of inducing of root is 1/2MS+0.05 mg/L NAA+0.05 mg/L IAA, in which the rooting rate reached 94.0%.
Key words: Artemisia annua Linn; explants; young leaves; vitro
黄花蒿(Artemisia annua Linn)为一年生艾属菊科草本植物,在中国已经有两千多年的药用历史[1]。从黄花蒿中分离出的活性单体成分青蒿素(Artemisinin),被证明是一种高效、低毒、副作用小的新型抗疟活性成分,已广泛应用于临床[2]。同时青蒿素及其衍生物在抗肿瘤、抗心血管疾病、镇痛、免疫、抗血吸虫、抗病原虫等方面也具有显著疗效[3]。
黄花蒿在世界范围内分布广泛,产地环境条件差异大,青蒿素含量变化也十分明显[4]。在中国,青蒿中青蒿素的含量从南到北基本呈递减趋势,其提取成本高,导致青蒿素价格居高不下,难以满足市场需要[5]。近年来,人们尝试从组织培养及扩繁技术获得的黄花蒿中分离青蒿素,单位产量黄花蒿中分离的青蒿素含量高于野生黃花蒿[6]。通过植物组织培养技术进行离体快繁,不仅可为生产上提供大量黄花蒿试管苗,推动优质黄花蒿生产的发展,而且可使其成为提高青蒿素产量的重要途径[7]。
近年来,在黄花蒿的组织培养方面,目前已通过其叶片、茎尖、茎段、花序等多种外植体诱导愈伤及再生植株,但不同生长调节剂种类和组合,在不同基因型黄花蒿品种上应用差别较大,结果不尽一致[8],其组培过程中的玻璃化现象也较严重[9]。本试验分别以子叶、叶片、顶芽作为外植体,在不同组织培养阶段添加不同种类和不同浓度的植物生长调节剂以优化培养基配方,建立简单有效的再生体系,为黄花蒿的遗传转化和优良种质的保存及改良提供依据。
1 材料与方法
1.1 材料
黄花蒿种子为常规品种428-A,湖南农业大学生物科学技术学院朱卫平副教授惠赠。
1.2 培养基
1)基本培养基:MS+3%蔗糖+7%琼脂,pH 5.8。
2)愈伤组织诱导及分化培养基:以MS为基本培养基,设置NAA、6-BA、KT 3种植物生长调节剂的不同浓度组合,进行愈伤的诱导、增殖及不定芽分化培养。
3)不定芽生根培养基:以1/2MS培养基为基础,设置NAA、IAA的不同浓度组合诱导生根。
1.3 外植体的获得
1)将脱脂棉浸透MS液体培养基与培养皿一起经高压蒸汽灭菌备用。将黄花蒿种子放入离心管中,加入1 mL 0.1%HgCl2溶液,快速混匀、悬浮,6 000 r/min离心2 min,无菌条件下吸出升汞,再用无菌水清洗5~6次,然后将种子均匀铺到放有脱脂棉的无菌培养皿中,置于28 ℃恒温培养箱培养,使其发芽获得无菌苗。在黄花蒿幼苗生长的不同时间取发育良好的子叶、叶片和顶芽分别作为外植体接种到不同浓度配比的植物生长调节剂培养基上。
2)直接将种子播种在腐殖土∶蛭石(3∶1)的营养土上,3~4 d即可萌发,分别取长出子叶或叶片的健壮植株放入0.1%的HgCl2溶液中消毒10 min,切下子叶、叶片和顶芽作为外植体。
1.4 外植體的接种
将消毒的外植体接种于不同的培养基中,诱导愈伤的形成及分化,记录并统计出愈数、芽分化数;再将分化生长的无根苗接种在不同生根培养基中。培养条件为每日光照10~12 h,光照度为1 500~2 000 lx,温度(25±2) ℃。
1.5 数据分析
数据处理采用SPSS软件进行单因素方差分析。
2 结果与分析
2.1 外植体的获得
采用无菌苗和实生苗为外植体,分别于子叶期、幼苗期取材接种,两种来源的外植体中,无菌苗所取外植体,在后期培养时不易染菌,感染率较低,但种子无菌发芽时萌发较晚,且植株较自然条件下生长势偏弱,在后期诱导分化过程中生活力偏低。自然条件下发芽的实生苗植株较健壮,生长发育快,6~7 d子叶展开,7~14 d,幼苗长出两片羽状叶片,20 d后,幼苗部分叶片生长到2~3 cm时即可进行叶片外植体接种。由于实生苗生长健壮,取材方便,更适合大批量接种,但接种时应尽量减少感染。
2.2 植物生长调节剂对诱导愈伤组织形成和分化的影响
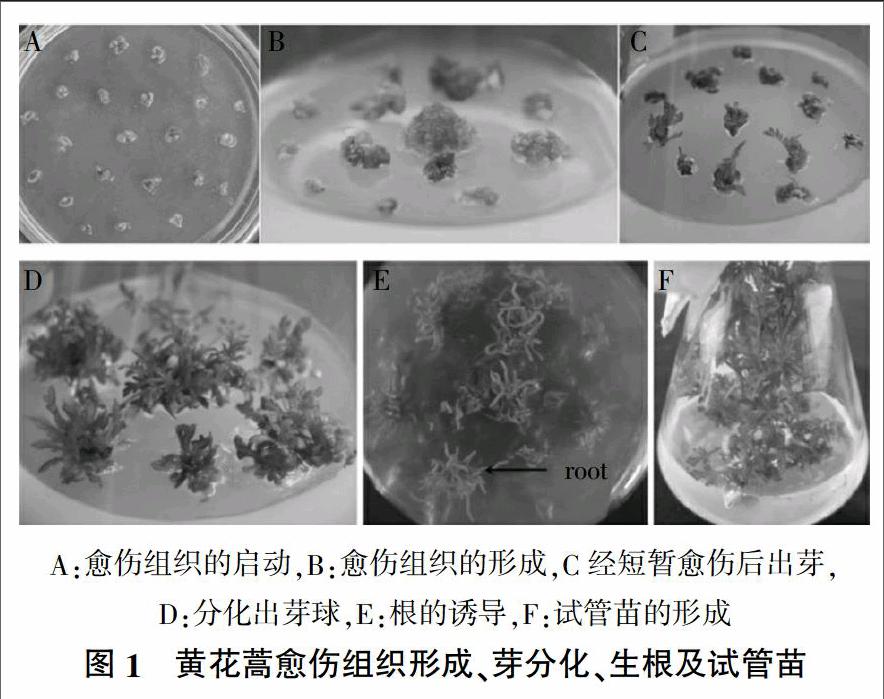
黄花蒿愈伤组织形成、芽分化、生根及试管苗如图1所示。
由表1可以看出,4~12号培养基均能诱导黄花蒿的子叶、叶片或顶芽等外植体形成愈伤组织,而1~3号、13~15号培养基外植体均未诱导出愈伤。通过对1~3号培养基与4~6号培养基比较可以表明,NAA对诱导愈伤组织的形成是必要的,1.0~2.0 mg/L 6-BA均能诱导愈伤组织,且当6-BA达到3 mg/L时易引起组织玻璃化,而1.5 mg/L 6-BA的浓度较为合适。
而在5、7、8、9号培养基中,1.5 mg/L 6-BA、0.05 mg/L NAA时,其诱导率和分化效率最佳。其中4、5、6号培养基的愈伤诱导率较高,且形成的愈伤色泽浅绿、结构致密,生长速度快,分生能力强,为典型的Ⅰ型愈伤组织。
对4~12号培养基研究表明,在黄花蒿的愈伤组织诱导中NAA和KT都是必需的植物生长调节物质,NAA比KT更能高效地诱导愈伤组织的形成和分化。通过对1-3号培养基单独添加6-BA的培养基和13~15号培养基同时添加6-BA、KT、NAA的培养基比较发现:外植体可以从器官型途径直接分化出芽,其中1~3号培养基出芽率偏低,丛芽生长缓慢,且当6-BA达到3 mg/L时易引起组织玻璃化。在13~15号培养基中,虽出芽率较1~3号培养基高,但总体效率较4~6号培养基低,虽然4~7号培养基要经过短暂愈伤才分化出芽,但其出愈时间快,且刚出愈后便迅速分化出丛芽,分化率高、时间短,而13~15号培养基虽直接出芽但其分化时间长,丛芽生命力差,生长缓慢。综上所述,5号培养基是诱导愈伤和分化不定芽的合适培养基。
SPSS单因素方差分析表明,本试验的P<0.001,差异极显著,说明由于培养基中生长调节剂不同造成的分生芽数量差异有统计学意义,生长调节剂种类和浓度能够极显著影响不定芽的产生和分化。
2.3 外植体对愈伤组织诱导的影响
分别以黄花蒿实生苗子叶、叶片、顶芽等作为外植体诱导分化,结果见表2~表4。子叶、叶片、顶芽均能诱导愈伤,其5号培养基诱导率均高于其他培养基,其中以子叶为外植体诱导率达最高到94%,出愈时间为最短(11 d),以羽状叶片为外植体诱导愈伤时,愈伤启动后叶片容易出现黄化且诱导时间较长,以顶芽为外植体诱导愈伤,虽然诱导率与子叶的诱导效果相差不大,但诱导时间比子叶平均长3.5 d,且接种过程中易造成感染,愈伤增值后容易褐化,不定芽分化率偏低。3种外植体中,子叶诱导的胚性愈伤组织,诱导时间短,效率高,后期的分化及出苗率均高于以叶片、顶芽诱导的愈伤。结果表明,在该基因型的黄花蒿子叶较适合作为外植体。
2.4 幼苗的生根
以1/2MS培养基为基础,设置NAA,IAA的不同浓度组合诱导生根,结果如表5所示。由表5可知,4种培养基都可诱导黄花蒿不定根的生成,只是生根时间和数量有差异。其中4号培养基,即1/2MS+0.5 mg/L NAA+0.5 mg/L IAA为生根较佳培养基,生根率高且根粗壮。当将幼苗接种于此培养基中时,第8天便有根出现,再过4~5 d不定根的数量增多,根系增长且粗壮。1号培养基,即1/2MS+0.2 mg/L NAA+0.2 mg/L IAA不定根的诱导效率偏低,可能是由于生长素浓度的降低,影响了根尖分生组织的分裂进而影响了生根效果。
SPSS单因素方差分析表明,试验中P<0.001,具有极显著性差异,说明植物生长物质种类和浓度的不同对幼苗生根的影响有统计学意义,是影响生根效率的重要因素。
3 讨论
3.1 植物生长调节剂的影响
在培养基中添加外源性植物生长调节剂时细胞分裂素与生长素的比例十分重要,是诱导愈伤组织的形成、分化以及正常分化成苗的关键因素,合适的植物生长调节剂浓度的选择有利于建立优化的再生体系,为后续的遗传转化研究提供基础。贾秀山等[10]认为诱导黄花蒿愈伤组织形成的最佳培养基配方为MS+2.0 mg/L 6-BA+2.0 mg/L KT;诱导黄花蒿愈伤组织分化的最佳培养基配方为MS+1.0 mg/L 6-BA+1.0 mg/L IAA。而本研究中发现,诱导黄花蒿愈伤形成的植物生长调节剂配比也刚好适用于不定芽的分化,因此愈伤诱导和不定芽分化可以同步进行,期间不需频繁更换培养基,这样可以大大缩短组培苗的时间,提高快繁效率,适应较大规模的试管苗繁殖。同时,黄花蒿愈伤诱导和不定芽分化同步进行的发育模式也为黄花蒿的遗传转化体系提供了简单方便的分化途径。唐凤鸾等[11]利用加入6-BA和IBA的培养基诱导黄花蒿生芽,张丽珍等[12]利用6-BA+IBA的培养基诱导叶片出愈及分化。而本研究则利用6-BA与NAA的组合培养基诱导愈伤及分化出芽,且分化效率较高,其结果丰富并优化了黄花蒿快繁体系的生长调节剂种类。于飞飞等[13]认为外植体在MS+1.0 mg/L 6-BA+0.5 mg/L NAA培养基上诱导丛生芽效果最好,这与本试验结果有差异,分析原因可能与不同基因型的黄花蒿品种内源激素差异有关。王梦琼等[6]利用6-BA与KT的组合对黄花蒿叶片、花序进行芽的诱导,诱导结果不佳,本研究用其组合诱导子叶出芽,其诱导效果同样不理想。说明KT在黄花蒿外植体出芽诱导中作用可能不大。
3.2 外植体的影响
黄花蒿组织培养的研究主要集中在诱导分化的方式与外植体的选择上。不同外植体的分化难易程度各不相同,这与外植体的生长情况、生理生化特性等紧密相关。赵欣等[14]利用MS+0.5 mg/L 6-BA+0.5 mg/L IBA的培养基组合以青蒿的根、茎、叶片作为外植体诱导愈伤组织,其诱导效率以根为最佳,茎和叶片次之。杨耀文等[15]利用黄花蒿幼嫩的花序,茎段诱导愈伤组织的形成分化,发现花序的增殖率是茎段的2~3倍。贾秀山等[10]分别对叶片、带腋芽的花序、和茎段进行诱导分化,其中叶片诱导愈伤出愈率较低,但后期愈伤组织的分化率、出苗率都很高,带腋芽的茎段诱导愈伤组织形成最快,但分化率较低,易褐变,花序基本不形成肉眼可见的愈伤组织,而是直接形成幼苗。王梦琼等[16]以黄花蒿花序为外植体分别进行愈伤组织诱导及芽和根的分化,结果黄花蒿愈伤组织诱导率为100%,芽分化率为100%,根的分化率可达85%。本研究中以叶片为外植体的诱导结果与上述研究结果有相似之处,采用顶芽为外植体其诱导、分化效率与伍晓丽等[17],张伟华[18]报道的一致。但以子叶作为外植体诱导愈伤和丛芽时,发现子叶的诱导效率更优于叶片和顶芽,且取材方便、实用,该结果可为黄花蒿快繁体系的优化,建立黄花蒿遗传转化体系提供有效途径。
参考文献:
[1] 钟国跃,周华蓉,凌 云,等.黄花蒿优质种质资源的研究[J].中草药,1998(4):264-267.
[2] 陈迪钊,郑雪花,张智慧,等.黄花蒿中青蒿素含量的紫外分光光度法测定[J].光谱实验室,2010,27(2):451-454.
[3] 静 一,罗安才.青蒿素生物合成研究进展[J].安徽农业科学, 2010,38(4):1698-1701.
[4] 韦美丽,崔秀明,陈中坚,等.黄花蒿栽培研究进展[J].现代中药研究与实践,2005,19(5):60-64.
[5] 杨丽英,李绍平,董志渊,等.黄花蒿良种选育和繁育技术初步研究[J].西南农业学报,2009,22(4):1069-1072.
[6] 王梦琼,王满元,崔俊茹,等.现代生物技术结合传统栽培方法在黄花蒿种植中的应用[J].安徽中医学院学报,2009,28(5):79-82.
[7] 耿 飒,叶和春,李国凤,等.中药青蒿的生理生化特征及其研究进展[J]应用与环境生物学报,2002,8(1):91-97.
[8] 寻晓红,蒋泰文,彭晓英,等.黄花蒿试管苗再生途径及多倍体诱发的研究[J].湖南农业大学学报,2003,29(2):115-119.
[9] 张丽珍,杨冬业,靳振江,等.青蒿组织培养中克服玻璃化现象研究[J].北方园艺,2010(23):120-122.
[10] 贾秀山,廖宇静,于飞飞,等.黄花蒿组织培养研究[J].生物技术通讯,2008,19(2):259-262.
[11] 唐凤鸾,韦记青,蒋运生,等.黄花蒿组培快繁与种质离体保存的研究[J].热带亚热带植物学报,2008,16(5):486-490.
[12] 张丽珍,徐淑庆,杨冬业,等.青蒿组织培养及其快速繁殖研究[J].生物学通报,2010,45(3):48-50,63.
[13] 于飞飞,廖宇静,贾秀山.青蒿离体快繁技术研究[J].西南师范大学学报(自然科学版),2008,33(1):116-120.
[14] 赵 欣,何利明,尹 静,等.栽培型与野生型青蒿愈伤组织及毛状根的诱导[J].中国农学通报,2012,28(28):239-244.
[15] 楊耀文,李保军,张廷襄,等.黄花蒿组织培养的初步研究[J].云南中医学院学报,2001,24(2):8-19.
[16] 王梦琼,崔俊茹.应用组织培养及扩繁技术迅速扩大黄花蒿优良品种的栽培[J].北京中医药,2009,28(12):1674-1307.
[17] 伍晓丽,刘 飞,李隆云,等.青蒿叶片愈伤组织的诱导和植株再生[J].时珍国医国药,2007,18(5):1106-1107.
[18] 张伟华.不同激素组合影响黄花蒿快速繁殖的初步研究[J].长春理工大学学报(综合版),2006,2(4):169-171.
