原发性中枢神经系统生殖细胞肿瘤3例临床病理分析
2020-04-21吕晶,梁奕,梁琰
吕 晶,梁 奕,梁 琰
中枢神经系统生殖细胞肿瘤(central nervous system germ cell tumors, CNS GCT)属于罕见的原发于中枢神经系统的恶性肿瘤,多发于年轻人及儿童,占儿童颅内肿瘤2.3%。根据有关文献报道[1],亚洲国家CSN GCT的发病率明显高于欧洲国家。国内对CNS GCT临床特征的总结属于经验性诊断,多无明确的病理诊断,因此有可能混杂其他疾病,导致其临床特点及治疗预后的报道不够准确。本文收集3例颅内原发性生殖细胞肿瘤,分析其临床特点、影像学特征、病理组织学形态及免疫表型等,旨在提高临床与病理医师对该病的认识水平。
1 材料与方法
1.1 临床资料收集长江航运总医院2012年1月~2018年12月诊治的3例颅内原发性生殖细胞肿瘤。
1.2 方法标本均经10%中性福尔马林固定,石蜡包埋,HE染色。采用免疫组化EnVision两步法染色,抗体包括PLAP、CD117、PCK、EMA、CD30、α-FP、GFAP、NSE和S-100蛋白,分别购自北京中杉金桥公司和福州迈新公司。
2 结果
2.1 临床资料例1男性,19岁,于1周前无明显诱因突发剧烈头痛,持续性胀痛,休息后无明显缓解,恶心并呕吐数次为胃内容物,非喷射性,非咖啡样液,无呼吸困难,无抽搐,无大小便失禁。头颅CT示“颅内占位,脑积水”,头颅MRI示“鞍区、三脑室占位,脑积水”,予脱水、对症治疗,效果不佳,遂转我院求治。例2男童,10岁,于1周前无明显诱因出现呕吐,非喷射性,呕吐物为胃内容物,非咖啡渣样液,当时按肠胃炎处理,予以对症处理后好转,无昏迷,无发热,无呼吸困难,无肢体抽搐,无大小便失禁。头部CT示:左侧额颞占位并出血,现转我院治疗。例3男童,5岁,于2018年10月21日无明显诱因突发头晕,持续半小时,伴呕吐2次,呕吐物为胃内容物,无头痛,无腹痛、腹泻、腹胀,无畏寒发热,精神食欲一般,未予特殊治疗,当天排便1次后呕吐好转,未发作头晕及呕吐,2018年10月25日患儿再次出现呕吐(合计6次),呕吐物为胃内容物,呕吐后诉头晕,无发热寒战,无腹痛、腹胀,精神反应欠佳,神志嗜睡,于当地诊所口服头孢类药物,未见好转,头颅CT示“松果体占位,脑积水”,予以甘露醇脱水治疗后,患儿病情未见明显好转,转入我院治疗。
2.2 影像学特征例1头颅MRI示鞍上池区及三脑室区肿块并脑积水,MRV双侧横窦部分显示欠清(图1)。在全麻下行右额开路经胼胝体入路肿瘤切除,术中于第三脑室和鞍区处见一病变,灰黄色,质韧,呈鱼肉样,边界不清,血供丰富,大小5 cm×4 cm×0.5 cm。例2头颅MRI示左侧基底节区肿块,考虑胶质瘤(图2)。患儿于急诊全麻下行左额颞开颅肿瘤切除+去骨瓣减压术,术中于左侧基底节区见一直径5 cm肿瘤,呈暗红色,边界欠清晰,血供丰富,质地软韧,肿瘤前半部可见明显出血及血凝块,瘤周脑组织肿胀明显。例3头颅MRI示松果体区占位性病变及脑积水(图3)。于全麻下行脑肿瘤切除,术中见第三脑室后部松果体区有一肿瘤,大小3 cm×3 cm×4 cm,肿瘤外层质硬韧,色白,边界清晰,可见毛发组织,血供一般;内层色暗红,血供丰富,有包膜,可见脂肪组织。
2.3 病理检查例1:灰白、灰褐色不整形碎组织一堆,大小5 cm×4.5 cm×0.5 cm;部分区域见腺管状结构,软骨样基质,其内可见夹杂小血管,部分区域瘤细胞大小较一致,核呈圆形或卵圆形,呈片状分布,内见钙化(图4)。免疫表型:PLAP(图5)、CD117生殖细胞均(+),PCK腺上皮(+),EMA部分腺上皮(+),α-inhibin、α-FP、vimentin、NSE、GFAP、Syn、CD99、CD45和S-100蛋白均(-),Ki-67增殖指数>30%。
例2:灰白、灰红色碎组织一堆,大小4 cm×4 cm×4 cm;瘤细胞密集增生,围绕血管形成乳头状结构,其内血管丰富,部分瘤细胞胞质丰富,透明状,可见大片坏死及出血,核分裂象可见(图6)。免疫表型:PCK(+),CD30、α-FP生殖细胞均(+),S-100蛋白(点+),NSE(±),GFAP、EMA、vimentin、PLAP、β-HCG、Syn和CgA均(-),Ki-67增殖指数约50%。
例3:灰褐色囊壁样碎组织一堆,大小5 cm×3.5 cm×1.5 cm,壁厚0.2~0.6 cm,其中可见灰黄色头结样物1枚,直径约1.8 cm;可见数量不等的未成熟胚胎组织,主要为原始神经小管或少数菊形团样结构(图7)。免疫表型:NSE原始神经管(+),S-100蛋白少数上皮、腺管(+),GFAP少数上皮及上皮巢(+),CKpan上皮(+),EMA少数上皮(+),Ki-67增殖指数>60%。
2.4 病理诊断例1:(第三脑室及鞍区)恶性混合性生殖细胞肿瘤,镜下可见精原细胞瘤和畸胎瘤成分,结合临床其他部位(尤其是睾丸生殖系统等处)均未见原发灶,该例考虑为原发性。例2:(左额颞)恶性生殖细胞肿瘤,镜下可见卵黄囊瘤成分,结合临床其他部位(尤其是睾丸生殖系统等处)均未发现原发灶,该例考虑为原发性。例3:(松果体区)未成熟性畸胎瘤(在低倍视野中见少数原始神经管)。
2.5 治疗与预后例1术后予以全脑加脊髓放、化疗,并随访患者6年,复查肿瘤无复发,预后尚可。例2术后予以全脑加脊髓放、化疗,并随访患者5年,复查肿瘤无复发,预后尚可。例3术后暂未行相关治疗。
3 讨论
CNS GCT是由原始生殖细胞向多个方向分化的异质性肿瘤,而中枢神经系统的生殖细胞肿瘤是一组罕见的主要发生于儿童和青少年的肿瘤。文献表明[2-3]14岁以前发病者占5%~40%,20岁以前发病者约占90%,男女发病率比约为3 ∶1;其组织形态和生物学行为与起源于性腺和其他性腺外的生殖细胞肿瘤相同。
CNS GCT是起源于胚胎的生殖细胞,而胚胎生殖细胞又可向多种细胞分化,属多能干细胞。其中CNS GCT的精原细胞瘤和无性细胞瘤相同,其原理多数人赞同胚芽移行异常学说。胚胎发育至3 cm时出现原始生殖细胞,经卵黄囊和原始系膜迁移至泌尿生殖嵴,迁移途中残留细胞巢则成为生殖细胞肿瘤的细胞来源。残留的原始生殖细胞属于多能分化细胞,具有多向分化的潜能。原始生殖细胞向绒毛膜细胞分化可形成绒毛膜癌,向上皮方向分化时则形成胚胎性癌,向卵黄囊方向分化则形成内胚窦瘤或卵黄囊瘤,向多个胚层方向分化则形成畸胎瘤,未分化的原始生殖细胞增殖则形成生殖细胞瘤[4-5]。但Sano等[6]认为生殖细胞肿瘤不是由单一的原始生殖细胞构成,而是由原始生殖细胞中不同分化阶段的细胞组成,由较晚分化阶段的细胞构成的肿瘤恶性度较低,由较早分化阶段细胞构成的肿瘤恶性度较高。
CNS GCT最常见于松果体、鞍上区,少见部位如基底节、第三脑室、小脑等也可发生。WHO(2016)将颅内生殖细胞肿瘤分为7个亚型:(1)生殖细胞瘤(对应睾丸和纵隔的精原细胞瘤,卵巢的无性细胞瘤);(2)畸胎瘤(成熟畸胎瘤、未成熟畸胎瘤);(3)畸胎瘤恶变;(4)卵黄囊瘤;(5)胚胎性癌;(6)绒毛膜癌;(7)混合性生殖细胞肿瘤(含2种或2种以上成分)。组织学类型的多样性是因为起源于不同发育阶段的原始生殖细胞,向胚外分化形成卵黄囊瘤和绒毛膜癌,向胚胎分化形成畸胎瘤,保持未分化状态则形成生殖细胞瘤。预后与肿瘤的类型和组织学分级相关,优劣依次为成熟性畸胎瘤、生殖细胞瘤、未成熟性和恶性畸胎瘤、胚胎性癌、卵黄囊瘤和绒毛膜癌[7]。颅内生殖细胞肿瘤常见的肿瘤标志物有AFP、β-HCG、PLAP。血清肿瘤标志物的检测对鉴别诊断CNS GCT有重要意义[8]。原发于鞍上区的CNS GCT可影响视丘-垂体系统,主要表现为尿崩症,其他症状包括头痛、呕吐、青春期发育迟缓、生长延迟、闭经、下丘脑综合征、海绵窦综合征、视力下降、视野缺损。松果体区的CNS GCT易造成梗阻性脑积水,表现为癫痫样发作、肿瘤压迫以及其造成的高颅压危象。诊断时同时累及鞍上及松果体双部位的CNS GCT,100%有尿崩症,其他表现为颅内压增高症状及垂体前叶功能减退。33.3%患者首发表现为轻偏瘫,16.7%患者表现为嗜睡、淡漠、反应迟钝、纳差、食欲减退;其他表现包括局部抽搐、视力下降、视野缺损。若CNS GCT位于大脑及小脑半球,由于肿瘤的直接压迫,加上周围组织的水肿,大部分表现为头痛、呕吐和视乳头水肿、意识障碍等颅内压增高症状,也可表现为肢体偏瘫、抽搐、流涎等局灶体征。
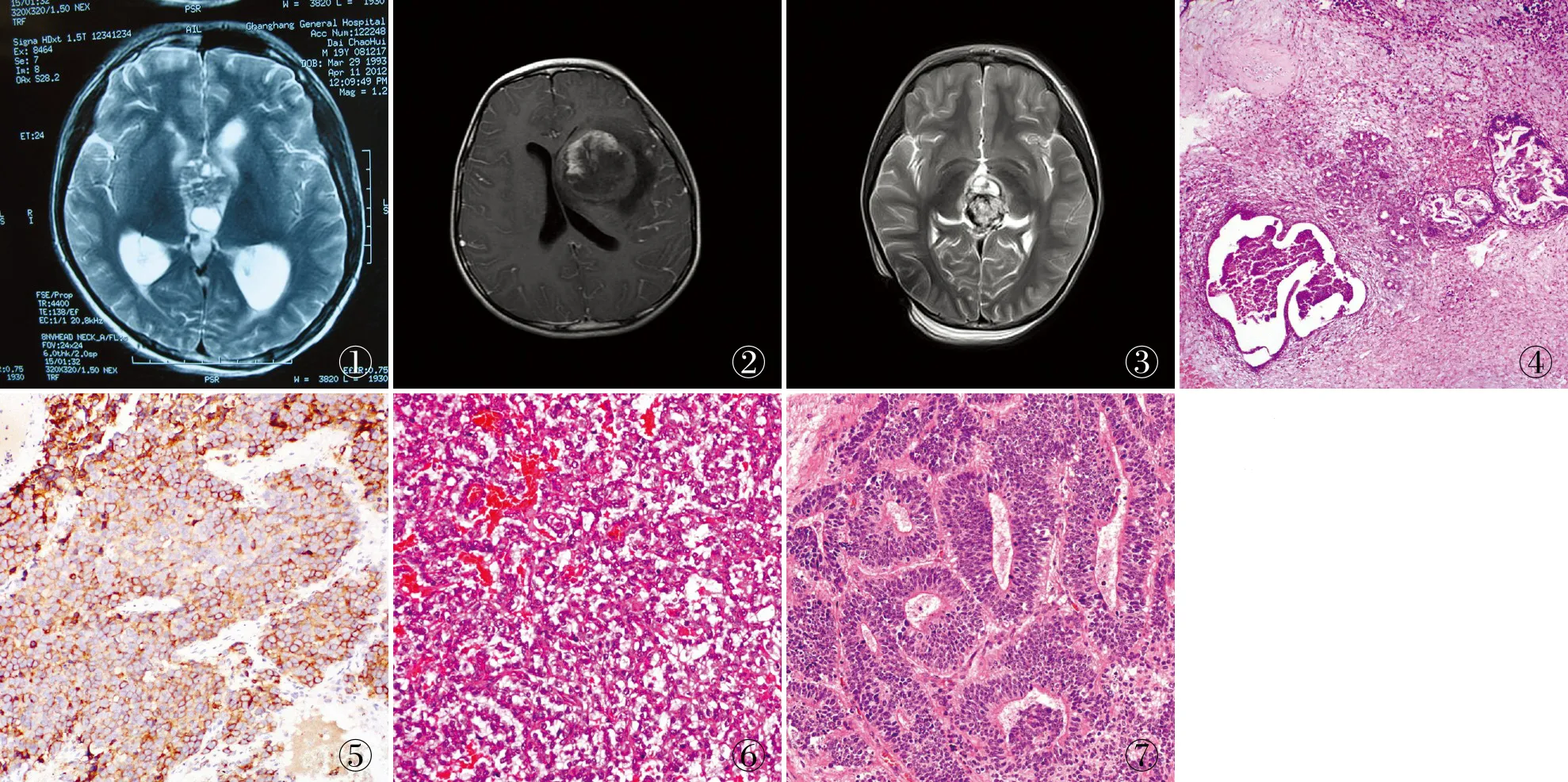
图1 例1:MRI示鞍上池及第三脑室不规则混杂T2信号肿块,内见囊变区 图2 例2:MRI示左侧基底节区类圆形占位 图3 例3:MRI示松果体区外形不规则的团片状占位图4 例1:(第三脑室及鞍区)恶性混合性生殖细胞肿瘤,部分区域见腺管状结构,软骨样基质
图5 例1:PLAP生殖细胞阳性,EnVision两步法 图6 例2:(左额颞)恶性生殖细胞肿瘤,镜下可见卵黄囊瘤成分 图7 例3:(松果体区)未成熟性畸胎瘤;见少数菊形团样结构
由于MRI对软组织分辨率较好,能清楚显示颅内肿瘤,是发现颅内占位的首选影像学检查,并可全面评估CNS GCT侵犯的范围、有无播散及转移,还可监测肿瘤大小,从而评估疗效。文献报道MRI在肿瘤早期的敏感性较低[9],因此各级医院应提高对CSN GCT的认识,对于病因不明的中枢性尿崩症和其它内分泌异常应行头颅MRI检查,从而避免延误诊断。患者在出现影像学可见的病灶前,激素水平可能已经有异常[9],尤其是尿崩症,往往是鞍上区CNS GCT的早期表现,为诊断提供了线索。因此,对垂体前叶功能和肿瘤标志物的敏感性均比影像学检查更高,对于病因不明的尿崩症患儿应定期检测。
因CNS GCT的肿瘤细胞成分多样,其分泌多种物质,如癌胚抗原、绒毛膜促性腺激素、生长激素、甲胎蛋白、胎盘碱性磷酸酶等,它们主要存在于血清和脑脊液中,且肿瘤细胞成分的不同,其分泌的肿瘤标志物也不相同。但是在非颅内的生殖细胞肿瘤中,这些标志物也可以升高,因此不能作为诊断的金标准。最近有文献表明,肿瘤标志物仅对准备进行激素替代治疗时有一定的参考价值[10]。
CNS GCT肉眼可见呈灰白色,质软或质脆;镜下见肿瘤细胞呈片、巢状或散在分布。肿瘤细胞巢内、外均可见散在的淋巴细胞浸润,肿瘤细胞与淋巴细胞的比例变化较大,有时有大量淋巴细胞,而仅见分散的瘤细胞;有时见大片肿瘤细胞,而仅有个别淋巴细胞。肿瘤细胞大小一致,泡状核,核偏大,核仁明显,圆形,胞质空泡状或透明,可见核分裂,可伴有坏死和出血,其周围间质反应明显,伴有条索状纤维组织增生,瘤体内可见钙化和砂粒体[11]。CNS GCT免疫表型多样化,其中精原细胞瘤表达CD117、OCT4、PLAP和PCK,本组例1中PLAP和CD117生殖细胞均阳性,PCK腺上皮阳性;卵黄囊瘤的瘤细胞表达α-FP、CD30和PCK,本组例2中α-FP和CD30均生殖细胞阳性,PCK上皮阳性;畸胎瘤的瘤细胞表达NSE、S-100及PCK,部分表达GFAP及EMA,本组例3中NSE和S-100原始神经上皮阳性,PCK腺上皮阳性,部分表达GFAP及EMA。
由于CNS GCT患儿外科手术风险程度高,国内诊断CNS GCT多采用诊断性放、化疗。随着微创外科技术发展,国外有研究认为[12]神经内镜下活检/切除术及立体定向脑活检可大大降低手术风险,且减少并发症。放疗范围原则上与生殖细胞肿瘤相同,但其对放疗的敏感程度低于生殖细胞肿瘤,放疗剂量较高。单纯的CNS GCT对放疗敏感性好,脑脊髓放疗后,10年生存率超过85%。本组3例均行手术切除,其中例1、2术后均予以全脑加脊髓放、化疗,且例1术后随访6年,例2术后随访5年,预后均可。因此治疗前明确病理类型,从而制定最佳治疗方案、提高疗效至关重要[3]。