芦丁和阿魏酸与酪蛋白的相互作用研究
2020-04-21王旭苹程镜蓉刘学铭1
雷 选,王旭苹,程镜蓉,刘学铭1,,*
(1.江西农业大学 生物科学与工程学院, 江西 南昌 330045;2.广东省农业科学院 蚕业与农产品加工研究所/农业农村部功能食品重点实验室/广东省农产品加工重点实验室, 广东 广州 510610)
酪蛋白(casein,Cs)在牛乳中的含量最为丰富,约占总蛋白质含量的70%~80%,含有人体所需的必需氨基酸,具有丰富的营养价值及促进钙铁离子吸收等生理功能[1]。Cs来源广泛、价格低廉、安全无毒且稳定性好,通常用它来运输小分子活性物质。芦丁属于黄酮类化合物,具有很高的药用价值和营养价值,可作为食品加工中的添加剂和抗氧化剂。阿魏酸是肉桂酸的衍生物之一,广泛应用于食品加工、医药制造等领域。
芦丁和阿魏酸等小分子活性物质在机体发挥作用时,需要被运送到细胞中,此过程会受到多糖、蛋白质等生物大分子的影响。在乳品加工领域,功能性乳制品越来越受到重视,而酚类物质与乳蛋白的相互作用对产品品质和功能有重要影响。目前已有相关文献对酚酸类物质与蛋白质相互作用机制进行了部分研究。Wang等[2]发现牛血清蛋白与橘皮苷作用方式为静态淬灭,且两者通过疏水作用结合。Zhang等[3]研究发现α-乳白蛋白和β-乳球蛋白与酚酸类物质(绿原酸、咖啡酸、阿魏酸及香豆酸)作用后,α-乳白蛋白和β-乳球蛋白的空间构象会发生改变,稳定性降低,有助于提高蛋白质的消化率。芦丁和阿魏酸与酪蛋白互作机制的研究较少,本研究采用多重光谱法和抗氧化活性测定来探讨芦丁和阿魏酸与酪蛋白的相互作用机制,有利于阐明芦丁和阿魏酸的生物利用途径,以期为富含酚类物质的功能性乳制品的研发提供理论参考。
1 材料与方法
1.1 材料与试剂
酪蛋白(纯度≥95%),上海瑞永生物技术有限公司;芦丁、阿魏酸(纯度≥98%),成都普瑞法公司;氯化钠、氯化钾、磷酸氢二钠、磷酸二氢钾(均为分析纯),1,1-二苯基-2-三硝基苯肼(DPPH)(纯度≥97%),天津市大茂化学试剂厂。
1.2 仪器与设备
Infinite M200pro型酶标仪,奥地利TECAN公司;UV- 1800型紫外分光光度计,日本岛津公司;Cary Eclipse型分子荧光分光光度计,美国Varian公司;VERTEX33型傅里叶变换红外光谱仪,德国Bruker公司;ST85B3- 1型真空冷冻干燥机,美国Milirock公司;JascoJ- 815型圆二色光谱仪,日本分光公司。
1.3 实验方法
1.3.1溶液配制
用10 mmol/L磷酸盐缓冲液 (PBS,pH值7.4)将酪蛋白配制成1.5×10-4、6×10-5mol/L的储备液,于4 ℃储存;用无水甲醇将芦丁和阿魏酸分别配制成1.2×10-3mol/L的储备液,于-20 ℃冰箱中避光贮存,使用时进行稀释。
1.3.2荧光光谱测定
取1 mL酪蛋白溶液于10 mL的比色管中,加入不同体积的芦丁和阿魏酸储备液,定容至10 mL,使得体系中酪蛋白的终浓度为6×10-6mol/L,芦丁和阿魏酸的终浓度为0、1.2×10-5、2.4×10-5、3.6×10-5、4.8×10-5、6.0×10-5mol/L。漩涡混匀,分别在303 K和314 K温度下反应1 h。在激发波长为280 nm、扫描波长为300~400 nm条件下,进行荧光检测。室温条件下,固定Δλ=15 nm和60 nm进行样品的同步荧光扫描。
荧光淬灭是一种降低荧光分子量子产率的方法,主要分为静态淬灭、动态淬灭及静态和动态淬灭两者共存三种类型[4]。淬灭类型可通过Stern-Volmer来判断[5],见式(1):
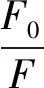
(1)
式(1)中,F、F0为有、无淬灭剂时,酪蛋白的荧光强度;Ksv为Stern-Volmer淬灭常数,L·mol-1;[Q]、Cq为淬灭剂浓度,μmol/L;Kq为双分子淬灭常数,L·(mol·s)-1;τ0为无淬灭剂时生物分子的寿命,一般约为10-8s。
对于静态淬灭,结合常数Ks和结合位点n可以通过双倒数Stern-Volmer方程计算[6],见式(2):
(2)
1.3.3紫外-可见光谱测定
用10 mmol/L PBS (pH值7.4)将1.5×10-4mol/L酪蛋白储备液稀释成1.5×10-5mol/L的蛋白质溶液,取1 mL蛋白质溶液于10 mL的比色管中,再加入不同体积的芦丁和阿魏酸溶液,定容至10 mL,使体系中酪蛋白终浓度为1.5×10-6mol/L,芦丁和阿魏酸终浓度为0、6×10-6、1.2×10-5、1.8×10-5、2.4×10-5、3.0×10-5mol/L,漩涡震荡,室温静置反应1 h。于250~450 nm处测定溶液的紫外吸收光谱。
1.3.4红外光谱测定
将冻干后的酪蛋白、芦丁- 酪蛋白及阿魏酸- 酪蛋白复合物分别与KBr混合后,在4 000~400 cm-1范围内进行红外光谱的测定。
1.3.5圆二色谱测定
分别移取300 μL的酪蛋白、芦丁- 酪蛋白及阿魏酸- 酪蛋白溶液于光程为1 mm的比色皿中,在波长为190~260 nm,持续通氮气的条件下,进行样品的圆二图谱扫描。
1.3.6抗氧化活性测定
参考齐国雨等[7]方法 。
1.4 数据处理
采用Origin 8.0、CDNN和Prodata软件处理数据,SPSS V20.0软件进行单因素差异性及相关性分析。
2 结果与分析
2.1 荧光光谱分析
2.1.1内源荧光淬灭分析
蛋白质能产生内源荧光的原因主要是蛋白质中的色氨酸、酪氨酸及苯丙氨酸所含有的共轭双键或苯环结构可在特定的激发波长下产生荧光[8]。图1反映了芦丁和阿魏酸对酪蛋白内源荧光淬灭的影响,在激发波长为280 nm条件下,酪蛋白的最大发射波长为338 nm,芦丁和阿魏酸溶液均不产生荧光,因此本研究中不考虑“内滤光效应”的干扰。

图1 芦丁、阿魏酸对酪蛋白内源荧光淬灭的影响Fig.1 Effects of rutin and ferulic acid on intrinsic fluorescence quenching of casein
由图1可知,加入芦丁和阿魏酸会使酪蛋白的内源荧光发生淬灭现象。随着芦丁和阿魏酸浓度的增加,酪蛋白的荧光强度不断被淬灭,且酪蛋白位于338 nm的最大荧光发射波长发生了明显的移位现象。添加不同浓度的芦丁使酪蛋白的最大荧光发射波长发生了蓝移现象,由338 nm处蓝移至332 nm处,说明酪蛋白中色氨酸残基附近结合腔的极性降低,表面疏水性增强,亲水性降低,蛋白质分子聚集。而添加不同浓度的阿魏酸使酪蛋白的最大荧光发射波长发生了红移现象,由338 nm红移至348 nm处,表明酪蛋白中酪氨酸和色氨酸残基附近的微环境发生了变化,疏水性降低,亲水性增加,肽链结构伸展,而这些均与酪蛋白的空间构象变化密切相关[9]。由激发波长280 nm的数据可知,芦丁和阿魏酸对酪蛋白内源荧光的淬灭率分别为83.25%和67.73%,同浓度的芦丁和阿魏酸对酪蛋白的淬灭速率不同,这可能与反应的进程有关,芦丁与酪蛋白的反应程度明显高于阿魏酸和酪蛋白的反应程度[10]。
2.1.2荧光淬灭机制分析
图2为温度303 K和314 K时,芦丁和阿魏酸与酪蛋白相互作用的Stern-Volmer曲线。根据Stern-Volmer方程的斜率计算对应温度下的Ksv和Kq,结果如表1。对于动态淬灭,随着温度升高,淬灭常数也随之增大,即Stern-Volmer曲线方程的斜率增大,静态淬灭则与之相反[11]。由图2和表1可知,芦丁和阿魏酸淬灭酪蛋白的曲线斜率随温度的升高而下降,且芦丁和阿魏酸淬灭酪蛋白的Kq均大于最大动态淬灭常数,表明芦丁和阿魏酸淬灭酪蛋白的方式为静态淬灭,且芦丁、阿魏酸与酪蛋白形成了新的复合物[12]。根据Stern-Volmer方程获得的静态淬灭常数在一定程度上可用来表征静态淬灭的相对强弱,由表1可知芦丁对酪蛋白的淬灭作用大于阿魏酸,导致该结果的原因可能与它们的结构不同有关,需要进一步探讨。

图2 芦丁、阿魏酸淬灭酪蛋白的Stern-Volmer曲线Fig.2 Stern-Volmer curves of casein quenching by rutin and ferulic acid

表1 芦丁、阿魏酸与酪蛋白的Stern-Volmer曲线的相关参数
结合常数Ks为通过lg(F0-F)/F对lgQ作图得到的截距(如图3),计算结果如表2。
由表2可知,芦丁及阿魏酸与酪蛋白在303 K和314 K下的结合位点约为1,表明在实验浓度范围内芦丁和阿魏酸与酪蛋白至少有一个单独的结合位点,可能形成了1∶1的复合物。且芦丁和阿魏酸与酪蛋白的结合常数的数量级均大于等于104,说明芦丁和阿魏酸对酪蛋白有较强的结合能力,有助于芦丁和阿魏酸等酚酸类物质对酪蛋白的靶向性及定位,降低酪蛋白的结合位点数,会减少其附着于胃肠黏膜的概率,同时也能提高酚酸类物质的寿命,使其不易被氧化,有助于将其运送至机体内后释放,提高酚酸类物质的生物利用度[13]。

图3 芦丁、阿魏酸淬灭酪蛋白的双对数曲线Fig.3 Double logarithmic curves of casein quenching by rutin and ferulic acid

表2 芦丁、阿魏酸与酪蛋白的双对数曲线的相关参数
2.1.3热力学参数和作用力分析
生物大分子与小分子配体间相互作用的驱动力,可以根据热力学参数熵变值ΔS和焓变值ΔH来进行表征[14]:(1)若ΔS>0且ΔH>0,则为疏水作用;(2)若ΔS>0且ΔH<0,则为氢键和疏水作用;(3)若ΔS<0且ΔH>0,则为静电引力;(4)若ΔS<0且ΔH<0,则为氢键和范德华力。芦丁和阿魏酸与酪蛋白反应的ΔG<0,表明芦丁和阿魏酸与酪蛋白的反应是自发进行的,见表3。芦丁与酪蛋白反应的ΔH>0,而阿魏酸与酪蛋白反应的ΔH<0,说明酪蛋白与芦丁的结合为吸热反应,而与阿魏酸的结合为放热反应;升温有利于酪蛋白与芦丁反应的进行,却不利于酪蛋白与阿魏酸反应的进行;这和酪蛋白与芦丁作用的Ksv随温度升高而增大及与阿魏酸作用的Ksv随温度升高而减小是一致的。由芦丁与酪蛋白反应的ΔH>0和ΔS>0可知,芦丁与酪蛋白间的作用力为疏水作用;阿魏酸与酪蛋白反应的ΔH<0和ΔS>0,表明阿魏酸与酪蛋白间的作用力为氢键和疏水作用。而ΔS>0是因为芦丁和阿魏酸与酪蛋白在溶剂中反应时,它们的亲水性部分极易被溶剂中的水分子包围,形成水合状态,进一步反应时,其表面的非极性基团将处于非极性区域的水分子排开,进而使被排开的水分子与羟基等亲水性基团的水合作用增强,最终导致体系的运动状态由有序性逐渐趋于相对无序性[15]。
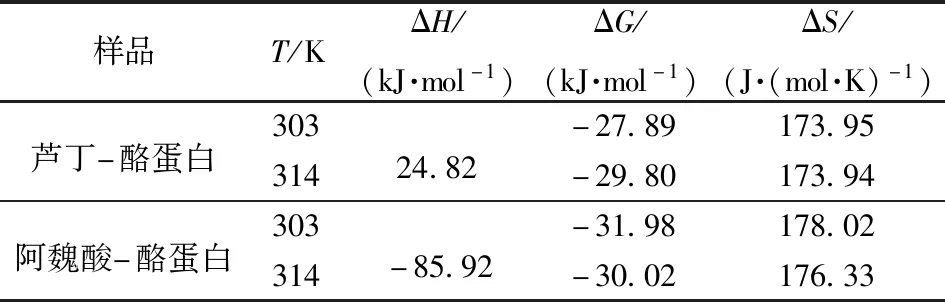
表3 芦丁、阿魏酸与酪蛋白相互作用的热力学参数
2.2 紫外- 可见光谱分析
酪蛋白在278 nm处具有最大吸收峰(如图4),这可能是由于酪蛋白分子中的芳香族氨基酸所含有的共轭双键具有吸收峰。添加芦丁和阿魏酸会使酪蛋白最大吸收峰的峰高和峰位置发生明显的变化,这说明芦丁和阿魏酸与酪蛋白发生了相互作用。随着芦丁和阿魏酸浓度的增加,酪蛋白最大吸收峰的峰值有规律的增加。芦丁的加入使酪蛋白的最大吸收峰所处的波长由278 nm蓝移至276.2 nm,表明芦丁与酪蛋白结合后诱导肽链伸展,使酪蛋白分子内部色氨酸和酪氨酸残基中的芳香杂环疏水性基团暴露出来,进而改变酪蛋白的构象,有利于酪蛋白中色氨酸和酪氨酸残基中芳香杂环的π-π*跃迁[16];而阿魏酸的加入则使酪蛋白的最大吸收峰所处的波长由278 nm红移至283 nm,表明阿魏酸的加入可能会使酪蛋白中芳香族氨基酸残基所处的微环境发生改变,最终引起酪蛋白的构象改变[17]。此外,紫外吸收光谱法也可用来判断小分子物质与蛋白质作用的淬灭类型:对于静态淬灭,小分子物质会使蛋白质的紫外吸收光谱发生红移或蓝移现象;而动态淬灭,则通常不会造成红移或蓝移现象[18]。因此,芦丁和阿魏酸与酪蛋白作用的紫外吸收光谱再次证明了它们之间相互作用的淬灭机制为静态淬灭。

图4 芦丁、阿魏酸对酪蛋白紫外- 可见吸收光谱的影响Fig.4 Effects of rutin and ferulic acid on UV-absorption spectrum of casein
2.3 同步荧光分析
同步荧光光谱法可以通过展现小分子物质对蛋白质微环境的影响,反映小分子物质与蛋白质相互作用对蛋白质构象的改变。Δλ=15 nm反映了发色基团酪氨酸的荧光信息,Δλ=60 nm反映了发色基团色氨酸的荧光信息[19]。图5(a)和(b)分别为加入芦丁和阿魏酸后,酪蛋白中酪氨酸的光谱信息,反映了其酪氨酸残基附近的微环境变化情况;(c)和(d)为加入芦丁和阿魏酸后,酪蛋白中色氨酸的光谱信息,反映了酪蛋白中色氨酸残基附近的微环境变化情况。由图5可知,随着芦丁和阿魏酸浓度的增加,酪蛋白中色氨酸和酪氨酸的荧光强度有规律的下降,表明芦丁和阿魏酸与酪蛋白的结合对酪蛋白中色氨酸和酪氨酸这两个发色基团均产生了影响。芦丁与酪蛋白结合后,色氨酸和酪氨酸的荧光强度分别下降了77.31%和85.34%,而阿魏酸与酪蛋白结合后,则色氨酸和酪氨酸的荧光强度分别下降了85.05%和69.64%,表明芦丁对酪蛋白中酪氨酸残基附近的微环境变化的影响大,而阿魏酸对酪蛋白中色氨酸残基附近的微环境变化的影响大,这可能是阿魏酸和芦丁的分子结构不同造成的。
2.4 红外光谱分析

图5 芦丁、阿魏酸与酪蛋白相互作用的同步荧光光谱Fig.5 Synchronous fluorescence spectra of casein interacted with rutin and ferulic acid
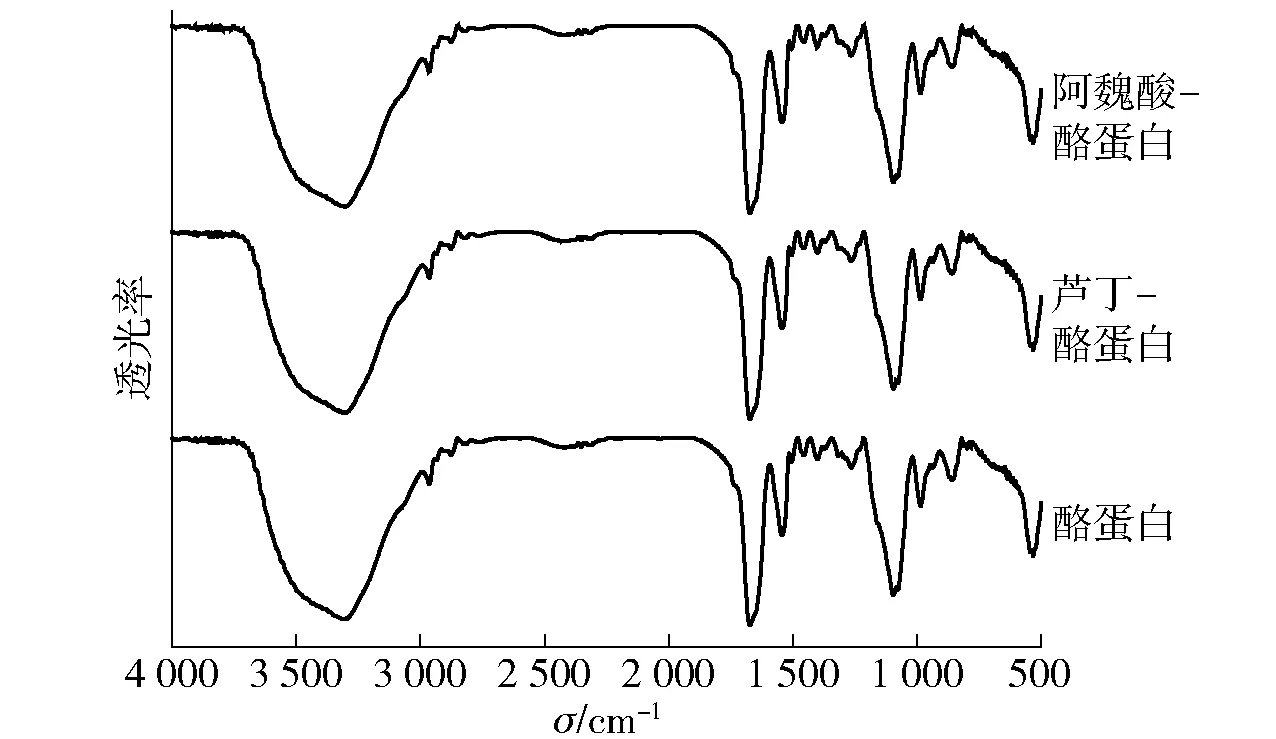
图6 芦丁、阿魏酸与酪蛋白相互作用的红外光谱Fig.6 Fourier transform infrared spectra of casein interacted with rutin and ferulic acid
红外吸收光谱可进一步研究蛋白质构象的变化,吸收光谱中的酰胺Ⅰ带及酰胺Ⅱ带和多肽链、碳骨架中的C-N伸缩振动的峰移位,可以证明多酚类物质与蛋白质发生了相互作用[20]。图6为芦丁和阿魏酸与酪蛋白相互作用的傅里叶红外光谱。由图6可知,加入芦丁和阿魏酸后,酪蛋白红外光谱中的酰胺Ⅰ带由1 673.19 cm-1分别蓝移至1 658.46 cm-1和1 661.97 cm-1,酰胺Ⅱ带略有红移现象,表明芦丁和阿魏酸引起了酪蛋白的二级结构改变。芦丁上的某些氧原子和羟基基团与酪蛋白的羰基及碳氮基团通过疏水作用结合形成稳定复合物;而阿魏酸则通过氢键和疏水作用与酪蛋白形成稳定复合物,引起酪蛋白肽链重排,并最终导致其二级结构发生变化[21]。这也可以通过吸收谱中酰胺A带(3 300~3 400 cm-1)的改变来辅证。加入芦丁和阿魏酸后,酪蛋白的酰胺A带由3 304.41 cm-1分别红移至3 313.97 cm-1、3 314.43 cm-1。He等[22]发现β-乳球蛋白与锦葵素-3-O-葡萄糖苷相互作用后,其红外光谱中的酰胺Ⅰ带发生红移,酰胺Ⅱ带略有蓝移。而刘勤勤等[23]研究茶多酚与大豆蛋白作用,发现大豆蛋白的酰胺Ⅰ带和Ⅱ带均发生蓝移现象。上述研究结果均与本研究结果不一致,这可能是由于酚酸与蛋白质的结构及种类不同造成的。
2.5 圆二色谱分析
通过Prodata和CDNN软件处理圆二图谱并计算酪蛋白的二级结构变化,结果如表4。 由表4可知,加入芦丁和阿魏酸后,酪蛋白中的α-螺旋含量由12.9%分别上升至16.7%和16.0%,β-转角含量由32.7%分别减少至26.5%和26.0%,无规卷曲、平行和反平行的含量均略有变化,这说明芦丁和阿魏酸与酪蛋白发生了相互作用,且在其相互作用的过程中芦丁和阿魏酸能够稳定酪蛋白的螺旋结构,同时可使酪蛋白变得略微疏松(即无规卷曲由33.5%分别上升至35.5%和36.5%)。Kanakis等[24]研究儿茶素与β-乳球蛋白相互作用,结果表明加入儿茶素后,β-乳球蛋白中的α-螺旋、平行及反平行折叠含量增加,无规卷曲含量降低,β-乳球蛋白结构更加稳定,这与本研究结果是一致的。

表4 酪蛋白与芦丁、阿魏酸复合物二级结构组成
2.6 抗氧化活性分析
酪蛋白、芦丁、芦丁- 酪蛋白、阿魏酸和阿魏酸- 酪蛋白的DPPH自由基清除率分别为19.29%、56.49%、57.17%、42.26%和44.67%,见图7。图7可以看出,芦丁、阿魏酸与酪蛋白结合后,其自由基清除率均略微增加(P>0.05),但是小于酪蛋白分别与芦丁及阿魏酸的理论值之和,这可能与芦丁和阿魏酸结构中的酚羟基能够与酪蛋白形成氢键有关。芦丁和阿魏酸中的酚羟基是使芦丁和阿魏酸具有抗氧化作用的重要基团,其中,芦丁的抗氧化作用主要源自其A环上的5-OH和7-OH及B环上的3′-OH和4′-OH;而阿魏酸的抗氧化作用则源自其苯环上的4-OH[25]。因此,芦丁和阿魏酸中的酚羟基因形成氢键,导致酚羟基基团被屏蔽,从而引起芦丁和阿魏酸对自由基清除率的下降。

不同小写字母表示差异显著(P图7 酪蛋白对芦丁和阿魏酸抗氧化活性的影响Fig.7 Effects of casein on antioxidant activity of rutin and ferulic acid
3 结 论
芦丁和阿魏酸对酪蛋白的淬灭机制均为静态淬灭,芦丁与酪蛋白间通过疏水作用形成复合物,而阿魏酸与酪蛋白间则通过疏水作用和氢键形成复合物。紫外和同步荧光光谱表明芦丁与酪蛋白的结合位点更接近于酪氨酸,而阿魏酸与酪蛋白的结合位点则更接近于色氨酸。傅里叶红外光谱和圆二色谱表明芦丁和阿魏酸的加入会改变酪蛋白二级结构。抗氧化活性结果表明芦丁和阿魏酸与酪蛋白间存在抗氧化活性屏蔽现象。此结果对于推测乳制品中酚酸类物质在食品加工、贮存及消化吸收过程中通过与酪蛋白作用来保护抗氧化基团的机理具有一定的指导意义。
