盐酸右美托咪定对颅内动脉瘤介入手术患者血流动力学及术后并发症的影响
2020-04-20史记张娜娜赵帅
史记 张娜娜 赵帅

[摘要] 目的 探討颅内动脉瘤介入治疗过程中使用盐酸右美托咪定对患者血流动力学的影响及其颅内压(ICP)改变引起术后神经系统不良反应发生率的情况。 方法 选取2017年1月~2018年12月河北医科大学第一医院神经科确诊且择期行介入治疗的颅内动脉瘤患者96例为研究对象,依据选用的药物与使用剂量的不同将其分为盐水组(A组)、低剂量盐酸右美托咪定组(B1组)、高剂量盐酸右美托咪定组(B2组),每组32例。B1、B2组在手术结束前30 min开始泵入0.6、1.2 μg/kg的盐酸右美托咪定,持续时间为20 min,A组泵入生理盐水。记录并比较三组患者术前(T0)、给药时刻(T1)、手术结束时刻(T2)、苏醒时刻(T3)、拔管时刻(T4)及拔管后(T5)ICP、平均动脉压(MAP)、心率(HR)及术后恢复相关指标(苏醒所需时间、术后拔管时间与Ramsay镇静评分),比较术后神经系统不良反应发生情况。 结果 B1组T2~T4时点ICP低于A组,T2~T5时点MAP、HR低于A组,差异均有统计学意义(均P < 0.05),B2组T2~T4时点ICP低于A、B1组,T2~T5时点MAP低于A、B1组,T1~T5时点HR低于A、B1组,差异均有统计学意义(均P < 0.05)。与A组比较,B1组苏醒所需时间、术后拔管时间差异无统计学意义(P > 0.05);B1组Ramsay镇静评分高于A组,差异有统计学意义(P < 0.05)。B2组苏醒所需时间、术后拔管时间长于A、B1组;Ramsay镇静评分高于A、B1组,差异有统计学意义(P < 0.05)。三组术后神经系统不良反应发生率比较,差异有统计学意义(P < 0.05)。B1、B2组神经系统不良反应发生率明显低于A组,差异均有统计学意义(均P < 0.05);B1组与B2组神经系统不良反应发生率比较,差异无统计学意义(P > 0.05)。 结论 手术结束前给予小剂量盐酸右美托咪定可以有效稳定患者血流动力学,改善脑组织灌注,降低ICP,减少术后神经系统不良反应发生。早期干预应用盐酸右美托咪定对颅内动脉瘤介入手术患者有一定的获益性应用价值。
[关键词] 颅内动脉瘤;保护;血流动力学;镇静;右美托咪定
[中图分类号] R614.2 [文献标识码] A [文章编号] 1673-7210(2020)03(a)-0115-05
[Abstract] Objective To investigate the effect of Dexmedetomidine Hydrochloride on hemodynamics and postoperative neurological adverse reactions caused by intracranial pressure (ICP) change during interventional therapy of intracranial aneurysm. Methods From January 2017 to December 2018, 96 cases diagnosed as intracranial aneurysm and receiving elective interventional treatment in the First Hospital of Hebei Medical University were selected as subjects. They were divided into saline group (group A), low-dose Dexmedetomidine Hydrochloride group (group B1), and high-dose Dexmedetomidine Hydrochloride group (group B2) according to the drugs selected and the dose used, with 32 cases in each group. At the time of 30 minutes before ending surgery , Dexmedetomidine Hydrochloride was injected into B1 and B2 groups at 0.6 μg/kg and 1.2 μg/kg and continued for about 20 minutes, while group A was pumped in saline. ICP, mean arterial pressure (MAP) and heart rate (HR) of the three groups were recorded at the time of the preoperative (T0), administration (T1), ending surgery (T2), recovery (T3), extubation (T4) and post-extubation (T5). Postoperative recovery indicators (recovery time, postoperative extubation time and Ramsay sedation score) and incidence of neurological adverse reactions of three groups were compared. Results ICP of group B1 was lower than that of group A at T2-T4, MAP and HR of group B1 were lower than those of group A at T2-T5, and the differences were statistically significant (all P < 0.05). At T2-T4, ICP of group B2 were lower than those of group A and B1, MAP of group B2 were lower than those of group A and B1 at T2-T5, HR of group B2 was lower than that of group A and B1 at T1-T5, and the differences were statistically significant (all P < 0.05). Compared with group A, group B1 showed no statistically significant difference in the recovery time and postoperative extubation time (P > 0.05). Ramsay sedation score in group B1 was higher than that in group A, with statistically significant difference (P < 0.05). The recovery time and postoperative extubation time of group B2 were longer than those of group A and group B1, Ramsay sedation score of group B2 was higher than that of group A and group B1, and the differences were statistically significant (P < 0.05). The incidence of postoperative adverse reactions in the nervous system of three groups were significantly differences (P < 0.05). The incidence of adverse nervous system reactions in group B1 and B2 were significantly lower than those in group A, with statistically significant differences (all P < 0.05). There was no significant difference in the incidence of neurological adverse reactions between group B1 and group B2 (P > 0.05). Conclusion Small doses of Dexmedetomidine Hydrochloride before ending surgery can effectively stabilize the hemodynamics of patients, improve cerebral perfusion, reduce intracranial pressure and the incidence of postoperative neurological adverse reactions. Early intervention with Dexmedetomidine Hydrochloride produces beneficial application value in patients with intracranial aneurysm undergoing interventional surgery.
[Key words] Intracranial aneurysm; Protection; Hemodynamics; Sedation; Dexmedetomidine
颅内动脉瘤是临床颅脑血管疾病中的常见病,也是引发原发性蛛网膜下腔出血与颅内出血的高危因素之一,可导致患者失语、偏瘫、昏迷,严重者甚或死亡[1]。在临床颅内动脉瘤的治疗中,手术介入治疗已广泛运用,但其对患者整个治疗过程中稳定血流动力学的要求较高[2]。患者术后苏醒期的躁动,可引起颅内压与脑氧耗量增加、血压上升,进而影响颅内压(ICP)的改变。有研究显示[3-4],脑室内或蛛网膜下腔ICP增高[15~20 mmHg(1 mmHg=0.133 kPa)]与不良预后如重度残疾、植物状态和死亡显著相关(P < 0.001)。因此,减轻颅内动脉瘤患者术后苏醒期不良应激反应,降低神经系统不良反应发生率,减少相关并发症的发生,成为临床麻醉医生所面对的一大棘手问题。右美托咪定属于α2肾上腺激素能高选择性受体激动剂,不仅能使交感神经系统的活性受到抑制,减少机体应激反应的发生;还能缓解患者在手术过程中并发的心血管反应。右美托咪定早期多用于机械通气患者镇痛镇静,现在麻醉及危重医学等领域中应用的范围已扩大,且其临床效果得到了肯定[5-6]。本研究显示对手术结束前给予小剂量盐酸右美托咪定可以有效稳定患者血流动力学,改善脑组织灌注,降低颅内压,减少术后神经系统不良反应发生率。现报道如下:
1 资料与方法
1.1 一般资料
选取2017年1月至2018年12月河北医科大学第一医院(以下简称“我院”)神经科确诊且择期行介入治疗的颅内动脉瘤患者96例为研究对象,依据选用的药物及使用剂量的不同将其分为生理盐水组(A组)、低剂量盐酸右美托咪定组(B1组)、高剂量盐酸右美托咪定组(B2组),每组32例。A组,男18例,女14例;年龄42~63岁,平均(54.57±12.38)岁;体重指数(BMI)18~25 kg/m2,平均(21.08±3.46)kg/m2。B1组,男17例,女15例;年龄41~61岁,平均(53.98±12.06)岁;BMI 17~25 kg/m2,平均(21.47±3.35)kg/m2。B2组,男19例,女13例;年龄42~64岁,平均(54.82±12.53)岁;BMI 18~24 kg/m2,平均(21.56±3.47)kg/m2。三组一般资料比较,差异无统计学意义(P > 0.05),具有可比性。本研究经我院医学伦理委员会批准。
纳入标准:①入院后行相关检查已确诊为颅内动脉瘤且择期行介入治疗者;②美国麻醉医师协会(ASA)分级Ⅰ~Ⅲ级者;③意识清楚,与家属协商后签署此研究的知情同意书。排除标准:①对本研究所用麻醉药物过敏者;②有心肺、肝肾及代谢性等严重疾患者;③意识障碍或患有精神疾患,不能配合医护人员工作者;④长期服用镇静镇痛类药物者。
1.2方法
患者于术前常规禁饮食,术前准备建立静脉通道,进行心电监护,行右侧桡动脉穿刺置管用于監测平均动脉压(MAP)。麻醉诱导:经静脉缓慢顺序注射盐酸咪达唑仑(江苏恩华药业,生产批号:2016614)0.05 mg/kg,舒芬太尼(宜昌人福药业,生产批号:1160514)0.5 μg/kg,依托咪酯(江苏恩华药业,生产批号:ADP1608260)0.3 mg/kg,顺式阿曲库铵(江苏恒瑞医药,生产批号:6062721)0.15 mg/kg。待麻醉深度平稳可靠后,行气管插管,连接呼吸机,患者呼吸频率维持12次/min左右、潮气量6~8 mL/kg。麻醉维持:瑞芬太尼(宜昌人福药业,生产批号:6160411)0.1~0.2 μg/(kg·min),异丙酚(广东嘉博制药,生产批号:2A170502-2)4~6 mg/(kg·h),间断加用0.05 mg/kg的顺式阿曲库铵。B1、B2组在手术结束前30 min开始分别泵入0.6、1.2 μg/kg盐酸右美托咪定(江苏恩华药业,生产批号:20160202),持续时间为20 min;A组泵入生理盐水。
1.3观察指标
1.3.1 各时间点血流动力学指标观察 记录三组患者术前(T0)、给药时刻(T1)、手术结束时刻(T2)、苏醒时刻(T3)、拔管时刻(T4)及拔管后(T5)6个时间点的血流动力学指标,包含颅内压(ICP)、MAP及心率(HR),ICP采用的是腰椎穿刺法以检测。
1.3.2 术后恢复相关指标观察 记录三组患者苏醒与拔管时间,拔管后对患者行Ramsay镇静评分。参考Ramsay镇静评分标准[7]:1分表示躁动不安,2分表示清醒但配合,3分表示嗜睡但对指令有反应,4分表示浅睡眠状态,5分表示入睡,6分表示深睡。分值越高,效果越理想。
1.3.3术后神经系统不良反应观察 不良反应包括恶心呕吐、视乳头水肿、意识障碍、库欣反应的发生情况。
1.4统计学方法
采用SPSS 18.0统计学软件进行数据分析,符合正态分布计量资料用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,两组间比较采用t检验;不符合正态分布的改用中位数(M),四分位数(P25,P75)表示,采用Kruskal-Wallis H检验;计数资料用率表示,组间比较采用χ2检验;三组各时间点血流动力学变化情况使用两因素重复测量方差分析进行比较。以P < 0.05为差异有统计学意义。
2 结果
2.1 三组各时间点血流动力学指标比较
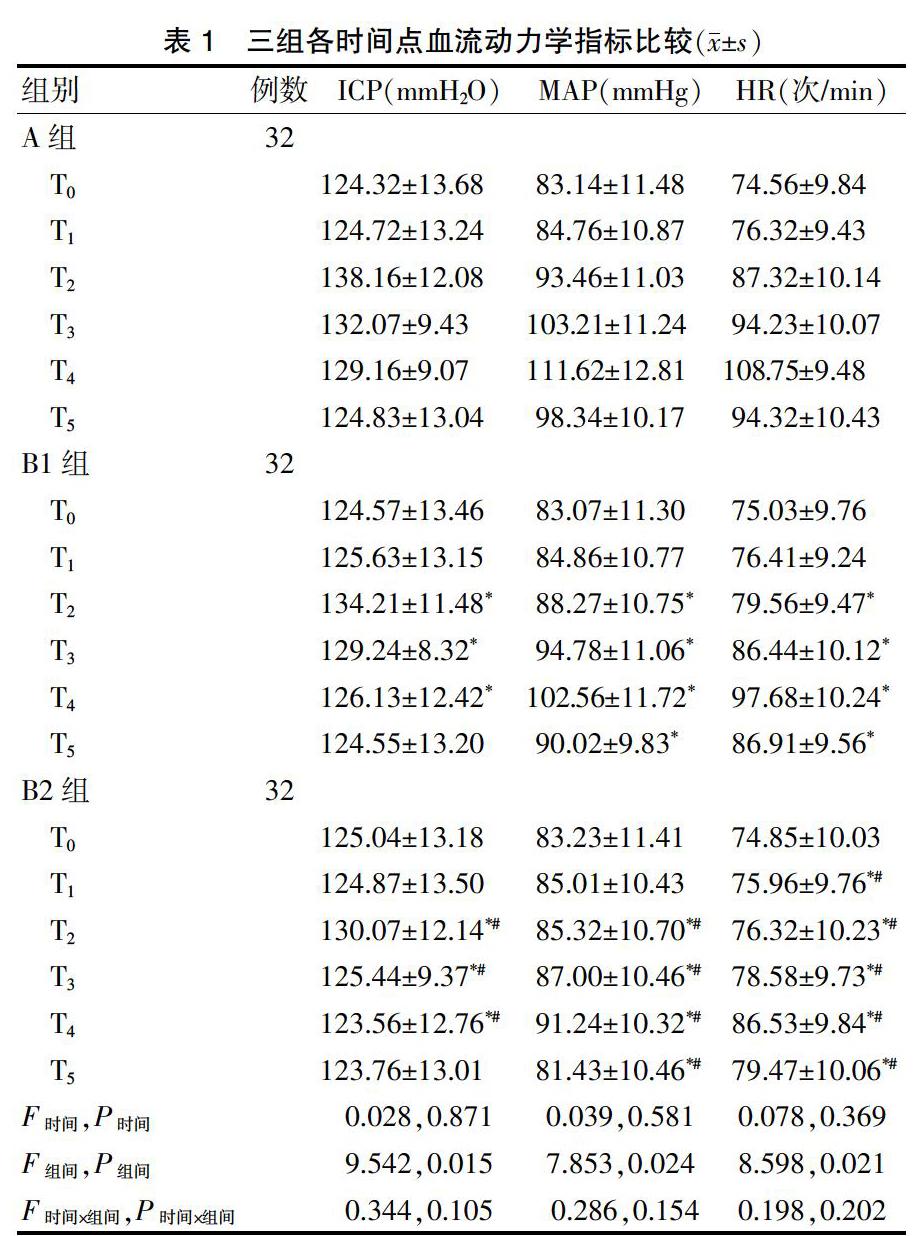
通过对学生化残差的分析,经Shapiro-Wilk检验,各组数据服从正态分布(P > 0.05);通过学生化残差是否超过±3倍标准差判断,各组数据无异常值。经Mauchly′s球形假设检验,对于交互项分组×时间,因变量的方差协方差矩阵相等(P > 0.05),故3个指标数值均符合球对称。
各时间点组间患者ICP、MAP、HR差异有统计学意义(P < 0.05)。B1组T2~T4时点ICP低于A组,T2~T5时点MAP、HR低于A组,差异均有统计学意义(均P < 0.05),B2组T2~T4时点ICP低于A、B1组,T2~T5时点MAP低于A、B1组,T1~T5时点HR低于A、B1组,差异均有统计学意义(均P < 0.05)。见表1。
2.2 三组术后与恢复相关指标的比较
与A组比较,B1组苏醒所需时间、术后拔管时间差异无统计学意义(P > 0.05);B1组Ramsay镇静评分高于A组,差异有统计学意义(P < 0.05)。B2组苏醒所需时间、术后拔管时间长于A、B1组;Ramsay镇静评分高于A、B1组,差异有统计学意义(P < 0.05)。见表2。
2.3 三组术后神经系统不良反应发生情况比较
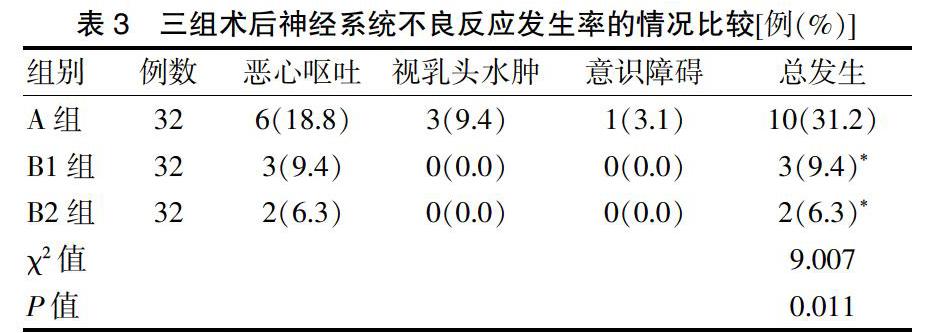
三組术后神经系统不良反应总发生率比较,差异有统计学意义(P < 0.05)。B1、B2组神经系统不良反应发生率明显低于A组,差异均有统计学意义(均P < 0.05);B1组与B2组神经系统不良反应发生率比较,差异无统计学意义(P > 0.05)。见表3。
3 讨论
近年来,颅内动脉瘤发病呈逐渐增加趋势,蛛网膜下腔出血成为最为主要的破裂因素,约为85%[8-9]。颅内动脉瘤发生破裂后致残率与致死率分别为33%、40%[10-11]。因此,对临床颅内动脉瘤患者的治疗过程需更加的谨慎,尽可能降低其致残与致死率,改善患者预后。ICP增高常见于颅脑外伤、颅内感染、脑血管病和脑瘤等脑部疾病。而难治性颅内压增高(ICP>20 mmHg),标准治疗不奏效的比例约为20%[12],病死率高达80%~100%[13]。因此,准确监测ICP变化,早期、合理麻醉用药干预并改善ICP,是降低病死率,改善神经功能预后的关键因素之一。
血管内介入治疗具有术后恢复快、住院周期较短、效果确切等优势,较易被患者接受[14-18]。血管内介入治疗被证明是一种安全有效的颅内动脉瘤治疗方法,但其潜在的并发症不容忽视,缺血性并发症(IC)是血管内介入治疗围术期最常见的并发症之一[19-21]。围术期内一旦发生IC,可能会造成永久性残疾或致死[22]。稳定患者脑血流动力学能够对患者脑组织有效保护。
颅内动脉瘤患者在手术麻醉过程中,机体肾上腺素能受体被激活,交感神经兴奋性增强,导致患者ICP、MAP及HR等相关指标明显升高,进而引发患者脑血流动力学的变化[23]。颅内动脉瘤介入手术苏醒期需密切监测患者血流动力学变化,患者出现疼痛刺激、苏醒躁动等不良应激反应,均可能引起脑组织灌注的剧烈波动。患者出现抵抗行为时易使引流管和/或气管导管脱落,威胁生命安全[24]。拔出气管导管时,部分患者会发生剧烈的呛咳,极易引起血压与ICP升高,使得动脉瘤再次破裂的风险明显上升[25]。因此,维持患者苏醒期尤其是拔管时血流动力学稳定,早期干预改善ICP增高界值,可避免难治性颅高压发生,降低颅高压并发症的发生率。
右美托咪定为高特异性新型α2肾上腺素能受体激动剂,具有抗交感神经兴奋,稳定心脑血管的血流灌注,镇静镇痛,不会对呼吸过程产生抑制等作用。在颅内动脉瘤麻醉过程中使用该药,不仅能使患者心脑血管的压力明显降低,还能改善脑部血氧供给,且术后还具有镇静镇痛的功效[26]。本研究结果显示,B1组T2~T4时点ICP低于A组,T2~T5时点MAP、HR低于A组(均P < 0.05),B2组T2~T4时点ICP低于A、B1组,T2~T5时点MAP低于A、B1组,T1~T5时点HR低于A、B1组(均P < 0.05)。提示手术结束前应用右美托咪定具有维护苏醒期血流动力学稳定,降低ICP,减少神经系统不良反应发生率,防控ICP增高相关并发症,发挥改善神经功能预后的作用。A组与B1组苏醒所需时间、术后拔管时间比较差异无统计学意义(P > 0.05),而B2组苏醒所需时间、术后拔管时间长于A、B1组(P < 0.05),提示小剂量右美托咪定更有助于患者后期的恢复。
综上所述,手术结束前给予小剂量盐酸右美托咪定可以有效稳定患者血流动力学,改善脑组织灌注,降低ICP,减少术后神经系统不良反应发生率。早期干预应用盐酸右美托咪定对颅内动脉瘤介入手术患者有一定的获益性应用价值。
[参考文献]
[1] 郑津,胡学斌,赵洪洋,等.血管介入栓塞治疗时机对颅内动脉瘤患者并发症及神经功能的影响[J].中国医药,2018,13(2):219-223.
[2] Liu H,Park D,Hwang SM,et al. Outpatient Day-care Neuroangiography and Neurointervention of Unruptured Intracranial Aneurysms [J]. Neurointervention,2016,11(1):37-41.
[3] Miller JD,Butter worth JF,Gudeman SK,et al. Further experience in the management of severe head in jury [J]. J Neurosurg,1981,54(3):289-299.
[4] Marshall LF,Smith RW,Shapiro HM. The outcome with aggressive treatment in severe head injuries [J]. J Neurosurg,1979,50(1):20-25.
[5] 焦莉,孔静,张红莉,等.盐酸右美托咪定和咪达唑仑在ICU患者机械通气中的镇静效果分析[J].保健医学研究与实践,2018,15(6):47-50.
[6] 史记,刘雅,周长浩,等.盐酸右美托咪定对颅内动脉瘤介入手术患者术中及苏醒期血流动力学的影响[J].河北医药,2017,39(24):3719-3722.
[7] 曾敏,邢燕,金旭,等.右美托咪啶在颅内动脉瘤血管内栓塞术中的应用价值[J].中国医药导报,2013,10(33):107-110.
[8] 李星海,赵卫,杨净松,等.脑动静脉畸形伴发动脉瘤的出血风险因素分析及介入治疗[J].中国介入影像与治疗学,2018,15(4):204-208.
[9] 宋志强,朱安林,陈锐锋,等.颅内动脉瘤急症介入术后神经系统并发症相关因素探讨[J].介入放射学杂志,2019, 28(5):411-414.
[10] 钟周军,胡秋根,杨少民,等.双源CT大螺距前瞻扫描在胸痛三联症成像中的应用价值[J].中国中西医结合影像学杂志,2017,15(3):313-315.
[11] 李力,张小曦,赵瑞,等.颅内未破裂动脉瘤介入治疗程序相关性术中破裂的危险因素及临床特点分析[J].第二军医大学学报,2017,38(12):1491-1496.
[12] Carney N,Totten AM,O′Reilly C,et al. Guidelines for the Management of Severe Traumatic Brain Injury,Fourth Edition [J]. Neurosurgery,2017,80(1):6-15.
[13] Godoy DA,Suarez PDG,Moscote-Salazar LR,et al. Side effects of indomethacin in refractory post-traumatic intracranial hypertension:a comprehensive case study and review [J]. Bull Emerg Trauma,2017,5(3):143-451.
[14] 王幸伟,韩玉慧.血管内介入栓塞术对颅内动脉瘤患者术后恢复影响[J].实用中西医结合临床,2018,18(5):48-50.
[15] 李亚捷,王磊,谷震,等.3D路径图用于颅内动脉瘤介入治疗对手术时间和X射线辐射剂量的影响研究[J].临床和实验医学杂志,2018,17(10):1104-1107.
[16] 高卉,程云章.血流导向装置与弹簧圈联合治疗巨型颅内动脉瘤的数值模拟研究现状[J].北京生物医学工程,2018,37(4):419-426.
[17] 洪德全,黄海鹰,杨华,等.介入栓塞术与开颅夹闭术治疗颅内动脉瘤的疗效对比[J].中国现代医生,2018,56(34):79-82,87.
[18] 吴毅,刘成辉,陈旭,等.血管内介入栓塞和开颅夹闭手术在颅内动脉瘤患者中的应用效果研究[J].中国医药科学,2018,8(7):213-216.
[19] Orrù E,Roccatagliata L,Cester G,et al. Complications of endovascular treatment of cerebral aneurysms [J]. Eur J Radiol,2013,82(10):1653-1658.
[20] Yonaha H,Hyodo A,Inaji T,et al. Thromboembolic events associated with coil protrusion into parent arteries after GDC treatment [J]. Interv Neuroradiol,2006,12(Suppl 1):105-111.
[21] Edwards NJ,Jones WH,Sanzgiri A,et al. Antiplatelet therapy for the prevention of peri-coiling thrombo embolism in high-risk patients with ruptured intracranial aneurysms [J]. J Neurosurg,2017,127(6):1326-1332.
[22] Adeeb N,Griessenauer CJ,Moore JM,et al. Ischemic stroke after treatment of intraprocedural thrombosis during stent-assisted coiling and flow diversion [J]. Stroke,2017,48(4):1098-1100.
[23] 姚长青,刘兵,刘志永,等.右美托咪定对颅内动脉瘤手术患者脑血流代谢及脑保护的影响[J].中华肿瘤防治杂志,2017,11(7):1-3.
[24] 王旭,陈锋,周达全,等.早期颅内动脉瘤夹闭术对颅内动脉瘤患者术后血清炎性因子水平变化及并发症发生率的影响[J].河北医学,2019,25(2):208-211.
[25] 唐海双,贺晓武,左乔,等.支架辅助弹簧圈栓塞治疗急性期颅内破裂动脉瘤的围手术期危险因素分析[J].第二军医大学学报,2019,40(2):117-124.
[26] 王贵成,管艳,盛大卫,等.不同靶控浓度右美托咪定對颅内动脉瘤患者脑氧代谢影响研究[J].现代中西医结合杂志,2017,26(11):1238-1240.
(收稿日期:2019-10-09 本文编辑:刘明玉)
