异黏蛋白及波形蛋白在食管鳞状细胞癌组织中的表达及其预后的关系*
2020-04-20付娟娟杨晨晨
付娟娟,徐 茜,杨晨晨,3△
(1.江苏省无锡市第五人民医院病理科,江苏无锡 214000;2.新疆医科大学基础医学院, 新疆乌鲁木齐 830011;3.无锡太湖学院护理学院,江苏无锡 214000)
在全球范围内食管癌的发病率和病死率分别位于恶性肿瘤的第8位和第6位[1]。由于局部浸润、淋巴结转移和远处转移,食管癌的病死率较高,且5年生存率较低,低于20%[2-4]。食道鳞状细胞癌(ESCC)起源于食道上皮细胞。据相关统计显示,世界上每年超过31万人死于食管鳞状细胞癌。最近的研究发现食管癌的生物血清标记物不稳定,可能导致某些实验结果偏差。 因此,筛选更好的肿瘤标志物成为一项监测发展的新热点。上皮-间质转化(EMT)为上皮来源的恶性肿瘤细胞提供了侵袭转移的条件[5-6]。EMT是上皮细胞失去极性,失去与基底膜的连接,并转化为间充质表型的生物学过程。EMT的特征通常是抑制细胞黏附受体E-钙黏蛋白(E-cadherin)和细胞凋亡,促使细胞迁移和侵袭[7],其在肿瘤转移和胚胎发育中起关键作用,在转移过程中,EMT可破坏细胞间的紧密连接,并促进迁移,获得自我更新和干细胞样特性。异黏蛋白(MTDH)也称为星形胶质细胞升高基因-1(AEG-1)和富含赖氨酸的CEACAM-1相关蛋白(Lyric),最初被鉴定为癌基因,其可通过人类免疫缺陷病毒1型(HIV-1)或用HIV包膜糖蛋白(gp120)或肿瘤坏死因子α(TNF-α)在原始胎儿星形胶质细胞中诱导表达[8-9]。MTDH在致癌作用中起关键作用。MTDH过表达在多种肿瘤类型中均可见高表达,例如肝癌、乳腺癌、恶性肿瘤神经胶质瘤等,并且与临床状况预后不佳相关。相关研究也表明MTDH可通过EMT促进肝癌的转移,在肝癌细胞中MTDH的抑制导致EMT相关标志物N-cadherin 和Snail的下调,以及E-cadherin的上调。但是在食管癌中MTDH与EMT相关蛋白的关系少有报道。本研究通过探讨MTDH及EMT相关因子波形蛋白(Vimentin)在ESCC组织中的表达及意义,探讨食管癌有关分子与EMT的关系,旨在为食管癌的侵袭转移机制的研究提供新的思路。
1 资料与方法
1.1一般资料 选取75对食管鳞状细胞癌癌组织及对应的配对癌旁正常食管组织(距病灶3 cm以外),另有30例食管癌组织为不成对的食管癌组织,所有食管癌组织和正常食管组织均来源于组织芯片。所有病例纳入符合美国癌症联合会(AJCC)2009年第7版。
1.2主要试剂 MTDH抗体(稀释浓度为1∶200,Abcam,美国)、Vimentin抗体(稀释浓度为1∶200,Abcam,美国),DAB显色试剂盒(北京中杉金桥生物技术有限公司),兔源性二抗(北京中山金桥生物技术有限公司)。
1.3MTDH、Vimentin检测方法及结果判定标准 光学显微镜下可观察到细胞核和或细胞质中出现淡黄色或者黄褐色颗粒染色,即可判断为MTDH阳性;细胞核和或细胞核呈黄棕色染色为Vimentin阳性,每张切片分别随机选取5个高倍镜视野进行观察。阳性细胞比例评分如下:0分(无阳性肿瘤细胞),1分(<10%阳性肿瘤细胞),2分(阳性肿瘤细胞所占肿瘤细胞居于10%~50%)和3分(阳性肿瘤细胞所占比例>50%)。染色强度根据以下标准分级:0分(无染色),1分(弱染色=淡黄色),2分(中度染色=黄棕色)和3分(强染色=棕色)。染色指数(SI)=染色强度得分×阳性细胞比例。高表达:4≤SI≤9;低表达:SI≤2。结果由2位副高以上的病理科医生双盲进行诊断。
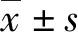
2 结 果
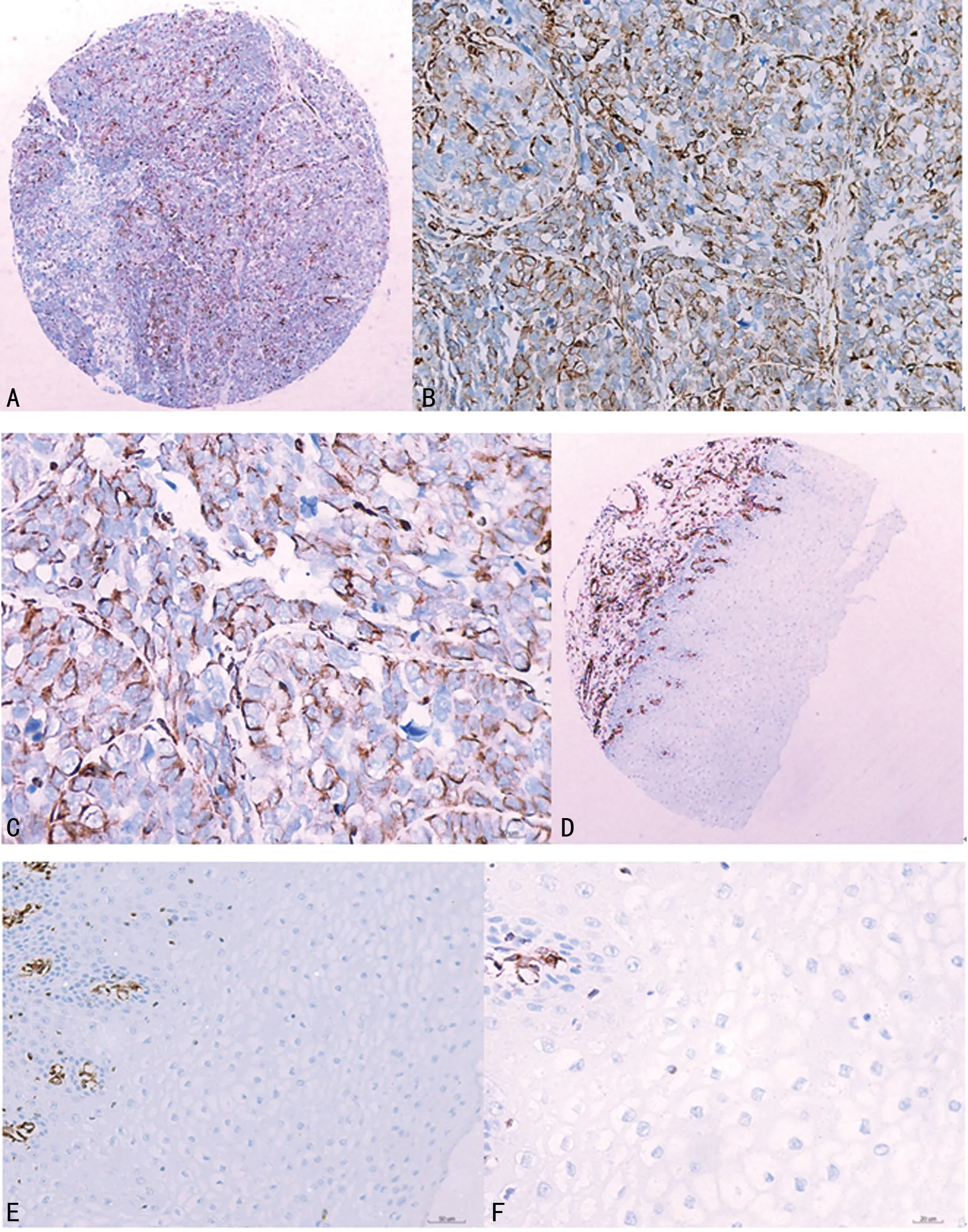
2.1MTDH在ESCC及配对癌旁正常食管组织中的表达及其与ESCC临床病理的关系 免疫组织化学显示,在食管癌细胞和少量正常食管上皮细胞中,可见MTDH的阳性表达,阳性细胞主要位于胞质,在细胞核中,也有部分MTDH的阳性表达,呈浅黄色、棕黄色,部分阳性表达呈褐色(图1)。与癌旁正常食管组织比较,MTDH在食管癌组织中的表达高于配对癌旁正常食管组织。
在86例食管鳞状细胞癌组织中,MTDH的阳性表达率为54.7%(47/86),在配对癌旁正常食管组织中MTDH的阳性表达率为14.1%(11/78),MTDH在食管癌组织中的阳性表达率明显高于配对癌旁正常食管组织,差异有统计学意义(P<0.05)。MTDH的表达与其他各临床病理参数的关系显示,MTDH在食管癌中的表达与N分期(P=0.016)、分化程度(P=0.005)有关,见表1。

续表1 食管癌组织中MTDH的表达与临床病理参数的关系

注:A为食管癌组织(×40);B为食管癌组织(×200);C为食管癌组织(×400);D为配对癌旁正常食管组织(×40);E为配对癌旁正常食管组织(×200);F为配对癌旁正常食管组织(×400)。
图1 MTDH在食管癌及配对癌旁正常食管组织中的表达
2.2MTDH的表达与食管癌预后的关系 高表达MTDH患者术后生存时间较短,低表达MTDH的患者,术后生存时间更长,两者中位生存时间比较,差异有统计学意义(P<0.05),患者Kaplan-Meier生存曲线见图2。

图2 MTDH高表达者与MTDH低表达者Kaplan-Meier生存曲线
注:A为食管癌组织(SP×40);B为食管癌组织(SP×200);C为食管癌组织(SP×400);D为配对癌旁正常食管组织(SP×40);E为配对癌旁正常食管组织(SP×200);F为配对癌旁正常食管组织(SP×400)。
图3 Vimentin在食管癌及配对癌旁正常食管组织中的表达
2.3Vimentin在ESCC及配对癌旁正常食管组织中的表达及其与ESCC临床病理的关系 免疫组化结果显示,Vimentin在食管癌细胞和正常食管上皮细胞中均有表达,在食管癌细胞中表达更多,阳性细胞主要定位在胞质,阳性表达呈浅黄、棕黄色或褐色颗粒,见图3。
在105例食管鳞癌组织中,Vimentin的阳性表达率为51.4%(54/105),在配对癌旁正常食管组织中Vimentin的阳性表达率为12.0%(9/105),Vimentin在食管癌组织中的阳性表达率明显高于配对癌旁正常食管组织,差异有统计学意义(P<0.05)。Vimentin在T3~T4期、N1~N3期、肿瘤体积>20 cm3的表达分别高于N0分期及肿瘤体积<20 cm3的食管癌组织,而在不同性别(P=0.480)、不同年龄(P=0.407)、不同病理分级(P=0.160)、不同大体类型(P=0.242)的食管癌中,Vimentin蛋白的表达比较差异无统计学意义(P>0.05),见表2。

表2 食管癌组织中Vimentin的表达与临床病理参数的关系
2.4Vimentin的表达与食管癌预后的关系 Kaplan-Meier法分析显示,Vimentin的高表达组食管癌患者生存率高于低表达组,但差异无统计学意义(P=0.335)。见图4。
2.5MTDH与Vimentin表达水平的相关性分析 Spearman相关性分析结果显示,MTDH与Vimentin在ESCC组织中表达水平呈显著正相关(r=0.218,P=0.019),见表3。

图4 Vimentin高表达者与Vimentin低表达者Kaplan-Meier生存曲线

表3 MTDH与Vimentin在ESCC组织中表达的相关性分析(n)
3 讨 论
相关研究证实EMT牵涉到多个生物学过程,EMT是转移的主要机制,与上皮肿瘤的恶性行为进展有关,因此已成为癌症预防和治疗的候选目标。EMT在肿瘤中参与肿瘤的侵袭转移,在肿瘤进展期,肿瘤细胞具有EMT的表现:细胞间黏附力变弱,E-cadherin的表达下降,细胞连接受损,导致上皮极性和细胞间粘连减少。上皮功能丧失通常伴有细胞运动性增加和表达间充质基因。在侵袭性肿瘤中,EMT是特征性地通过减少上皮标志物(E-cadherin)的表达和上调间充质基因标记(N-钙黏蛋白)来实现,在EMT中,上皮细胞由圆形演变为纺锤形细胞形态,出现Vimentin的上调表达,肿瘤细胞的极性继而会消失,促使细胞黏附能力下降,继而增加了细胞的运动能力,这有助于更多的基质细胞黏附特征并增加肿瘤细胞的运动性和侵袭性。ZHOU等[10]研究发现EMT是细胞获得逃逸能力的过程,是从上皮层侵入间质并形成转移灶的过程,与多种肿瘤,如卵巢癌的预后密切相关。
食管癌发生浸润和转移与EMT相关,EMT被认为是肿瘤细胞迁移和侵袭过程中最关键的步骤[11],一般来说,钙黏蛋白表达的缺失或减少及间质标志物的诱导上调是EMT发生的主要标志。在EMT过程中,除了上皮性标志物E-cadherin表达的变化,还常常伴随有间质性标志物Vimentin表达的改变。Vimentin即波形蛋白,属中间丝蛋白,主要表达于间叶组织细胞中,而在上皮细胞中几乎不表达。Vimentin可通过参与调节细胞黏附及改变细胞骨架结构,诱导EMT发生。大量研究结果证实,在多种恶性上皮性肿瘤组织中,E-cadherin蛋白表达下调,而Vimentin蛋白表达上调,且E-cadherin低表达和Vimentin高表达与肿瘤EMT及侵袭转移等因素密切相关。因此,本研究采用免疫组化染色分析中EMT相关蛋白Vimentin表达量的变化。DUARTE等[12]研究发现波形蛋白在细胞分裂过程中表现出明显的可塑性,支持细胞的基本功能和重组。波形蛋白丝在有丝分裂过程中重新分布到细胞皮层,形成一个与皮层肌动蛋白交织在一起并影响其组织的坚固的骨架,促进有丝分裂进程。本研究结果发现,Vimentin在食管癌组织中的表达主要为强阳性或中度阳性,在癌旁正常食管组织中的表达为阴性或弱阳性,在食管癌组织中的阳性表达率明显高于癌旁正常组织,差异有统计学意义(P<0.05)。而Vimentin的升高在很多肿瘤中都被视为发生EMT的转化,本研究与其结果相似,在食管癌组织中的表达升高,提示EMT转化与肿瘤发生相关。有研究报道,食管鳞癌组织中E-cadherin表达降低,Vimentin表达升高,说明EMT的发生与肿瘤的侵袭转移相关,本研究与其相似。本研究发现,在食管癌中Vimentin表达升高,Vimentin在食管癌中的表达与T分期(P=0.016)、N分期(P=0.018)、肿瘤体积(P=0.040)有关,证实食管鳞癌中确实存在EMT的现象,EMT在肿瘤的发现中起到了促进肿瘤侵袭、转移的作用。
MTDH是一种与恶性细胞高度相关的新型致癌基因,参与增殖、细胞凋亡、血管生成等生物学过程[13-14]。MTDH参与多种癌症相关的细胞信号通路,MTDH能促血管生成和促转移途径。MTDH促进细胞存活,抑制凋亡,并通过多种途径促进肿瘤进展。进一步研究报道,MTDH也与EMT相关,在肝细胞癌中,MTDH和E-cadherin、β-catenin、Snail和N-cadherin的表达有关。 MTDH在致癌作用中起关键作用,包括肿瘤的发生、转移和化学耐药性。MTDH促进能通过PI3K/Akt的磷酸化而促进肿瘤的发生;此外,MTDH增强血管生成因子的表达,例如缺氧诱导因子1-α和基质金属蛋白酶9,并促进内皮细胞向成纤维细胞转化。异常表达和MTDH的功能障碍参与各种肿瘤的发生和发展,包括乳腺癌、胶质母细胞瘤、胃癌和前列腺癌等。ZHANG等[15]研究表明MTDH在结肠癌的组织和细胞中高表达,且MTDH的表达与年龄、肿瘤部位、TNM分期及组织学分化程度有关,高MTDH表达者的生存率要明显低于低表达者,COX回归分析显示MTDH表达水平是影响大肠癌患者预后的独立因素。DHIMAN等[16]研究提出MTDH可能是多个肿瘤的治疗靶点,包括乳腺癌、前列腺癌、肝癌和食道癌。MTDH的高表达与前列腺癌有关,另外,MTDH在功能上与Ha-Ras癌基因相互作用并导致黑素细胞的进展。MTDH的表达还与乳腺癌干细胞的生长及对紫杉醇和曲妥珠单抗的耐受有关。同时,MTDH在唾液腺肿瘤中的表达升高,并与患者的预后有关。MTDH的表达增加也与肝细胞癌的复发和转移有关。在结肠癌中MTDH可以激活基质金属蛋白酶9,发挥促癌作用。MTDH的增加也与AKT/PI3K介导的头颈部鳞状细胞转移有关。相关研究报道显示,胃癌和非小细胞肺癌中,MTDH可通过肌动蛋白的细胞骨架重塑调节癌细胞的转移。多项研究报道MTDH与鳞状细胞癌的高表达有关[17-18],MTDH在食管癌中的表达与N分期(P=0.016)相关;发生淋巴结癌转移的患者MTDH表达的阳性率明显高于未发生淋巴结转移患者,差异有统计学意义(P<0.05)。结合Kaplan-Meier生存曲线,患者MTDH的表达越高,术后中位生存时间越短,低MTDH表达的患者生存时间更长(P=0.001),说明MTDH蛋白表达程度与食管癌的恶性程度有一定的关系,且与预后密切相关,因此,推测可以通过检测食管癌组织中MTDH的蛋白表达水平来判断食管癌进程,并对食管癌的预后帮助有一定的帮助。
另外,本研究发现MTDH与Vimentin在食管癌组织中的表达水平呈正相关(r=0.218,P=0.019),提示MTDH和Vimentin在食管癌的发生、发展中二者相互影响,可能具有促进作用。
4 结 论
食管癌组织癌细胞中存在EMT现象,参与食管癌的浸润及转移,MTDH在食管癌的发生、发展中表达水平显著上升,且与发生淋巴结转移密切相关,可能具有促进食管癌发生及肿瘤细胞浸润转移的作用,其机制可能与MTDH与Vimectin相互促进彼此的表达相关。本研究为阐明食管癌的发病机制提供了资料,也为食管癌的临床诊断治疗和预后分析提供了理论依据。联合检测MTDH和Vimectin的表达可作为更为理想的肿瘤标记物辅助食管癌的诊断。
