2型糖尿病患者血浆中PAI-1及sVCAM-1水平与耳鸣的相关性研究*
2020-04-20王庆,罗茂
王 庆,罗 茂
(1.乐山市市中区人民医院耳鼻喉科,四川乐山 614000;2.西南医科大学药物研究中心,四川泸州 646000)
随着当代医学对2型糖尿病(T2DM)的深入研究,人们认识到T2DM本身并不会对患者生命造成较大威胁,而其引发的血管、肾脏、视网膜损害将严重影响患者生活质量[1]。近年来,听力损害作为T2DM的并发症,正逐渐受到卫生领域重视,相关调查报告显示,糖尿病患者并发听力障碍风险为健康人群的2倍,其特征常见双侧对称性、渐进性、不可逆性病变[2],且多以高频听力损害为主,表现为耳鸣、耳聋等症状,为患者日常生活带来诸多不便。由于T2DM患者主观感受、听觉感受并不能确切反映其实际的听力情况,因而并发耳鸣症状在早期并不容易察觉,即便通过纯音测听试验也不能做出有效诊断[3]。然而全面的听力学检查项目较多,且试验程序复杂,对测试仪器与测试者经验要求较高,早期筛查诊断仍较为困难。基于此,本研究检测了T2DM产生的全身性病变相关标志物,分析了这些标志物与并发耳鸣之间的潜在联系,取得一定成果,现报道如下。
1 资料与方法
1.1一般资料 对2017年4月至2019年3月乐山市市中区人民医院收治的64例T2DM并发耳鸣患者(观察组)及148例单纯T2DM患者(对照组)临床资料进行回顾性分析。观察组男性34例,女性30例;年龄60~88岁,平均(76.33±5.41)岁;T2DM病程为7~20年,平均(14.94±3.26)年;空腹血糖(FPG)水平为(9.47±1.35)mmol/L,糖化血红蛋白(HbA1c)水平为(8.82±0.73)%;耳鸣残疾度量化表(THI)评分为(27.95±6.89)分。对照组男性76例,女性72例;年龄48~81岁,平均(65.12±9.50)岁;病程为3~18年,平均(11.60±4.18)年;FPG水平为(8.60±1.22)mmol/L,HbA1c水平为(8.26±0.59)%。纳入标准:(1)临床表现及口服葡萄糖耐量试验(OGTT)检测结果均符合T2DM相关诊断标准;(2)年龄40~90岁;(3)中耳及前庭功能正常。排除标准:(1)诊断为外耳道栓塞、中耳炎、耳硬化症、内耳畸形、鼓膜穿孔、梅尼埃病等耳部疾病因素或病毒感染、噪声、爆震、外伤、中毒、颞颌关节疾病等直接因素引起的耳鸣;(2)存在意识、精神障碍而无法对耳鸣状况进行如实描述;(3)临床资料不完整。
1.2方法 患者空腹状态下常规采集肘静脉血5 mL,乙二胺四乙酸二钠(EDTA)抗凝管保存,30 min内通过3 000 r/min转速离心机内处理≥20 min,提取上清液保存于样品管,在-80 ℃冰箱中冻存待测;确保批量测试周期≤3个月,测试采用纤维酶原激活物抑制物-1(PAI-1)、可溶性血管细胞黏附分子-1(sVCAM-1)、3-硝基酪氨酸(3-NT)、神经生长因子(NGF)对应酶联免疫吸附法(ELISA)试剂盒(购自伊莱瑞特生物科技有限公司),测试前24 h将血浆样品转移至4 ℃冰箱缓慢解冻,测试前30 min将血浆样品与试剂盒转移至实验台上平衡至室温,在此期间准备好稀释液、工作液、洗涤液、底物溶液、终止液等所需试剂,取96孔板分别标记空白孔、样品孔及多个标准孔;向空白孔、样品孔与首级标准孔中分别加入稀释液、血浆样品与标准品溶液,逐级稀释标准品溶液并确保每孔液体体积均为100 μL,混匀后覆膜在37 ℃恒温箱中温育1 h;倾去孔内液体后甩干,加生物素化抗体工作液100 μL,混匀后覆膜在37 ℃恒温箱中温育1 h;倾去液体后每孔加入洗涤液350 μL,浸泡2 min后倾去,重复洗涤3次后在吸水纸上尽量拍干,每孔加酶结合物工作液100 μL,混匀后覆膜在37 ℃恒温箱中温育30 min;倾去液体后甩干,以上述方法洗涤5次并拍干,每孔加入底物溶液90 μL,混匀后覆膜、加盖避光在37 ℃恒温箱中温育约15 min,终止时间以半数标准孔休闲肉眼可见显色即可,以底物溶液相同顺序加入终止液50 μL;通过酶标仪在450 nm波长处测量每孔光密度(A),以空白孔数据校正背景,将孔梯度浓度与A值绘制为标准曲线并拟合出回归方程,计算对应样品孔血浆样品中对应物质的浓度水平。
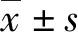
2 结 果
2.1两组各指标比较 观察组血浆PAI-1、sVCAM-1、3-NT、NGF水平均明显高于对照组,差异均有统计学意义(P<0.05),见表1。

表1 两组患者血浆PAI-1、sVCAM-1、3-NT、NGF水平比较
2.2预测诊断效能分析 血浆PAI-1、sVCAM-1、3-NT、NGF单独预测T2DM患者并发耳鸣ROC曲线AUC>0.5,Youden指数对应cut-off值分别为8.06 mmol/L、58.50 ng/mL、269.79 pg/mL、4.16 ng/mL;4个指标联合预测的ROC曲线AUC为0.796,均明显大于单独预测指标(P<0.05)。见图1、表2。

图1 各指标单独及联合预测T2DM患者并发耳鸣的ROC曲线

表2 ROC曲线参数
注:与联合预测比较,*P<0.05;-表示无数据。
2.3相关性分析 观察组患者血浆PAI-1、sVCAM-1、3-NT、NGF水平与THI评分均表现出显著正相关性(r>0,P<0.05),见表3。

表3 各指标与观察组THI评分的Pearson相关性分析
3 讨 论
PAI-1属于纤溶系统的重要组成部分,其主要功能是通过抑制纤维酶原激活物(PA)活性,以调节整个纤溶系统平衡[4]。T2DM患者在血糖逐渐升高及糖耐量下降的同时,血管内皮细胞功能失调,PAI-1过度释放,纤溶抑制可随之出现,引起血液高凝状态,能促进血栓形成,心、脑血管病变风险极大增加[5],是独立于体质量指数(BMI)、胰岛素抵抗指数(HOMA-IR)、糖尿病家族史等已知因素以外的危险因素。有关研究指出,血液流变学异常可增加微血管循环负担,不仅基底膜增厚,管状内皮细胞也将出现病理增生,与糖尿病视网膜病变机制相仿,可加重耳蜗毛细胞内脂肪沉积作用,形成典型的微循环障碍,进而导致听觉损害[6]。本研究结果显示,观察组血浆PAI-1水平明显高于对照组,与THI评分有明显正相关性,ROC曲线显示PAI-1≥8.06 mmol/L可高风险提示为耳鸣,这表明血浆PAI-1能一定程度预测T2DM并发耳鸣及其严重程度,临床检测可通过参考阈值进行早期筛查诊断。
sVCAM-1是免疫球蛋白超家族成员之一,主要由活化的血管内皮细胞、平滑肌细胞、巨噬细胞及成纤维细胞表达,其配体为整合素家族的极迟抗原-4(VLA-4),二者结合能介导细胞间相互黏附作用[7]。T2DM导致的广泛炎性反应,将促使动脉粥样硬化病变进程加快,并触发血管内皮细胞受损,白细胞更易于向内皮下结构募集,刺激其过度表达sVCAM-1[8]。据相关研究报道,内耳血流供应主要依赖于小脑前下动脉分支,且由于其他代偿动脉较少,一旦血管发生病变导致内耳缺血,即便成功达成再灌注,也难以恢复耳蜗正常电位[9]。本研究中,观察组血浆sVCAM-1水平明显高于对照组,与THI评分正相关性良好,sVCAM-1≥58.50 ng/mL可提示存在较高耳鸣风险。
T2DM由于存在葡萄糖自身氧化、蛋白质非酶促糖基化、多元醇通路过度激活等作用产生广泛的氧化应激,不仅可进一步损害胰岛β细胞,还将减少外周组织对胰岛素的敏感性[10]。3-NT作为蛋白质硝基化的主要产物,是T2DM患者体内一氧化氮被超氧阴离子氧化为过氧亚硝基阴离子(ONOO-)后造成蛋白质氧化损伤的主要证据[11]。有学者认为,ONOO-能对多种生物大分子产生过氧化与硝基化作用,能导致DNA链断裂与多聚核苷酸二磷酸核糖基聚合酶(PARP)激活,对神经病变与微血管病变均有较强促进作用[12]。本研究发现,观察组血浆3-NT水平明显高于对照组,与THI评分有明显正相关性(r=0.473,P=0.011),其cut-off值为269.79 pg/mL,因此T2DM患者3-NT水平越高,越容易并发更严重的耳鸣,早期检测可一定程度反映患者微血管病变及神经病变的程度。
NGF是最早发现的神经营养因子,不仅能维持神经细胞生理活动,还可促进新生血管形成等非神经组织生理活动。既往研究已证实随着糖尿病病程延长,血管内皮细胞损害与非酶促糖基化反应加剧,NGF表达与HbA1c生成量同时增高[13]。针对糖尿病视网膜病变患者而言,视网膜低氧状态可诱发视神经细胞过度表达NGF以产生代偿性保护作用,由于能提高新生血管网增生效率,将进一步损害视功能[14]。赵振鹿等[15]在研究中提出,T2DM患者耳蜗小血管管壁增厚明显,血管纹则有显著萎缩,螺旋神经节细胞出现明显缺失,神经纤维则明显减少,第Ⅷ颅神经纤维束结构变得更为松散,导致部分神经轴索分裂为碎片,从而引起听力障碍。本研究也发现,观察组血浆NGF水平明显高于对照组,与THI评分正相关性良好,其水平大于或等于4.16 ng/mL者更易于出现耳鸣,且联合应用上述指标能提高对T2DM患者并发耳鸣的早期预测诊断效能,可作为全面听力学功能测试前的迅速联合筛检项目应用于临床。
4 结 论
糖尿病并发耳鸣早期确诊相对困难,有必要通过简便易行的检测方法提供诊断与评估信息。血浆PAI-1、sVCAM-1、3-NT、NGF水平作为生化指标,均已证实与T2DM患者并发耳鸣严重程度存在确切正相关性。尽早通过实施联合检测,可为临床干预提供指导,具有较高预测价值。
