EGFL8基因沉默对肝癌细胞侵袭转移能力的影响
2020-04-20
暨南大学医学院附属广州红十字会医院肝胆外科(广州510220)
肝细胞癌(hepatocellular carcinoma,HCC)是临床上第6位最常见的恶性肿瘤,尽管近年来针对肝癌的手术切除、经皮射频消融术及肝移植等治疗手段和分子靶向药物的应用取得了一定的进步[1],使肝癌患者的5年生存率较此前提高了10%以上[2],但是肝癌的复发和转移仍是肝癌患者致死的主要原因[3]。因此,探索肝癌转移的分子机制,对于研发新的肝癌治疗措施及提高其总体治疗效果均具有重大意义[4]。笔者前期研究已发现EGFL8 在结直肠癌及胃癌中表达下调,且其低表达与这两种恶性肿瘤的转移、TMN 分期及预后密切相关[5-6],提示其可能参与多种消化道恶性肿瘤的调控,但目前尚未见EGFL8 在肝癌中的研究报道。为此,本研究检测了EGFL8 在3种不同转移潜能的肝癌细胞系的表达水平,并采用慢病毒介导的siRNA技术靶向沉默Hep3B 肝癌细胞系中EGFL8的表达,观察EGFL8基因沉默对肝癌细胞侵袭迁移能力的影响。
1 材料与方法
1.1 细胞系及质粒Hep3B及SMMC-7721 肝癌细胞系均购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所,HCCLM3 肝癌细胞系、293T 细胞及慢病毒质粒GV248,包装质粒pGCLV、pHelper1.0和pHelper2.0 均购自上海吉凯基因化学技术有限公司。
1.2 实时定量PCR检测提取细胞总RNA并逆转录,在荧光定量PCR 仪(TP800,日本TAKARA 公司)上行PCR 检测,反应条件为:95℃预变性15 s,然后95℃变性5 s,60℃退火延伸30 s,共进行45个循环。EGFL8 引物为:上游,5′-GTCCCGCTCC ACTACAACG-3′;下游,5′-GCGGTACATGGTCCTGTAAGT-3′。内参GAPDH 引物为:上游,5′-TGACTTCAACAGCGACACCCA-3′;下游,5′- CACCCTGTTGCTGTA- GCCAAA-3′。以2-ΔCT法分析EGFL8基因的表达水平。
1.3 慢病毒介导的siRNA设计针对EGFL8基因的shRNA 序列如下:正义链:5′-CCGGCAACCAGTGCCAGCATACTCACTCGAGTGAGTATGCTGGCACTGGTTGTTTTTG-3′;反义链:5′-AATTCAAAAAGAGTTGGTACTGGATCACATTCTCGAGAATGTGATCCAGTACCAACTC-3′。阴性对照序列为:正义链:5′-CCGGTTCTCCGAACGTGTCACGTTTCAAGAGAACGTGACACGTTCGGAGAATTTTTG-3′;反义链:5′-AATTCAAAAATTCTCCGAACGTGTCACGTAAGTTCTCTACGTGACACGTTCGGAAA-3′。上述序列由上海吉凯基因化学技术有限公司合成,并将其所形成的DNA 双链连接到siRNA慢病毒质粒GV248,再将上述质粒分别与pGC-LV、pHelper1.0和pHelper2.0 3个包装质粒共转染至293T 细胞,制备EGFL8-siRNA及阴性对照慢病毒。上述两种慢病毒各自感染的Hep3B 肝癌细胞系即被分别命名为shEGFL8组(实验组)和shCtrl组(对照组)Hep3B 细胞。采用荧光倒置显微镜(micropublisher 3.3RTV,日本奥林帕斯公司)观察两组细胞的慢病毒感染效率,并采用实时定量PCR 法检测两组细胞中EGFL8基因的表达水平以检测EGFL8基因的沉默效率。
1.4 Transwell小室侵袭实验检测细胞侵袭能力将Transwell 小室(购自美国Corning 公司)放置于一个洁净的24 孔板中,取100 μL 无血清培养基加入Transwell 小室,放置培养箱中1~2 h。在24 孔板下室中加入30% FBS 培养基600 μL,用无血清培养基稀释细胞,在每个小室中加入1 × 105个细胞,把小室转移入含30%FBS 培养基的下室中,在组织培养箱中常规培养4~24 h。移除培养基,用棉签仔细除去非转移细胞,在24 板的空孔中加入400 μL Giemsa 染色液,把小室浸泡在染色液中20 min,在聚碳酸酯膜的下方对转移细胞进行染色,完成后弃去孔中培养液,冲洗数次,将小室适当风干。显微镜拍照计数穿过膜的细胞数即为侵袭细胞数。
1.5 划痕实验检测细胞迁移能力将所有能灭菌的器械及划痕仪在操作前使用紫外照射30 min(超净台内)。在96 孔板中按约3×104个细胞/孔,加入各组Hep3B 细胞系。待细胞生长铺满96 孔板底表面时,使用划痕仪对准96 孔板的下端中央部位,向上平移形成划痕。使用无血清培养基轻轻漂洗2 遍,加入低浓度血清培养基,随后将96 孔板放入37℃、5%CO2培养箱培养。分别于划痕后0、24和72 h 显微镜拍摄照片并测量划痕宽度,并计算各组细胞24 h和72 h的细胞迁移率,计算公式为细胞迁移率=(划痕后0 h 划痕宽度-划痕后24 h或72 h 划痕宽度)/划痕后0 h 划痕宽度×100%。
1.6 统计学方法应用SPSS 19.0 统计软件进行统计学分析。计量资料以均数±标准差表示,对EGFL8 在肝癌细胞系中的表达水平采用单因素方差分析检验,多重比较采用Tukey 检验;其余采用Student′st检验。所有分析均为双侧检验,P<0.05为差异具有统计学意义。统计图采用Graphpad Prism 5.0 软件(美国Graphpad 软件公司)绘制。
2 结果
2.1 EGFL8在肝癌细胞系中的表达水平多重比较的方差分析显示EGFL8 在侵袭转移能力最强的HCCLM3细胞系中的表达水平低于侵袭转移能力中等的SMMC-7721 细胞系(0.000 261 3 ± 0.000 019vs.0.000 602 8±0.000 031 28,P=0.007 1),后者又显著低于侵袭转移能力最弱的Hep3B 细胞系(0.000 602 8±0.000 031 28vs.0.002 106±0.000 782,P<0.000 1)见图1。
2.2 慢病毒的感染效率及EGFL8基因沉默效率荧光显微镜观察shCtrl组和shEGFL8组Hep3B细胞的结果显示,两组细胞中可发出绿色荧光的细胞比例均超过80%,显示慢病毒的感染效率达到80%以上(图2A)。实时定量PCR 结果显示shEGFL8组Hep3B 细胞中的EGFL8基因表达水平仅为shCtrl组的23.3%(0.233 ± 0.007vs.1.013 ± 0.118,t= 6.582,P= 0.002 8),即EGFL8基因在Hep3B 细胞系中的沉默效率达到了76.7%(图2B)。

图2 慢病毒的感染效率及沉默效率Fig.2 Infection efficiency and silencing efficiency of lentivirus
2.3 EGFL8基因沉默对肝癌细胞侵袭能力的影响Transwell 小室侵袭实验的结果示,在同样时间内,shEGFL8组Hep3B 细胞的侵袭细胞数量明显高于shCtrl组(105.3±6.983vs.52.33±4.256,t=6.48,P= 0.002 9),证明shEGFL8组Hep3B 细胞的侵袭能力显著高于shCtrl组,提示EGFL8基因沉默可增强肝癌细胞的侵袭能力(图3)。
2.4 EGFL8基因沉默对肝癌细胞迁移能力的影响划痕愈合实验的结果显示,shEGFL8组Hep3B细胞的24及72 h 迁移均高于shCtrl组(24 h 迁移率:10.67% ± 1.20%vs.5.67% ± 0.33%,t= 4.009,P= 0.016;72 h 迁移率:22.67% ± 1.20%vs.12.67%± 1.20%,t= 5.883,P= 0.004),提示EGFL8 沉默可明显增强肝癌细胞的迁移能力(图4)。
3 讨论
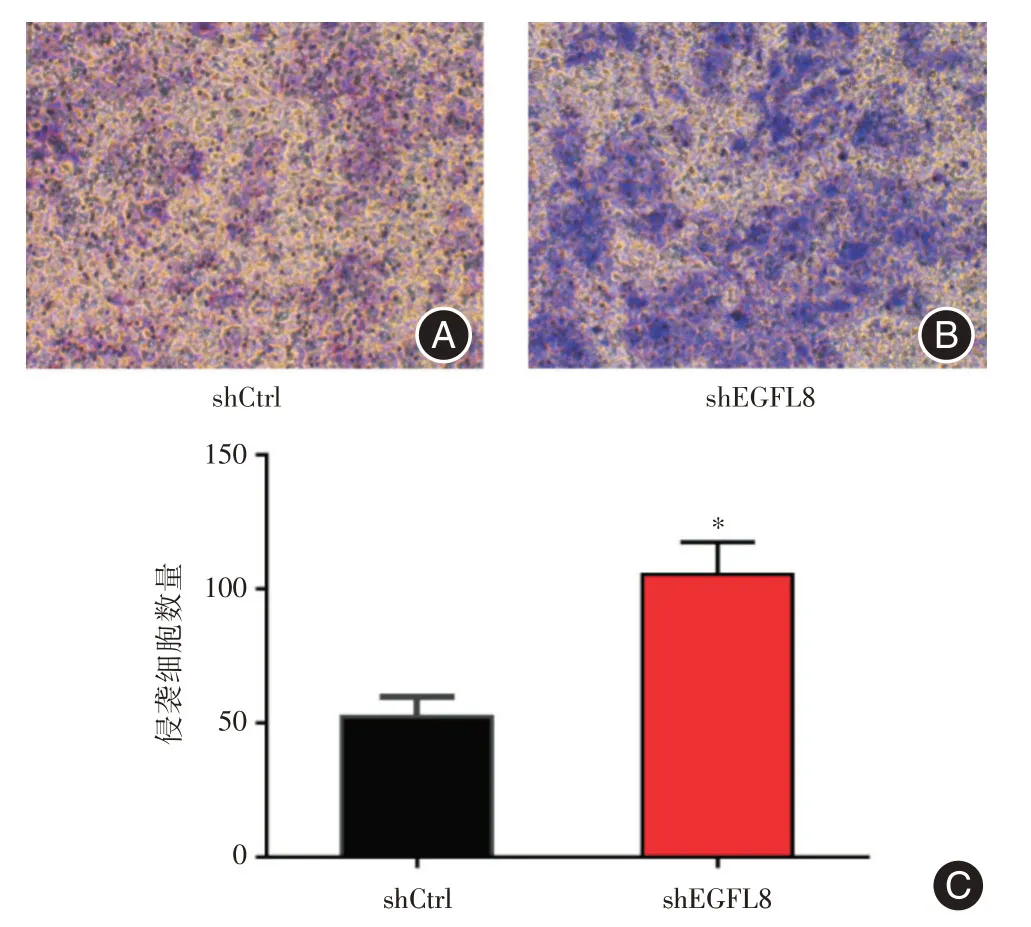
图3 Transwell 小室侵袭实验结果Fig.3 Results of transwell chamber invasion assay
原发性肝癌是全球第5 大常见的恶性肿瘤,占肿瘤致死原因的第3位,全球每年有超过50万人罹患肝癌,其中一半以上在中国[7]。尽管针对肝癌的治疗手段众多,如手术切除、介入治疗、传统放化疗、基因靶向治疗、生物治疗和中医药治疗等,但根治性肝切除术仍然是治疗肝癌的最主要的手段,然而,即便在实施了肝癌肝切除术的患者中,仍然有超过50%以上的患者出现术后的复发和转移[1],这显著限制了肝癌总体治疗效果的进一步提高。因此,肝癌侵袭转移的机制已成为目前肝癌研究中的重点问题。
在前期研究中,笔者阐述了EGFL7 基因可通过EGFL7/EGFR/FAK 这一信号通路影响肝癌的侵袭转移,显示EGFL7可成为一个新的潜在肝癌治疗靶点[8]。EGFL8基因是EGFL7的同源基因,两者均为EGFL 基因家族成员[9]。EGFL8 蛋白与EGFL7蛋白具有极为相似的分子结构,两者均属于分泌型蛋白,都含有一个EGF 样结构域,一个钙离子结合型EGF 样结构域和N 尾端的信号肽[9-10],且二者在成年小鼠组织中的表达水平也很相似,均在肾、脑、胸腺及肺组织中高表达[10],这种结构和表达谱的高度相似性提示EGFL8 可能和EGFL7 一样影响人类恶性肿瘤的发生发展。而笔者前期研究也确实证实EGFL8 在人结直肠癌及胃癌组织中的表达水平较正常组织明显下调,且其低表达与结直肠癌及胃癌的转移、疾病进展及不良预后密切相关。然而,目前尚无EGFL8 在肝癌中表达及功能的研究报道。因此,本研究检测了EGFL8 在Hep3B 等三种肝癌细胞系中的表达水平,结果发现转移潜能最强的HCCLM3 肝癌细胞系[11]中的EGFL8表达水平低于中等转移潜能的SMMC-7721肝癌细胞系[12],后者中的EGFL8表达水平又低于转移潜能最弱的Hep3B 肝癌细胞系[13],提示EGFL8表达水平的下调可能与肝癌细胞转移潜能的增强相关,然而EGFL8 在肝癌中发挥的功能尚不清楚。

图4 划痕愈合实验的结果Fig.4 Results of wound healing assay
为进一步研究EGFL8在肝癌中的生物学功能,本研究采用小干扰RNA技术靶向抑制了3种肝癌细胞系中EGFL8表达水平最高的Hep3B 肝癌细胞系中EGFL8基因的表达,从而模拟EGFL8基因在肝癌组织中表达水平下调的状态,以此观察EGFL8 下调对肝癌侵袭转移能力的影响。相较于直接转染的siRNA 片段易降解而导致基因沉默不持久,慢病毒介导的siRNA技术具有可感染分裂期和非分裂期细胞、转移基因片段容量大、目的基因表达时间长、不易诱发宿主免疫反应等优点[14],这使其成为目前主要的基因抑制技术[15]。本研究结果显示慢病毒的感染效率达到80%以上,而EGFL8基因的沉默效率达到了76.7%,显示了慢病毒介导的siRNA技术在基因靶向沉默中的优势。进而,通过Transwell 小室侵袭实验及划痕愈合实验来观察EGFL8基因表达抑制对肝癌细胞侵袭迁移能力的影响。实验结果显示,EGFL8 沉默组Hep3B 肝癌细胞的侵袭能力和迁移运动能力较之对照组细胞都有明显的增强,这不仅验证了笔者之前的推测,即EGFL8基因可能参与了肝癌的发生发展过程,而且与前期研究发现的EGFL8表达下调与结直肠癌及胃癌的腹膜播散及肝转移等密切相关的结果相吻合[5-6],提示EGFL8基因可能发挥了抑制肝癌细胞侵袭迁移的作用。
有研究[16]显示,EGFL8 对小鼠胸腺上皮细胞中细胞间粘附因子(ICAM-1)的表达具有负向调控的作用:即EGFL8 过表达可抑制小鼠胸腺上皮细胞中ICAM-1的表达,而EGFL8基因沉默则可促进小鼠胸腺上皮细胞中ICAM-1的表达。因为ICAM-1在现有的研究中被公认为可促进肝癌等多种恶性肿瘤的侵袭转移[17-18],而胸腺上皮细胞和肝癌细胞都属于腺上皮细胞,而笔者推测EGFL8 在肝癌中可能也存在对ICAM-1 表达的负向调控,即沉默EGFL8基因表达时可能上调肝癌细胞中ICAM-1的表达水平,进而增强肝癌的侵袭转移。此外,重组小鼠EGFL8 蛋白可抑制小鼠胸腺细胞中Notch信号通路下游作用基因Hes1和Hey1的表达[19],而后者已被证实可促进肝癌的转移[12-20],提示EGFL8也有可能通过抑制Notch 信号通路发挥其抑制肝癌侵袭转移的功能。由于EGFL8 蛋白和EGFL7蛋白有着相同的蛋白质结构,而EGFL7 蛋白又称VE-statin,是一种血管内皮抑制素,通过抑制平滑肌细胞的运动来抑制血管的新生和成熟[21-22]。笔者由此推测,肝癌细胞中的EGFL8表达下调也有可能通过提高平滑肌细胞的运动能力来促进肿瘤内血管的生成,从而提高肝癌细胞的增殖、侵袭及转移能力。显然,EGFL8 调控肝癌细胞侵袭转移能力的具体分子机制和EGFL8 在肝癌中的更多生物学功能目前尚不清楚,还有待于进一步研究阐明。
综上所述,本研究EGFL8的表达下调与肝癌细胞系的转移潜能相关,EGFL8基因沉默则可显著提高Hep3B 肝癌细胞系的侵袭迁移能力,提示EGFL8 可能是一个肝癌转移抑制基因,有望成为降低肝癌复发转移的治疗靶点。
