甲基-CpG结合蛋白1缺失小鼠抑制背根神经节与脊髓背角降钙素基因相关肽生成缓解炎性疼痛
2020-04-20盛恒炜磨凯
盛恒炜 磨凯
1南部战区总医院麻醉科(广州510010);2南方医科大学珠江医院麻醉科(广州510280)
正常感觉信息或伤害性信息传递依赖于神经系统感觉传导通路中痛觉相关基因的完整表达[1-2]。该痛觉相关基因在外周炎症或神经损伤后的表达改变对急慢性疼痛的诱导和维持至关重要[3],而且疼痛状态下的这些疼痛基因的表达依赖于表观遗传调控[4-5]。甲基-CpG结合域蛋白1(methyl-CpG-binding domain protein 1,MBD1)是一个具有调节基因转录活性的表观遗传抑制因子[6-7]。笔者最新研究显示,MBD1 缺失小鼠能缓解神经损伤引起的疼痛行为,机制上进一步发现背根神经节(dorsal root ganglia,DRG)内MBD1 可募集DNA 甲基化转移酶DNMT3a 到μ阿片受体基因(Oprm1)和钾通道蛋白Kv1.2 基因(Kcna2)两个痛觉相关基因启动子区抑制其表达,从而调控急性疼痛和神经病理性疼痛的产生和持续[8-9]。因此DRG MBD1 可能是急慢性疼痛的发展和持续的关键因素。然而,MBD1 缺失缓解完全弗氏佐剂(complete freund′s adjuvant,CFA)诱导的慢性炎性疼痛具体机制仍然不清楚[8],明确这一机制对慢性炎性疼痛病因治疗至关重要。
慢性炎性疼痛是由多种炎症介质刺激C-类纤维产生动作电位并上传到脊髓背角,其冲动在脊髓内通过背根反射逆行传到感受外周伤害性刺激的神经末梢,导致神经肽和神经递质生成和释放增加,造成血管扩张和渗出增多等炎症反应,在外周和中枢形成一个正反馈,促进炎性疼痛的发展和持续[10-12]。这些神经肽和神经递质包括降钙素基因相关肽(calcitonin gene related peptide,CGRP)、P 物质、神经激肽A和速激肽等,其中CGRP 在介导炎性疼痛发展和持续中发挥重要作用[13-14]。那么,MBD1 缺失是否通过抑制背根神经节和脊髓背角区CGRP的生成与释放,从而缓解慢性炎性疼痛产生和持续,目前尚未见报道。基于此,本研究拟采用MBD1 敲除小鼠构建小鼠CFA诱导的炎性疼痛模型,检测DRG和脊髓背角内CGRP 含量改变,探讨MBD1 缺失对慢性炎性疼痛调控的具体机制。
1 材料与方法
1.1 实验动物及分组
1.1.1 实验动物野生型小鼠(wildtype,WT)选用SPF级健康雄性8 周龄C57BL6J 小鼠,体质量约25~30 g 小鼠,由南方医科大学动物实验室提供;同时选取年龄、性别和体质量相符的MBD1 敲除小鼠(knockout,KO)与之配对,MBD1 KO 小鼠由美国罗格斯大学新泽西医学院提供,其遗传背景与C57BL6J小鼠完全相同,其敲除方法见文献[8,15]。
1.1.2 分组根据处理方式不同,按随机数字表法分为4组,分别为做足底注射生理盐水(normal saline,NS)、CFA的WT小鼠组和注射NS、CFA的KO小鼠组(每组7 只)。小鼠鼠分笼饲养,室温和湿度分别保持在24±1℃和50%~60%,白天(12 h)一黑夜(12 h)循环照明,实验前对小鼠进行适应性饲养l 周,本研究依据国际疼痛研究学会(IASP)准则和学校动物伦理委员会许可实施小鼠疼痛实验。
1.2 MBD1基因敲除小鼠的饲养繁育与基因型鉴定由美国罗格斯大学新泽西医学院提供的3 只MBD1-/-雄小鼠(纯合子)和3 只MBD1+/-雌小鼠(杂合子),该小鼠的遗传背景为C57BL/6。因雌MBD1-/-纯合子小鼠生育力极低,本研究采用一只MBD1-/-纯合子雄鼠和一只MBD1+/-杂合子雌鼠同居交配繁育的方式进行繁殖。新生小鼠出生第5~7 d时,无菌条件下将小鼠距离尾端3 mm的鼠尾组织剪断,标记后置于离心管中。每个离心管中各加入600 μL 50 mmol/L的NaOH 溶液,置于99℃金属浴中煮20 min。冷却至室温后,将每个离心管中各加入100 μL 1M Tris-HCl(pH-7.4),混匀后转移到离心机中以10 000g离心管5 min。转移上清100 μL至新的离心管中可存于-20℃冰箱备用。18 μL PCR 反应体系:GoTaq Green Master Mix,2×(Promega 公司,M7122)9.0 μL,上下游引物混合物1 μL,DNA 模板2 μL,dH2O 6.0 μL。反应条件为:第1 步94 °C 1 min 预变性,第2 步94℃变性1 min,63℃退火1 min,72℃延伸1 min,共40个循环,第3 步72℃5 min,第4 步冷却到20℃后反应结束。取10 μL PCR 产物加入含6 μL 溴化乙啶的100 mL 电泳缓冲液制备的2%琼脂糖胶板上样孔内,电泳槽中电泳(135 V)20 min,然后置入凝胶成像仪中进行成像保存并观察电泳条带,依照特定的基因条带对各个小鼠的基因型进行鉴定(图1)。基因型鉴定引物序列:WT 正义链5′-TCTTCTCAGACTGAGGAAGGGTGA-3′,反义链:5′-CAAGGTCCAACGCCACTGAACAT-3′,350 bp;KO 正义链:5′-GGATTCTCCGTGGGAACAAACG-3′,反义链:5′-CAAGGTCCAACGCCACTGAACAT-3′,450 bp。
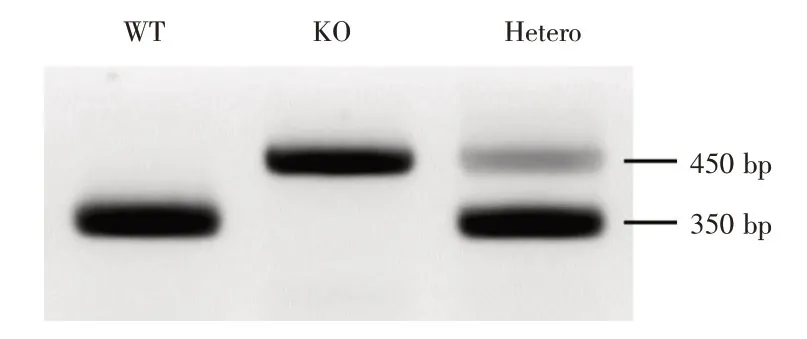
图1 基因型鉴定典型图Fig.1 Genotype identification
1.3 CFA慢性炎性痛模型制备按50%乳化的弗氏完全佐剂(complete freund′s adjuvant,CFA,美国Sigma 公司)10 μL 皮下注射到小鼠左足底(等量的生理盐水做对照)建立CFA 炎性疼痛模型,4组小鼠分别于注射前1 天(-1 d)、注射后2 h、1、3、7和14 d 测定机械痛阈和辐射热痛阈,具体方法如下。
1.4 小鼠疼痛行为学测定
1.4.1 机械痛阈测定CFA注射前(-1 d)、注射后2 h、1、3、7和14 d时,各组小鼠放置于有机玻璃箱内适应30 min 安静后,使用0.4 g von Frey 细丝测定各组小鼠后肢机械痛阈。方法同既往文献,即将纤毛丝垂直刺激各小鼠后足底中部,当小鼠受刺激出现缩足、抬腿,记做1次阳性反应,连续刺激10次,每次间隔5 s,记录10次刺激中出现阳性反应的频数,完成各组测试后计算缩爪反应频率(paw withdrawal frequency,PWF)=(有效反应次数/10)×100%,以此评定小鼠机械痛阈。
1.4.2 辐射热痛阈测定CFA注射前(-1 d)、注射后2 h、1、3、7和14 d时,各组小鼠放置于恒温的玻璃台上的有机玻璃笼内,维持小鼠足底皮肤的温度恒定,室温稳定在22~24℃,30 min 适应环境后,采用热辐射刺激仪(美国life science instruments 公司)照射小鼠的后足底中部,记录从照射开始到小鼠出现抬足的时间,记为热缩足反应潜伏期(paw withdrawal latency,PWL),来判定小鼠热痛敏情况。辐射适宜强度调整为8~12 s,设置刺激切断时间为20 s 以免热辐射灼伤小鼠皮肤,每次刺激间隔15 min,连续刺激5次,记录5次测量的平均值作为该后爪PWL 值。
1.5 ELISA法测 定DRG和脊髓 背角CGRP 含量 另取上述4组小鼠(每组3 只)于CFA注射后1天(CFA 致痛最明显时点)机械痛阈和热痛阈测定结束后,七氟醚深度麻醉后处死,快速取出患侧和对侧L3和L4 DRG组织和腰膨大处脊髓患侧和对侧背段。按CGRP EIA 试剂盒(法国SPI-BIO 公司)操作说明,取出4组患侧脊髓背角组织(左侧)冰上化解后称重,按5 mL:1 g组织加入2N 乙酸(即:5.88 mL 乙酸加44.12 mL 配置成50 mL 溶液)充分匀浆,90℃加热10 min,1 500g离心10 min,转移上清至新管,负压离心空干上清后获得沉于管底的固态颗粒,等乙酸体积的EIA 缓冲液重悬溶解,根据我们既往经验,重悬液按1∶50 稀释成200 μL备用。检测前每孔加入300 μL 漂洗液,倒扣空干,反复漂洗5次封闭非特异性抗原表位。每排第1 孔做空白孔(Blank),第2 孔加100 μL EIA 缓冲液阴性对照,第3和4 孔依次滴加8个标准样品(100 μL),2个重复测定标准曲线,其余4 孔滴加稀释好的100 μL上述4组样品,每个样品3个重复;随后每孔加入100 μL anti-CGRP AchE 标记物,塑封后4℃孵育16 h。孵育结束,倒置空干,300 μL漂洗液震荡2 min 漂洗3次后,每孔加入200 μL Ellman′s 显色试剂,铝箔纸避光,震荡45 min,设置波长为405 nm的自动化酶标仪(美国Bio-Tek 公司)读取吸光度。数据分析:各组吸光度值减去空白孔均值,根据8 点标准曲线计算各样品CGRP 浓度,将所有组校正到WT-NS组,以倍数表达比较组间差异。
1.6 统计学方法数据分析采用SigmaPlot 12.0 统计软件进行分析,计量资料以均数±标准差表示,多重比较采用单因素方差分析,组内比较采用Tukey 法检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 4组小鼠患侧PWF的比较CFA注射后2 h、1、3、7和14 d,4组小鼠患侧PWF 比较差异有统计学意义(F= 268.093,P<0.001)。与注射生理盐水的WT 小鼠组比较,注射CFA的WT 小鼠患侧PWF 增加,差异有统计学意义(P<0.05),而与注射CFA的KO 小鼠患侧相比,差异无统计学意义(P>0.05,图2)。表明MBD1 缺失显著缓解CFA诱导的机械痛觉过敏。

图2 4组小鼠患侧PWF的比较(n=7)Fig.2 Comparation of hind paw withdrawal frequency of ipsilateral sides in vehicle and CFA treated wildtype or Mbd1-/-mice at before 1 day,2 hours,1 day,3 days,7 days and 14 days after CFA injection(n=7)
2.2 4组小鼠对侧PWF的比较CFA注射前(-1 d)以及注射后2 h、1、3、7和14 d,4组小鼠对侧PWF 比较差异有统计学意义(F= 191.525,P<0.001)。与注射生理盐水的WT 小鼠对侧后爪比较,注射CFA的WT 小鼠对侧后爪PWF 无明显变化,差异无统计学意义(P>0.05),而与注射生理盐水和CFA的KO 小鼠对侧后爪相比,差异有统计学意义(P<0.05,图3)。表明MBD1 缺失可提高小鼠对机械刺激的基础痛阈。
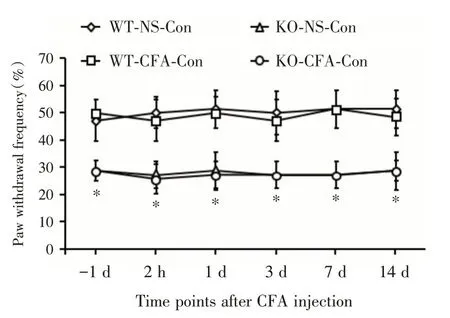
图3 4组小鼠对侧PWF的比较(n=7)Fig.3 Comparation of hind paw withdrawal frequency of contralateral sides in vehicle and CFA treated wildtype or Mbd1-/-mice at before 1 day,2 hours,1 day,3 days,7 days and 14 days after CFA injection(n=7)
2.3 4组小鼠患侧PWL的比较CFA注射后2 h、1、3、7和14 d,4组小鼠患侧PWL 比较差异有统计学意义(F= 797.954,P<0.001)。与注射生理盐水的WT 小鼠组比较,WT 小鼠在CFA注射后2 h、1、3、7和14 d的PWL 明显降低,差异有统计学意义(P<0.05),而与注射CFA的KO 小鼠患侧相比,仅在CFA注射后1 d 有差异(P<0.05),其余差异无统计学意义(P>0.05,图4),表明MBD1 缺失可缓解CFA注射侧后爪引起的热痛觉过敏。
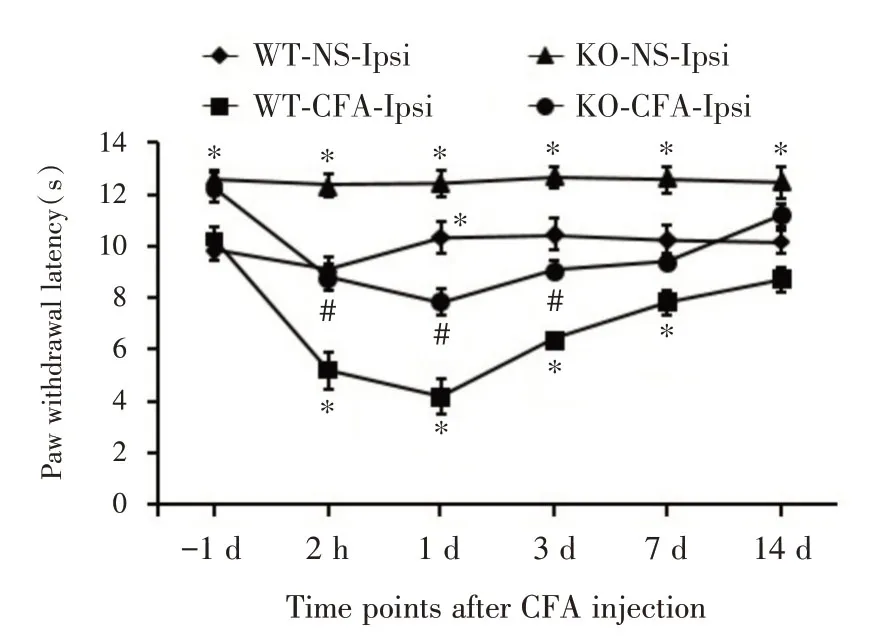
图4 4组小鼠患侧PWL的比较(n=7)Fig.4 Comparation of hind paw withdrawal latency of ipsilateral sides in vehicle and CFA treated wildtype or Mbd1-/-mice at before 1 day,2 hours,1 day,3 days,7 days and 14 days after CFA injection(n=7)
2.4 4组小鼠对侧PWL的比较在CFA注射前(-1 d)以及注射后2 h、1、3、7和14 d的时间点,4组小鼠对侧PWF 比较差异有统计学意义(F=290.491,P<0.001)。与注射生理盐水的WT 小鼠对侧后爪比较,注射CFA的WT 小鼠对侧后爪PWF 无明显差异(P>0.05),而与注射生理盐水和CFA的KO 小鼠对侧后爪相比,差异有统计学意义(P<0.05,图5)。表明MBD1 缺失小鼠可更好的耐受热伤害性刺激。
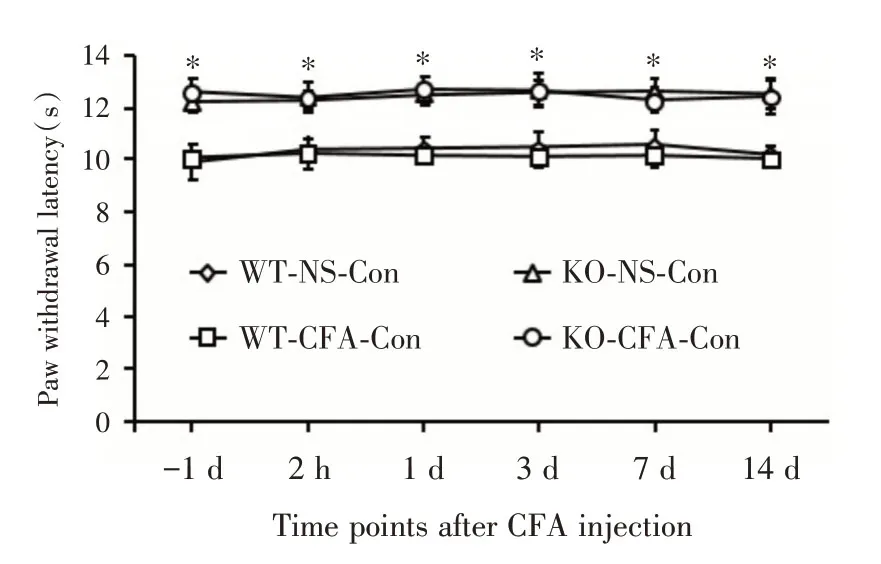
图5 4组小鼠对侧PWF的比较(n=7)Fig.5 Comparation of hind paw withdrawal latency of contralateral sides in vehicle and CFA treated wildtype or Mbd1-/-mice at before 1 day,2 hours,1 day,3 days,7 days and 14 days after CFA injection(n=7)
2.5 4组小鼠患侧DRG内CGRP 含量的比较CFA注射后1 d,4组小鼠患侧L3/4 DRG 内CGRP含量比较差异有统计学意义(F= 64.384,P<0.001)。与注射生理盐水的WT 小鼠组比较,WT小鼠DRG 内CGRP 显著增加,差异有统计学意义(P<0.05),注射生理盐水的KO 小鼠DRG 内CGRP 显著降低,差异有统计学意义(P<0.05),而注射CFA的KO 小鼠DRG 内CGRP 无明显变 化(P>0.05,图6),表明MBD1 缺失可抑制CFA 引起的DRG 内CGRP 含量增加。
2.6 4组小鼠患侧脊髓背角内CGRP含量的比较 CFA注射后1 d,4组小鼠患侧腰膨大处脊髓背角内CGRP 含量变化差异有统计学意义(F=19.019,P<0.001)。与注射生理盐水的WT 小鼠组比较,WT 小鼠脊髓背角内CGRP 含量显著增加,差异有统计学意义(P<0.05),注射生理盐水的KO 小鼠脊髓背角内CGRP 显著降低,差异有统计学意义(P<0.05),而注射CFA的KO 小鼠脊髓背角内CGRP 无明显变化(P>0.05,图7),表明MBD1 缺失可抑制CFA 引起的脊髓背角内CGRP含量增加。
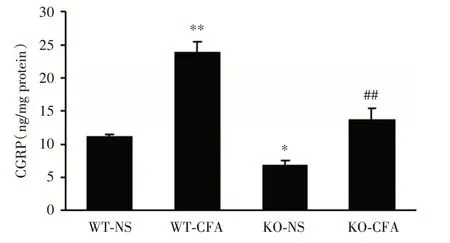
图6 4组小鼠患侧DRG 内CGRP 含量的比较(n=3)Fig.6 Comparation of CGRP content of L3/4 ipsilateral sides of dorsal root ganglia in four group mice at 1 day after CFA injection(n=3)
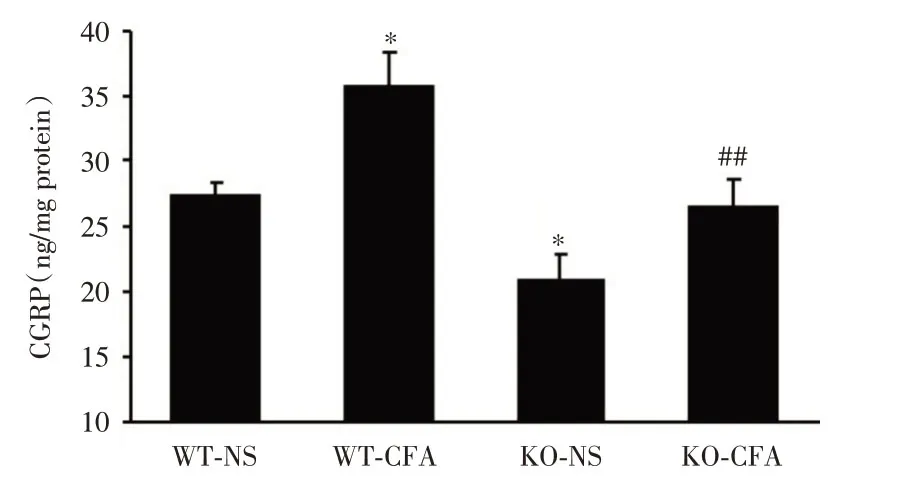
图7 4组小鼠患侧脊髓背角内CGRP 含量的比较(n=3)Fig.7 Comparation of CGRP content of L3/4 ipsilateral sides of spinal dorsal horn in four group mice at 1 day after CFA injection(n=3)
3 讨论
伤害性疼痛是维持机体完整所必需的重要组成部分,是抵御外界侵扰和适应环境重要神经活动[16]。在有/无外界伤害性刺激下,炎症性疼痛即可引起机械和热刺激痛觉过敏,部分原因是炎症引起炎症介质释放导致神经传导通路中的DRG和脊髓背角区神经肽CGRP 生成和释放增加导致中枢敏化[17-18]。本研究结果显示,MBD1 缺失小鼠缓解CFA 诱导的炎性疼痛引起机械和热刺激痛觉过敏,可能是通过抑制DRG和脊髓背角区神经肽CGRP 生成和释放来实现,表明MBD1是调控慢性炎性疼痛重要的关键因子。
慢性疼痛的形成被认为是由炎症、组织损伤和/或神经损伤引起DRG、脊髓背角和疼痛相关的脑区感觉神经元基因表达的变化引起[19]。CGRP作为疼痛因子参与炎性、躯体性、内脏性和神经性等多种慢性疼痛的过程,其表达亦受包括表观遗传机制在内的多种因子调控[20-21]。越来越多的研究表明,CGRP 在外周神经元、脊髓背角上调,促进伤害性信号传播,介导外周敏化加剧炎症和神经性疼痛中起着关键作用[22-23]。抑制其表达对缓解慢性疼痛的产生和维持至关重要。表观遗传修饰是控制基因表达的重要方式,参与了慢性疼痛的发生和持续过程[24]。DNA 甲基化作为表观遗传修饰控制基因表达的重要方式之一,可通过多种机制抑制基因转录,包括甲基-CpG结合域蛋白(MBD)家族作为转录抑制因子或共抑制因子结合到启动子区CpG 岛抑制转录活动[6,25]。本研究发现,对甲基化结合域蛋白MBD1 进行小鼠敲除,可以有效缓解小鼠CFA注射后14 d 内的炎性疼痛行为。进一步通过选取疼痛最明显的时点(CFA注射后1 d)取材检测,进一步发现MBD1 敲除可降低DRG和脊髓背角区域神经肽CGRP 总水平,进而抑制CFA 炎性诱导引起的CGRP 生成和释放增加。另外,本课题组发现DRG 神经元细胞核内的MBD1 蛋白与CGRP 标记物共表达于同一个DRG小神经元内[8]。上述研究结果表明,MBD1 敲除缓解慢性炎性疼痛可能是通过下调DRG和脊髓背角神经肽CGRP的生成与释放来实现。然而,本研究仍然不清楚MBD1 敲除具体影响到哪种神经细胞CGRP的分泌和释放,笔者将在以后的实验中使用离体原代细胞去进一步验证。
综上所述,小鼠DRG和脊髓背角区域内神经肽CGRP 表达上调参与了CFA 诱导的慢性炎性疼痛形成;MBD1 敲除可缓解CFA 诱导的机械和热刺激痛觉过敏,机制可能与抑制DRG和脊髓背角内CGRP 生成和释放有关。
