pH敏感型复合水凝胶的设计与药物缓控释评价
2020-04-18胡燕胡升吉木色张尚文王欣雅康丽
胡燕,胡升,吉木色,张尚文,王欣雅,康丽
(中南民族大学 药学院,武汉 430074)
目前,水凝胶作为一种新型药物输送载体,因其优良性质而具有广阔的应用前景.智能水凝胶能对pH[1]、温度[2]、电场[3]、超声[4]和光[5]等条件刺激做出应答,其作为药物载体优势更加明显.生物药物在胃肠道中具有不稳定、半衰期短、低渗透性等缺点[6],而采用水凝胶作为生物类药物载体是一种有效克服方法[7-9].戊二醛作为明胶交联剂具有细胞毒性[10],但氧化多糖类可用于蛋白质类天然高分子材料的交联[11].因此,本实验以海藻酸钠和明胶为原料,用氧化海藻酸钠与氯化钙为交联剂,制备了优良性能的复合水凝胶,并探讨了该体系性能、对蛋白质类药物的缓控释效果及释药机制.
1 实验部分
1.1 材料与仪器
海藻酸钠(AR,上海阿拉丁);壳聚糖(食用级,Mw=1×105,浙江金壳生化);明胶(药用级,上海阿拉丁);浓盐酸(AR,信阳市化学试剂);牛血清白蛋白、考马斯亮蓝(AR,Sigma);其他试剂均为国药集团化学试剂有限公司AR级.
CP214电子天平(梅特勒-托利多);冷冻干燥机(北京博医康);恒温磁力搅拌器(巩义市予华);傅里叶红外光谱仪(IR,Nicolet 6700,赛默飞世尔);X-射线衍射仪(XRD,Bruker advance D8型,德国布鲁克AXS).
1.2 水凝胶的制备
1.2.1 氧化海藻酸钠(OSA)的制备
取适量乙醇和蒸馏水,在搅拌下加入海藻酸钠(SA),搅拌10 min后加入高碘酸钠,室温下避光搅拌,控制氧化时间,加乙二醇终止反应[12,13].再用纯化水透析后抽滤、浓缩、冷冻干燥即得(反应方程式见图1).
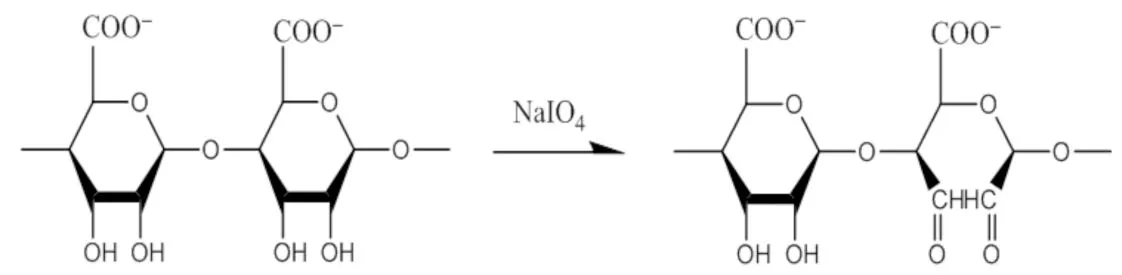
图1 氧化海藻酸钠反应方程式Fig.1 Chemical equation of OSA
1.2.2 复合水凝胶的制备
取一定量上述制备好的OSA溶解.称量适量明胶(Ge)分散于溶有OSA的蒸馏水中,后于40℃水浴搅拌至完全溶解并交联.SA溶液与OSA交联的Ge溶液混合均匀,抽气,用滴制法与钙离子交联,再用2%CS包膜,纯化水冲洗后自然风干得复合水凝胶(CH),制备流程见图2.
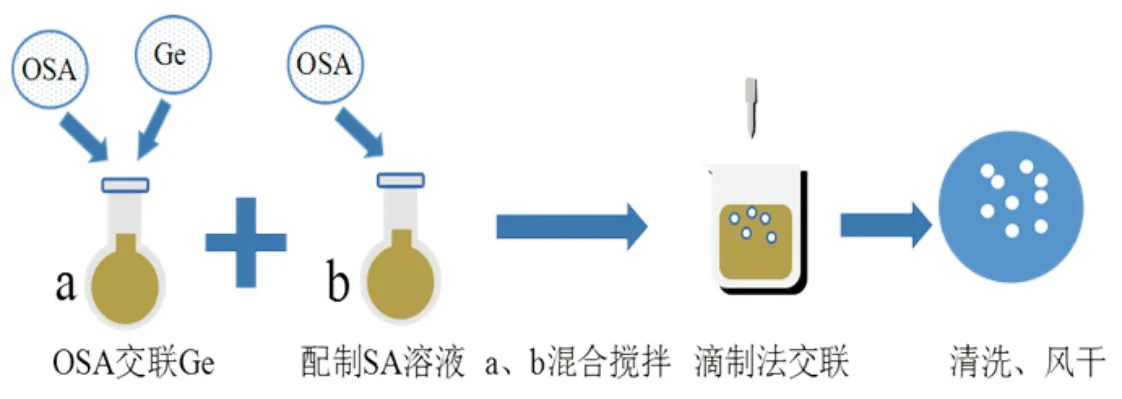
图2 复合水凝胶制备示意图Fig.2 Schematic diagram of preparation of composite hydrogel
1.3 OSA交联Ge/SA 复合水凝胶的表征
1.3.1 水凝胶的形貌
拍摄水凝胶新制备、风干后及溶胀后的外部形态,并用扫描电镜观察其内部结构.
1.3.2 红外光谱分析(IR)
将SA、OSA及SA/Ge复合水凝胶冻干样品按一定比例与溴化钾粉末混合压片后测试.
1.3.3 热重分析(TGA)
运用TGA对SA、Ge、OSA及复合水凝胶冻干样品进行检测.温度范围:40~600 ℃,升温速率为10 ℃/min.
1.3.4 X射线分析(XRD)
运用X射线分析仪对海藻酸钠、明胶、氧化海藻酸钠以及复合水凝胶样品进行检测.测试条件:管压40 kV,扫描速度1 °·min-1,衍射角范围4°~40°.
1.3.5 溶胀性能测试
称适量风干水凝胶样品,前2 h在模拟胃液(pH=1.2)中溶胀,再在模拟肠液(pH=7.4)中,直至溶胀平衡.每30 min称重并记录,用下式计算溶胀率:
SR=[(mt-m0)/m0],
式中:SR为水凝胶的溶胀率;mt为凝胶在模拟液溶胀t时的质量,g;m0为凝胶的初始质量,g.
1.4 释药实验
采用直接包埋法制备载牛血清白蛋白(BSA)水凝胶,风干备用.称若干份风干样品置入锥形瓶中并记录样品质量.加入模拟胃肠液,水浴恒温振荡测试.每隔30 min取样,再补充同体积的模拟液,同法进行其它条件测试.
将取样液用考马斯亮蓝染液染色,在595 nm波长下检测并记录.根据标准曲线计算浓度,按下式计算BSA的累积释药率:
Qn=[(V0ρn+V∑ρn-1/W]×100% ,
式中:ρn为第n次取样中BSA质量浓度;V为取样量;V0为初始体积;W为载药量.
1.5 释药机制
利用复合水凝胶在模拟胃肠液释放BSA的释药数据,进行零级方程、一级方程、Higuchi方程和Ritger-peppas方程拟合.
(1)零级动力学模型:Mt/M∞=k0t,
(2)一级动力学模型:ln(1-Mt/M∞) =-k1t,
(3)Higuchi方程:Mt/M∞=kHt1/2,
(4)Ritger-peppas方程:Mt/M∞=ktn,
式中:Mt为t时间内的累积释放量;M∞为理论上最大的释放量;Mt/M∞为累积释药率;k、k0、k1、kH为速率常数;n为特征参数.
2 结果与讨论
2.1 复合水凝胶的表征结果
2.1.1 水凝胶的形貌表征
图3水凝胶的外部形貌.图3a是刚制备的水凝胶,呈类白色的球状,直径约为4 mm;图3b是风干后的水凝胶,明显收缩,直径约为2 mm,为黄色;图3c是溶胀8 h时的水凝胶,膨胀明显,呈透明状.

图3 复合水凝胶外部形貌Fig.3 External morphology of composite hydrogel
图4a、4b为同一样品用扫描电镜拍摄的水凝胶三维结构,内部为多孔层状,利于载药及吸水溶胀释放药物.

图4 复合水凝胶的扫描电镜图(×100)Fig.4 SEM images of composite hydrogel(×100)
2.1.2 红外光谱分析
图5为复合水凝胶的红外谱图.由图5可见:OSA在1735 cm-1呈现新的吸收峰,为―CHO的伸缩振动,表明SA发生了氧化反应;该峰在SA/Ge复合水凝胶图谱中消失,表明OSA与明胶发生了交联.

图5 复合水凝胶的红外图谱图Fig.5 Infrared spectra of composite hydrogel
根据制备过程以及红外光谱的分析,推测SA/Ge复合水凝胶的交联机理如图6所示.
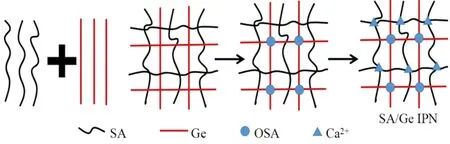
图6 复合水凝胶的交联机理Fig.6 Crosslinking mechanism of composite hydrogel
2.1.3 热重分析
复合水凝胶的热重分析图见图7.结合图7a,SA和Ge在200~250 ℃较快失重;复合水凝胶在250~300 ℃缓慢失重,说明交联后的水凝胶热稳定有所提高.图7b表明复合水凝胶在两个阶段出现热分解,分别50~250 ℃与300~400 ℃.低温失重是由于复合水凝胶吸附水的损失;高温失重是体系中化学键的断裂,海藻酸钠中相邻的羟基结合脱水,明胶降解.
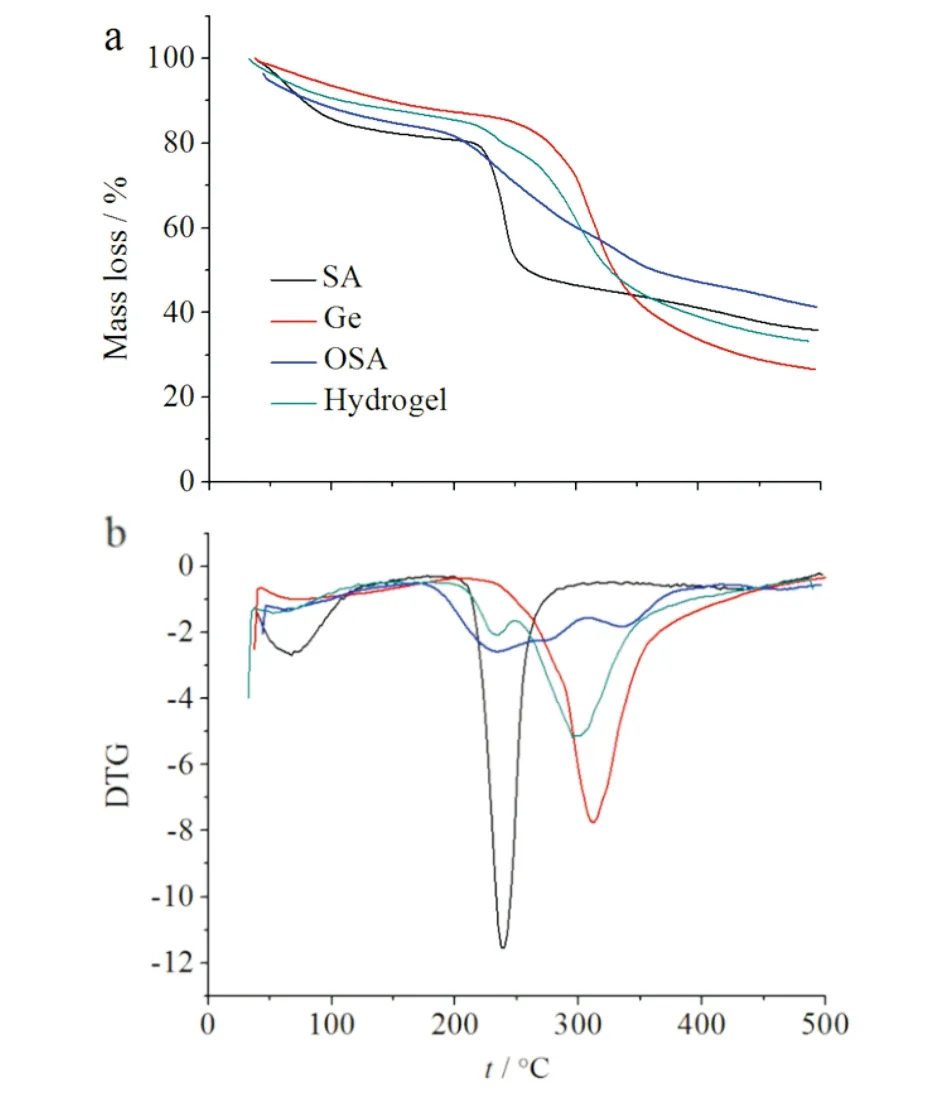
a) TAG曲线; b) TAG曲线的一阶导数图7 复合水凝胶的热重分析图Fig.7 TAG curve of composite hydrogel
2.1.4 X射线衍射分析
复合水凝胶的X射线衍射分析图谱见图8.由图8可见:SA在14°和23°处有两个尖锐的衍射峰,Ge在20°处有衍射峰;CS在19.5°处有尖锐的衍射峰,但是复合水凝胶未出现较强的衍射峰,说明该体系发生物理化学交联后,原料由晶体结构变为无定型结构.

图8 复合水凝胶的X射线衍射分析图谱Fig.8 XRD spectrogram of composite hydrogel
2.1.5 溶胀性能
在模拟体液中,进行SA/Ge复合水凝胶的溶胀性能测试. 图9a是不同氧化时间的OSA作为交联剂的溶胀曲线图.图中随着氧化时间增加,OSA的氧化程度越高,与明胶交联强度越好,体系越稳定则溶胀率越大,选择氧化时间为6 h的OSA进行下步的研究.图9b中是不同OSA浓度复合水凝胶的溶胀曲线. 图中复合水凝胶溶胀时间在10 h以上并能维持约30 h,因为体系中有化学交联和物理交联,使体系稳定;复合水凝胶溶胀率在pH 1.2中维持在5左右,而在pH 7.4中体系溶胀逐渐增大,最高的溶胀率可达约36.因为在SGF中,H+使得体系表面带有正电荷使--COOH以分子形式存在,分子间排斥力小,而在pH 7.4中,OH-使―COOH解离,分子间排斥力增加,吸水溶胀.当OSA加入量小于0.3%时随OSA浓度增加溶胀率升高;OSA浓度继续增加则交联密度大,溶胀率降低.

a)不同氧化时间;b) 不同交联剂浓度图9 复合水凝胶的溶胀曲线Fig.9 Swelling curves of composite hydrogel
2.2 体外释药测试
选择牛血清白蛋白(BSA)作为体外释药的模型药物, 载药复合水凝胶在不同模拟液下释放BSA模型药物结果见图10. 图10a表示在SBF中缓释效果较好,10 h药物释放率低于60%,随着OSA浓度的增加,缓释效果更好.图10b表示在SIF中释放呈缓慢释放的趋势,体系开始溶胀,释药率约为20%,然后缓慢释放.不同浓度的OSA,后期释药不同,因为高浓度的OSA使交联紧密,网络体系瓦解慢,缓释作用好.图10c表示在SGF中释放药物率整体较低,0.5 h内由于表面药物的释放,释药率约10%,因为在模拟胃液中的溶胀率较低使释药非常缓慢.

a)模拟体液;b)模拟肠液;c)模拟胃液图10 不同pH条件下释放BSA模型药物Fig.10 Cumulative release curve of BSA in different pH condition
2.3 复合水凝胶释药机制研究
根据复合水凝胶在模拟胃液、模拟肠液的释药数据进行拟合. 根据表1和表2拟合的结果,参考相关系数R,Higuchi方程中R的相关度较高,n值均在0.45~0.89之间,所以其释药机制属于骨架型扩散机制释放[14,15].

表1 复合水凝胶释药机制拟合结果Tab.1 Drug release mechanism fitting results of composite hydrogel
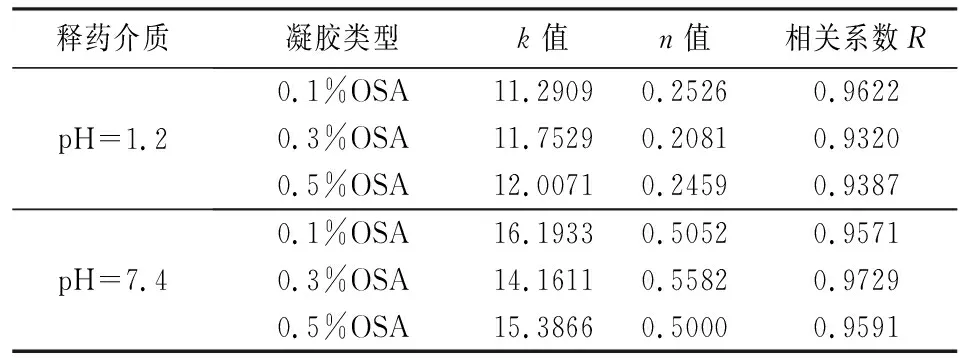
表2 复合水凝胶释药机制拟合结果(Ritger-peppas拟合)Tab.2 Drug release mechanism fitting results of composite hydrogel(Ritger-peppas fitting)
3 结论
本文以海藻酸钠和明胶为原料,采用温和的方法以OSA替代戊二醛作为明胶的交联剂,得到一种基于天然材料的pH敏感性水凝胶.该复合水凝胶的溶胀率随着OSA氧化时间的延长呈现线性增大的趋势,随着OSA浓度的增大先增大后减小,溶胀特性好且溶胀率约为36.体系稳定性好,溶胀时间较长,可达到约30 h.在释药实验中,该体系对蛋白质类药物BSA表现出缓释效果,属于骨架型扩散机制释放.此类SA/Ge(OSA交联)复合水凝胶有望作为一种新型的大分子药物缓控释载体.
