大肠杆菌对链状弯壳藻生长特性的影响
2020-04-18万年新王涛易志勇裴国凤
万年新,王涛,易志勇,裴国凤*
(1 山东省调水工程运行维护中心 棘洪滩水库管理站,青岛 266111;2 中南民族大学 生命科学学院,武汉 430074)
硅藻水华的暴发给水生态系统带来危害,学者们对引起水华的硅藻生物学研究越来越多[1].链状弯壳藻(Achnanthidiumcatenatum)属于弯壳藻属,是该属硅藻中极为特殊的一种藻类.弯壳藻属中绝大多数硅藻以附着方式生长,而只有链状弯壳藻是唯一一种既能浮游生长又能附着生长,既可以单细胞形式存在、也可以多细胞链状群体形式存在的硅藻,有研究表明链状弯壳藻单体细胞转变为群体细胞时有利于其浮游生长,而由于该藻本身的浮游特性,它也是目前弯壳藻类中唯一一种可以形成水华的硅藻[2].近十几年来,在世界各地淡水湖泊以及饮用水库中均发现了链状弯壳藻水华[3],影响了工业用水和城市居民的日常生活用水.本课题组在棘洪滩水库也发现了弯链状壳藻的存在,并在少数年度(2005年)的春季形成微弱优势.
在淡水生态系统中,硅藻水华暴发的原因是由生物因素与非生物因素共同作用,温度、光照、营养源是非生物因素中的主要影响因子[4],细菌的存在是硅藻生长环境中不容忽视的生物影响因子,两者之间的关系主要表现在相互促进和相互抑制,且与胞外多聚物的分泌也有密切关系[5].而大肠杆菌作为自然界中常见的异养细菌广泛存在于江河、湖泊等水体中,它不仅是一种环境指示菌,也是一种影响水生生物生长繁殖的细菌[6],亦或是影响链状弯壳藻生长特性的重要生物因子.
硅藻在生长过程中会分泌一类粘性物质,称之为胞外多聚物,一般包括多糖、酶类等物质,其中胞外多糖是最重要的组成部分[7],这些物质的功能主要表现在附着性、运动、稳定环境等方面[8].胞外多聚物的产生使固着型生长硅藻的附着结构更加有柔韧性,牢固地附着在基质上,避免被浮游动物捕食或被较快的水流冲走,它在硅藻由单细胞形成多细胞群体的过程中也起着重要作用[9].近几年国内不同地方的水库和湖泊,相继出现有关链状弯壳藻水华的报道,故有必要研究环境因素对链状弯壳藻生长的影响.本研究以浙江宁波东钱湖采集纯化的链状弯壳藻藻株为实验对象,测定链状弯壳藻与细菌共培养时的生物量、单体和多细胞链状群体的比例和胞外多糖含量的变化,进而探究细菌的存在对链状弯壳藻生长特性的影响,以期在链状弯壳藻水华预警与防治方面提供科学依据.
1 材料与方法
1.1 实验材料
藻种为羽纹纲弯壳藻属硅藻链状弯壳藻,由浙江宁波东钱湖分离纯化的藻株.采用DV培养基培养[10],温度(23±1)℃,光照强度3500 lux,光暗时间比12h/12h.每天定时人工摇动2~3次.实验菌种为大肠杆菌E.coli,购自中国普通微生物菌种保藏管理中心(China General Microbiological Culture Collection Center, CGMCC).
1.2 大肠杆菌液的制备
取活化的对数生长期大肠杆菌至50 mL LB液体培养基,37 ℃恒温摇床进行培养(200 r·min-1),取处于对数生长期的大肠杆菌菌液作为实验用菌液.
1.3 链状弯壳藻和细菌共培养
在相同体积和浓度的链状弯壳藻培养液中,分别加入不同量的大肠杆菌菌液,依据菌液加入体积占培养液总体积的比例不同,实验设置5个梯度,分别是0%、0.2%、0.5%、1%、 2%,每个处理组3个重复,设置培养条件为:培养温度(23±1)℃,光照强度3500 lux,光暗时间比12h/12h.每天定时人工摇动2~3次,实验周期为12 d.
1.4 藻细胞密度方法测定
将藻液摇匀后取0.1 mL于浮游植物计数框中,在显微镜下随机选取25个视野,分别对链状弯壳藻的总细胞、单体、群体细胞记数.比例计算方法:单体或群体细胞密度/总细胞密度.
1.5 胞外多糖含量的测定
取5 mL培养液于离心管中.在12000 r·min-14 ℃条件下离心10 min.用5 mL去离子水悬浮沉淀,60 ℃水浴30 min后,离心10 min.取上清即为胶体胞外多糖(colloid exopolysaccharides, CEPS),用苯酚硫酸法测胞外多糖的含量[11].
1.6 数据处理
用SPSS19.0对试验数据进行单因素方差分析(one-way ANOVA);用EXCEL 2007进行作图.
2 结果
2.1 大肠杆菌对链状弯壳藻生物量的影响
用不同浓度的大肠杆菌菌液处理后,链状弯壳藻生长受到明显抑制,且随菌液浓度的提高,链状弯壳藻的生长受到的抑制越明显.当对照组的细胞密度峰值达到3.46×106个·mL-1时,1%浓度菌液处理组的细胞密度峰值为2.07×106个·mL-1(图1),是对照组同期的59.83%,而2%浓度条件下的链状弯壳藻的细胞密度从第4 d开始呈现负增长,并在第6 d时,细胞密度为0 个·mL-1,说明2%的菌液对链状弯壳藻的生长具有强烈的抑制作用.与对照组相比,0.2%、0.5%、1.0%、2.0%处理组的链状弯壳藻细胞密度均有显著性减少(P<0.05),表明大肠杆菌能够抑制链状弯壳藻的生长.而各处理组大肠杆菌浓度均在第4 d达到峰值,随后开始下降并持续至实验末期,表明链状弯壳藻的生长同样会影响大肠杆菌的生长繁殖.
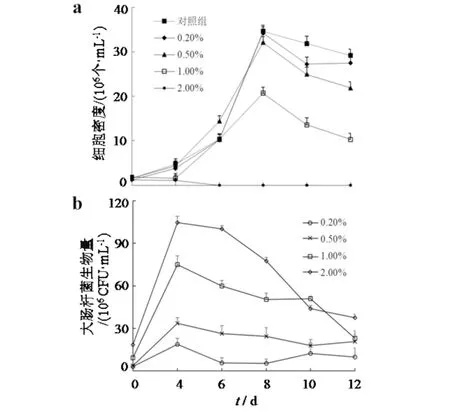
a)链状弯壳藻总细胞密度的变化;b)大肠杆菌生物量的变化图1 不同浓度的大肠杆菌对链状弯壳藻生长的影响Fig.1 Effects of different amounts ofE. coli on the growth of A.catenatum
2.2 大肠杆菌对链状弯壳藻形成多细胞群体的影响
链状弯壳藻单体与多细胞群体的细胞密度测定结果显示处理组的单体生长均受到明显的抑制作用(P<0.05),而浓度为0.2%、0.5%、1.0%处理组的多细胞群体的生长具有明显的促进作用(P<0.05).其中,在0.5%处理组中,链状弯壳藻的单体细胞密度变化趋势与对照相似(图2a);1.0%处理组中,链状弯壳藻的单体细胞密度在第6 d达到生长峰值,而多细胞群体在第8 d达到峰值,与对照相比,多细胞群体的细胞密度具有显著性的提高(P<0.05),多细胞群体的细胞密度最高可达7.55×105个·mL-1,是同时期对照组的312.9%(图2b).这些结果表明适当浓度的大肠杆菌与链状弯壳藻共培养,能使链状弯壳藻单体、多细胞群体提前达到生长峰值,促进链状弯壳藻多细胞群体的生长.
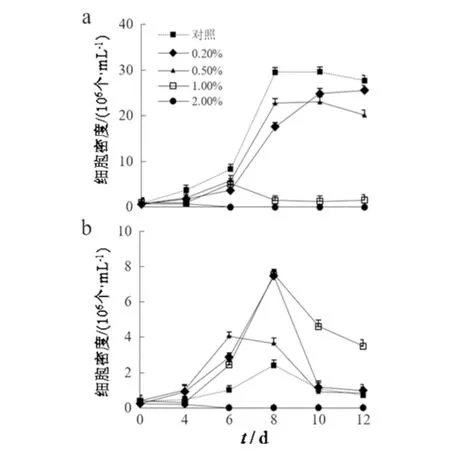
图2 链状弯壳藻单细胞(a)和多细胞群体(b)细胞密度的变化Fig.2 Changes of cell density in single(a)and multicellular population (b)of A.catenatum
其他条件不变,只改变大肠杆菌菌悬液的添加量时,发现对照组中的多细胞群体细胞密度随培养时间的延长而逐渐减少,处理组中的群体细胞密度呈先增加,后减少的变化趋势(图3).处理组与对照组中群体细胞密度百分比的显著性分析显示:0.2%和0.5%处理组的多细胞群体细胞密度从第4 d开始增长,并在第6 d达到峰值,此时的多细胞群体分别占各自总细胞密度的44.06%、67.61%,与对照相比均具有明显的增加(P<0.05);1%处理组的多细胞群体的细胞密度在第8 d达到5.11×105个·mL-1,是单体细胞密度的5.35 倍.由此表明大肠杆菌对链状弯壳藻单体、多细胞群体的生长有显著影响,对多细胞群体的形成有促进作用.
用印度墨水对链状弯壳藻进行负染色后,单体和多细胞群体外均包裹有层次固定、层次较厚、无色透明的胞外多聚物(图4).在实验前期,大多数链状弯壳藻以单细胞状态存在,随着培养时间的延长,培养液中的链状弯壳藻形成2~6个细胞的链状多细胞群体.
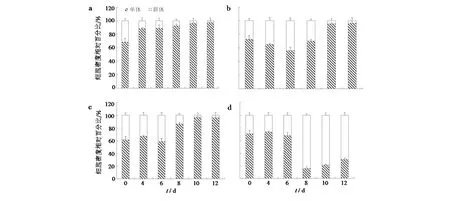
a)空白对照;b、c、d)分别添加了0.2%、0.5%、1.0%浓度大肠杆菌菌液图3 链状弯壳藻单细胞和多细胞群体的细胞密度相对百分比Fig.3 Relative percentage of cell density in single-cell and multicellular populations of A. catenatum
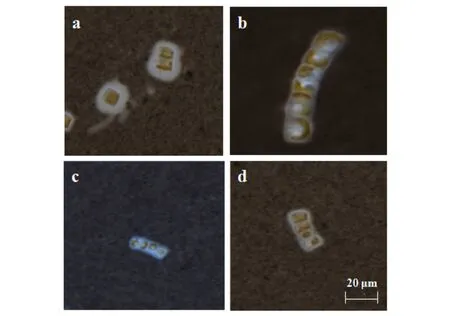
a) 链状弯壳藻的单个细胞或2个多细胞群体;b~d) 4、5个链状弯壳藻单细胞聚集在一起形成的链状多细胞群体图4 链状弯壳藻经印度墨水负染色的胞外多聚物及链状多细胞群体Fig.4 Extracellular polymers of A. catenatum negatively stainedby Indian ink and chain multicellular colony
2.3 大肠杆菌对链状弯壳藻形成胞外多糖的影响
实验测定了各组不同培养时期的胞外多糖含量,发现链状弯壳藻多细胞群体细胞密度峰值时期的胞外多糖含量可达15.51 μg·mL-1,是对照组同期胞外多糖含量的2.33 倍,实验期间的胞外多糖含量平均可达14.77 μg·mL-1,是对照组的2.09倍;1%浓度处理组的胞外多糖含量平均最高(图5);单因素方差分析显示,与对照组相比,各浓度处理组的胞外多糖含量均有显著性的增加(P<0.05),说明大肠杆菌的存在对链状弯壳藻胞外多糖的形成具有显著的促进作用.
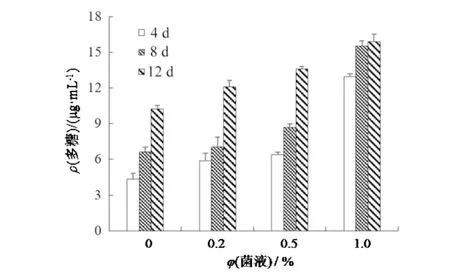
图5 不同添加量的大肠杆菌对链状弯壳藻胞外多糖含量的影响Fig.5 Effects of different additions of E. coli on extracellularpolysaccharide content of A. catenatum
3 讨论
3.1 共培养对链状弯壳藻生长及其成群的影响
在天然水体中,细菌与藻类之间存在共生、拮抗、竞争等复杂的关系[12].本文结果表明大肠杆菌与链状弯壳藻共培养时,大肠杆菌对链状弯壳藻的生长有抑制作用.同一环境中一种生物被另一种生物所影响是多种机制共同作用的结果,链状弯壳藻的生长被抑制可能是多种机制相互耦合的结果,营养物质的竞争是其中一种重要的机制[13].因此在大肠杆菌与链状弯壳藻共培养体系中,培养基中营养成分固定时,随着菌液添加量的增加,藻类细胞生长所受的抑制作用越强;而单独添加大肠杆菌菌液到DV培养基中进行培养时,发现大肠杆菌能够在DV培养基中生长,因此推测链状弯壳藻细胞生长受到抑制可能是由于大肠杆菌与链状弯壳藻竞争营养源所导致.
3.2 链状弯壳藻胞外多糖的分泌对多细胞群体形成的影响
在添加大肠杆菌的条件下,处理组中形成的群体细胞明显增多,较多的链状弯壳藻细胞聚集在一起形成群体.说明培养基中的单细胞表面黏性增强,单细胞表面与粘性有关的胞外多糖分泌可能增多.本文通过实验测定对照组与处理组中的胞外多糖,证实处理组中的胞外多糖含量均高于对照组,实验结果与席藻Phormidiumautumnale胞外多糖分泌增多的机制有相似之处[14].研究表明,藻类释放的胞外多糖与细菌的生物量存在密切关系[15],本文有相似的实验结果,即随着大肠杆菌菌液浓度的增多,处理组培养基中积累的胞外多糖的含量也逐渐增加,处理组培养基中的胞外多糖含量明显高于对照组.由此可见,链状弯壳藻群体细胞的形成可能与胞外多糖的分泌量有紧密联系.总之,本文结果表明大肠杆菌对链状弯壳藻的生长有明显的抑制作用,且对其多细胞群体的形成及胞外多糖的分泌有密切关系,不同浓度细菌菌液对该硅藻生长的影响具有差异性.
