氮芳基取代靛红的合成研究
2020-04-18卞子龙孙文武吴滨
卞子龙,孙文武,吴滨
(中南民族大学 药学院,武汉 430074)
靛红是一类非常重要的氮杂环化合物,广泛存在于天然产物、药物和染料中,具有抗惊厥、抗抑郁、抗炎、抗菌、抗病毒等生物活性[1,2],同时也是宝贵的药物合成中间体,有非常好的应用前景[3-6].靛红C-3位的酮羰基具有较高的反应活性,常常作为反应活性位点引入各种取代基团,以期寻找具有药用活性潜力的化合物[7-9]. 此外,用氮芳基取代的靛红作为原料合成的吖啶类化合物作为荧光探针可以同时定量多个核酸[10].
虽然氮苯环取代的靛红衍生物的报道已有很多,但是氮上大共轭体系的取代基团的靛红类化合物鲜有报道. 鉴于靛红类衍生物在药物、染料及作为合成中间体的重要应用,本研究以靛红,芳基硼酸化合物为原料,经过Ullmann偶联反应,合成了6个含有大体系的氮取代的靛红衍生物(图1).为进一步开展这类靛红衍生物的荧光特性和生物活性的研究提供了坚实的物质基础.
1 实验部分
1.1 仪器与试剂
1H NMR和13C NMR在 Bruker Avance III 600 核磁共振仪上测定,所用氘代试剂均为 Cambrige生产,TMS 作为内标,δ单位为 ppm,J单位为 Hz. 层析用硅胶为 300~400目以及制备薄层板(厚度 0.4~0.5 mm)均为烟台江友公司生产. 靛红、芳基硼酸、醋酸铜、吡啶均购于伊诺凯公司.
1.2 实验操作
在圆底烧瓶中依次加入靛红(1.0 equiv),芳基硼酸(2.0 equiv),Cu(OAc)2(2.0 equiv),吡啶(2.0 equiv),最后加入二氯甲烷,搅拌过夜. 反应结束后,反应液用硅藻土过滤,用乙酸乙酯和石油醚作为展开剂,柱层析分离得到产物.

图1 Ullmann偶联反应合成靛红类化合物Fig.1 Synthesis of isatin compounds through the Ullmann coupling reaction
2 结果与讨论
2.1 合成的产物结构及收率
如图2和表1所示,合成了含有萘、菲、芘、芴和二苯并噻吩等大共轭体系的氮芳基取代的靛红衍生物,最高收率为63%.
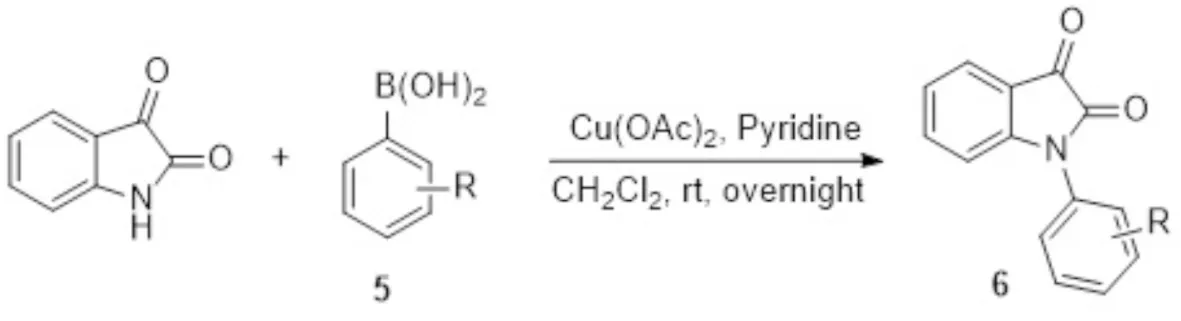
图2 Ullmann偶联反应合成靛红类化合物6Fig.2 Synthesis of isatin compounds 6 through the Ullmann coupling reaction
表1 靛红类化合物的合成
Tab.1 Synthesis of isatin compounds

编号底物产物产率/%16323232543154646
为了提高收率,采用加热,加入三乙胺,活化的分子筛的方法进行研究.但一个有趣现象是,在升温的情况下两分子的靛红会发生缩合反应. 反应方程式如图3.

图3 两分子靛红的缩合反应Fig.3 Condensation of two molecules of isatin
在表1编号 3的反应中,用DCM做展开剂,紧挨着目标化合物6c的下方出现了一个新点,经核磁氢谱确定为化合物5c被氧化生成的菲-9,10-二酮8,这很可能是造成6c产率低的原因(图4).

图4 Ullmanna反应中伴随的副反应Fig.4 Side reaction along with Ullmann reaction
2.2 化合物的表征
5,5A-dihydroindolo[2,1-b]quinazoline-6,12-dione(7):1H NMR(600 MHz, CDCl3)δ8.64(d,J=8.1 Hz, 1H), 8.45(d,J=7.9 Hz, 1H), 8.04(d,J=8.0 Hz, 1H), 7.92(d,J=7.5 Hz, 1H), 7.86(t,J=7.7 Hz, 1H), 7.80(t,J=7.8 Hz, 1H), 7.68(t,J=7.6 Hz, 1H), 7.43(t,J=7.5 Hz, 1H).以上数据与文献[11]报道一致.
Phenanthrene-9,10-dione(8):1H NMR(600 MHz, CDCl3)δ8.19(d,J=7.8 Hz, 2H), 8.02(d,J=8.0 Hz, 2H), 7.72(t,J=7.7 Hz, 2H), 7.47(t,J=7.5 Hz, 2H). 以上数据与文献[12]报道一致.
1-(4-(Naphthalen-1-yl)phenyl)Indoline-2,3-dione(6a):Yellow solid,mp 47~49C;1H NMR(600 MHz,CDCl3)δ7.94(d,J=8.5 Hz,2H),7.91(d,J=8.2 Hz,1H),7.74(d,J=8.1 Hz,1H),7.69(d,J=8.3 Hz,2H),7.60(td,J=7.9 and 1.2 Hz,1H),7.58-7.51(m,4H),7.51-7.44(m,2H),7.22(t,J=7.5 Hz,1H),7.07(d,J=8.0 Hz,1H);13C NMR(150 MHz,CDCl3)δ182.9,157.4,151.6,141.4,138.8,138.4,133.7,131.9,131.5,131.3,128.4,128.2,127.1,126.3,126.0,125.72 ,125.70,125.6,125.4,124.4,117.5,111.4; HRMS(ESI+) Calcd for C24H16NO2[M+H]+: 350.1181,Found 350.1174; IR(KBr) ν(cm-1):1738,1614,1466,1364,1180,752.
1-(Naphthalen-2-yl)Indoline-2,3-dione(6b):Yellow solid,mp 125~127C;1H NMR(600 MHz,CDCl3)δ8.03(d,J=8.6 Hz,1H),7.96- 7.86(m,3H),7.73(d,J=7.4 Hz,1H),7.63-7.53(m,3H),7.49(dd,J=8.6,2.0 Hz,1H),7.20(t,J=7.5 Hz,1H),6.95(d,J=8.0 Hz,1H);13C NMR(150 MHz,CDCl3)δ182.9,157.5,151.7,138.4,133.5,132.9,130.13,130.05,128.0,127.9,127.1,127.0,125.6,125.0,124.4,123.3,117.5,111.3; HRMS(ESI+) Calcd for C18H12NO2[M+H]+: 274.0863.1181,Found 274.0864; IR(KBr) ν(cm-1): 1726,1605,1470,1182,754.
1-(Phenanthren-9-yl)Indoline-2,3-dione(6c): Yellow solid,mp 199~201C;1H NMR(600 MHz,CDCl3)δ8.81(d,J=8.3 Hz,1H),8.76(d,J=8.3 Hz,1H),7.93(d,J=7.8 Hz,1H),7.87(s,1H),7.82-7.72(m,4H),7.67(t,J=7.9 Hz,1H),7.60(t,J=8.0 Hz,1H),7.45(td,J=7.9 and 1.3 Hz,1H),7.19(td,J=7.5,0.9 Hz,1H),6.50(d,J=8.0 Hz,1H);13C NMR(150 MHz,CDCl3)δ182.9,158.2,152.6,138.6,131.8,131.0,130.8,129.1,128.2,128.0,127.7,127.6,127.5,127.4,127.3,125.5,124.3,123.5,123.1,122.8,117.4,111.9; HRMS(ESI+) Calcd for C22H14NO2[M+H]+: 324.1025,Found 324.1025; IR(KBr) ν(cm-1): 1732,1604,1466,1364,1301,1179,758.
1-(4,5A1-dihydropyren-1-yl)Indoline-2,3-dione(6d):Yellow solid,mp 67~69C;1H NMR(600 MHz,CDCl3)δ8.34(d,J=8.0 Hz,1H),8.30(d,J=7.6 Hz,1H),8.26(d,J=7.5 Hz,1H),8.21(d,J=8.9 Hz,1H),8.14(d,J=9.1 Hz,1H),8.12(d,J=9.2 Hz,1H),8.09(t,J=7.6 Hz,1H),8.00(d,J=8.0 Hz,1H),7.91(d,J=9.1 Hz,1H),7.81(dd,J=7.6 and 0.8 Hz 1H),7.46(td,J=7.9 and 1.3 Hz,1H),7.21(t,J=7.5 Hz,1H),6.47(d,J=8.0 Hz,1H);13C NMR(150 MHz,CDCl3)δ183.1,158.3,152.8,138.6,132.2,130.9,130.7,129.3,128.8,127.7,127.0,126.7,126.3,126.1,126.0,125.7,125.6,125.5,125.2,124.34,124.32,121.4,117.6,111.8; HRMS(ESI+) Calcd for C24H14NO2[M+H]+: 348.1025,Found 348.1018; IR(KBr) ν(cm-1): 1730,1605,1466,1294,1180,843,752.
1-(9,9′-Spirobi[fluoren]-4-yl)Indoline-2,3-dione(6f): Yellow solid,mp 243~245C;1H NMR(600 MHz,CDCl3)δ8.00(d,J=8.1 Hz,1H),7.89(d,J=7.6 Hz,1H),7.82(d,J=7.5 Hz,2H),7.59(d,J=8.2 Hz,1H),7.46-7.34(m,5H),7.20-7.11(m,3H),7.07(t,J=7.6 Hz,1H),6.81-6.73(m,4H),6.58(d,J=8.0 Hz,1H);13C NMR(150 MHz,CDCl3)δ182.7,157.1,151.4,150.6,149.1,147.7,142.3,141.7,140.4,138.24,138.22,131.9,128.5,128.00,127.98,127.96,125.9,125.4,124.2,124.1,123.9,121.3,121.2,120.3,120.1,117.3,111.1,65.9.HRMS(ESI+) Calcd for C33H19NO2Na[M+Na]+: 484.1313,Found 484.1307; IR(KBr) ν(cm-1):1744,1614,1468,1362,760,729.
1-(Dibenzo[b,d]thiophen-4-yl)indoline-2,3-dione(6e):Brown solid,mp 199~203C;1H NMR(600 MHz,DMSO-d6)δ8.56(d,J=7.9 Hz,1H),8.51-8.46(m,1H),8.08-8.00(m,1H),7.75(t,J=7.6 Hz,2H),7.69(d,J=7.6 Hz,1H),7.61-7.54(m,3H),7.23(t,J=7.5 Hz,1H),6.61(d,J=8.0 Hz,1H);13C NMR(150 MHz,DMSO-d6)δ182.2,157.3,150.0,138.2,138.1,137.4,136.7,135.0,128.2,127.8,126.5,126.2,125.2,125.0,124.0,123.2,122.9,122.6,118.0,111.5; HRMS(ESI+) Calcd for C20H12NO2S[M+H]+: 330.0589,Found 330.0582; IR(KBr) ν(cm-1): 1738,1611,1464,1364,1300,1159,758.
3 结语
以靛红、芳基硼酸为原料,经过Ullmann反应,在靛红的氮上引入大共轭体系的基团,成功合成了具有大体系的氮芳基取代的靛红类化合物. 所合成的产物结构通过核磁共振氢谱、碳谱、红外光谱、高分辨质谱进行表征确认. 这些靛红类化合物具有较大的-共轭体系,能极大增强化合物的发光能力,接下来需要进一步研究和检测这些化合物的光学性质,计算出量子产率,考察它们的荧光性能,为深入研究靛红类荧光探针打下坚实的物质基础.
