利用CRISPR/Cas9技术构建GLUT4基因敲减的A549细胞系
2020-04-18赵平刘佳张颖
赵平, 刘佳, 张颖
(中南民族大学 生命科学学院,医学生物研究所,武陵山区特色资源植物种质保护与利用湖北省重点实验室&湖北省医学生物国际科技合作基地,武汉430074)
葡萄糖转运蛋白是一类跨膜蛋白,每个葡萄糖转运蛋白都有12个跨膜结构域,螺旋2、5、7和10与D-葡萄糖穿过GLUT蛋白中的空隙有关,螺旋7的残基Gln-Leu-Ser被称为QLS位点,广泛存在于GLUT蛋白家族中[1].肌肉及脂肪组织中的葡萄糖摄取主要依赖于葡萄糖转运体4 (GLUT4)转运细胞外的葡萄糖通过细胞膜进入细胞.GLUT4对维持体内糖平衡及稳态至关重要,GLUT4在肌肉或脂肪组织中表达的选择性中断会诱导全身的胰岛素抵抗.
A549细胞是一种人肺腺癌上皮细胞系.它在形态、结构及代谢产物组成上与II型肺泡细胞极为相似,后者是一类直径约9 μm的球形肺泡细胞,主要合成和分泌脂蛋白类物质,稳定肺泡体积变化,降低其表面张力,其功能异常可能会引起水肿的发生.因此,A549细胞已被用作研究II型肺泡细胞反应的模型[2].另一方面,它作为非小细胞肺癌中的一种,在肺癌研究中具有一定的意义.癌细胞具有不受控的无限增殖及持续的侵袭与迁移的能力,发生比正常细胞更多的能量代谢及糖代谢,GLUT4作为葡萄糖传感器和治疗糖尿病的重要靶点,在癌细胞中的作用机制鲜有报道,因此构建GLUT4基因敲减的A549细胞系,探讨GLUT4基因表达缺失是否会对A549细胞葡糖糖摄取及细胞功能上产生影响很有意义.
CRISPR/Cas9是近年来在原核生物中发现的一种免疫系统,原本是一种存在于古细菌和细菌中的规律、成簇的间隔短回文重复序列,为自身提供特异性保护机制[3].它在各种模式生物以及人类细胞[4]中均表现出较强的基因编辑活性.后对真核细胞中的这种新型CRISPR/Cas系统进行改造,如对Cas9内切酶进行了优化,使其包括人类细胞的核定位信号,并可合成单个引导RNA(sgRNA),以针对任何20 bp的DNA序列[5],从而达到定点基因编辑的目的.
我在新西兰做获奖演说时,我讲过“文学是另一种造屋”。写作就是造屋,第一个层面的造屋是使人们有个安居的地方,让心灵有一个安顿的地方,作品就是心灵的屋子;第二个层面的造屋是指每个人都向往自由,自由在哪里能实现?是在文学的这个屋子里实现,因为这个屋子是我的,我可以在这个地方自由地放飞我的思想。从这个意义上讲,你想得到的自由,写作可以满足你。
基于CRISPR/Cas9技术,本文拟构建GLUT4敲减细胞系,从而对该基因在肺癌细胞中的功能进一步研究.
在NCBI网站上查找并设计人源GLUT4基因的Real-time PCR引物,找出一组评分最高的引物进行合成.引物序列见表2.利用Trizol提取总RNA,而后逆转录成cDNA,利用普通PCR检测GLUT4基因的Real-time PCR引物是否可用,若GLUT4和β-actin均有条带,则此GLUT4引物设计成功,可供后续使用,反之,则需重新设计引物.
1.2.6 培训设施 Laerdal211—00050SinMan高级全功能综合模拟人心肺复苏听诊与腹部触诊仿真电子标准化病人TV8021M3BW44llg心肺音听诊模型、高级综合穿刺术与叩诊检查技能训练模拟人MWA496028、3BW44008外科缝合包扎展示模型、高级外科缝合腿肢模型RLDO76O02、无菌技术操作包、换药操作包、小型综合手术技巧训练模块、针灸针、火罐、针包、电针、听诊器、叩诊锤、直尺、皮尺等。
1 材料与方法
1.1 材料和仪器
A549肺癌细胞(Procell);Fast DigestBpiI、Fast AP、10X Fast Digest Buffer(Thermo Scientific);Stbl3感受态大肠杆菌、10X T4 Ligation Buffer、T4 DNA ligase(武汉淼灵生物);T4 PNK、10XTaq Buffer、dNTP、rTaq(TaKaRa);PX458质粒、逆转录试剂盒(Thermo Scientific);Protein Ladder(Thermo);DTT(Biosharp);PMSF、SDS-PAGE凝胶快速配制试剂盒、BCA蛋白浓度测定试剂盒、胶回收试剂盒(AxyGen);BeyoECL Plus、Tween-20、上样缓冲液(碧云天);DMEM培养基、RPMI-1640培养基(HyClone);Lipofectamine 3000 (Invitrogen);甲醇(分析醇);氯化钠、甘氨酸、磷酸二氢钾、十二水合磷酸氢二钠、氯化钙(国药集团);Anti-β-actin、HRP-goat anti mouse IgG(康为世纪);引物合成、引物合成及基因测序(武汉擎科生物);Anti-GLUT4(Cell Signaling Technology).
核酸凝胶成像系统、蛋白凝胶成像系统(BIO-RAD, USA);细胞培养箱(力康生物医疗科技控股集团);流式细胞仪(BD公司);DYY-6C 型电泳仪(北京六一仪器);冷冻离心机(Eppendorf);酶标仪(Infinite200型,TECAN) ; Real-Time PCR System(7500fast型,Applied Biosystems).
1.2 sgRNA序列的设计
在NCBI上检索出人源GLUT4基因的mRNA序列,将位于CDS区的靠前的几个外显子序列依次粘贴至CRISPR在线设计工具网站http://crispr.mit.edu/,选择评分最高的sgRNA,根据PX458载体上BpiI限制酶的酶切位点,在选定的sgRNA序列5′端添加CACCG,对应互补链的3′端加上C,5′端加上AAAC,设计出的四个成对的sgRNA序列见表1,PX458质粒图谱见网站http://www.addgene.org/48138/.

表1 GLUT4 sgRNA引物名称及序列Tab.1 Primename and sequences of GLUT4 sgRNA
1.3 重组表达载体的构建与检测
利用快切酶BpiI对PX458质粒的Bbsi位点进行特异性切割,跑胶鉴定后得到线性质粒,同时将成对的sgRNA退火成双链,切胶回收后的线性质粒及稀释后的sgRNA双链在T4 DNA ligase 的作用下进行连接[6],而后通过45 s热击转化至stbl3感受态中,37 ℃过夜培养,将长出来的菌落挑选出一部分,150 r·min-1摇菌,部分保种,而后送测序以鉴定是否构载成功.
1.4 细胞培养和细胞转染
培养约两周后将细胞转至24孔板里,等到细胞密度长到80%再将细胞转入12孔板中.待到12孔板里细胞长满,抽提各孔细胞基因组,做好标记送测,而后与原始序列进行比对,从而挑选出被编辑的细胞株,扩培后一部分冻存,一部分开展后续实验.
1.5 流式细胞仪分选
采用Origin 9.0和 CorelDRAW X4 SP2绘图,采用t-test 统计数据.
1.6 基因组提取及测序
A549细胞用含1%双抗、10%胎牛血清和89% RPMI-1640培养基的培养液培养在含5%的CO2,37 ℃恒温培养箱中.待细胞状态生长良好,使用Lip 3000进行转染,按说明书进行操作.将细胞传代至六孔板中,待细胞生长达到80%的汇合率进行实验.先使用opti-MEM培养基饥饿细胞,再配制125 μL opti-MEM、2.5 μg质粒和5 μL P3000的混合液,以及125 μL opti-MEM、3.75 μL Lipo-3000的混合液,分别静置5 min后,轻轻混匀.再静置5 min后,加入细胞中,3 h后换RPMI培养基,24 h后在荧光显微镜下观察细胞发出荧光的状态.
1.7 Real-time PCR检测mRNA水平敲减效率
第一,把好选苗关。种龟试蛋产出的苗和病龟产蛋孵化出的龟苗都会出现体质较弱的特点,在饲养过程中容易出现问题;年轻种龟苗抗病能力低,老种龟苗为上选;最傻瓜的方法:买大不买小,还要搞清楚是自然孵化出的还是加温孵化出的,前者抗病能力强。
取八连排离心管,按照如下体系配好(5×Real-time PCR mix 10 μL,Primer-R 1 μL,Primer-F 1 μL,Template 7 μL,H2O 20 μL),放入Real-time PCR仪中,得到所测量的数据,实验重复3次.
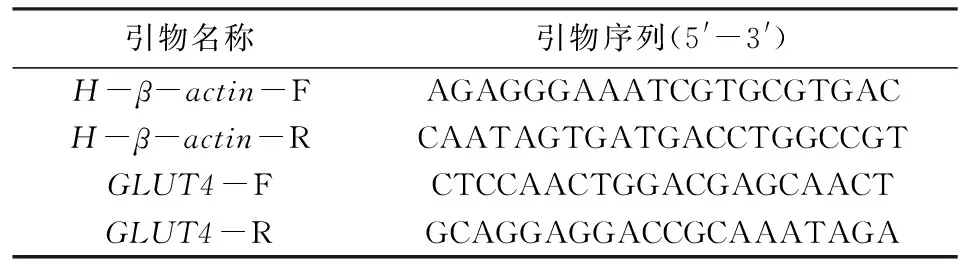
表2 Real-time PCR引物列表Tab.2 Real-time PCR primer list
1.8 Western Blot检测蛋白水平敲减效率
待野生型A549细胞株与GLUT4基因敲减细胞株生长达到90%的汇合率时,提取细胞总蛋白,用SDS-PAGE凝胶配制试剂盒配完胶后,点样,浓缩胶80 V/40 min,分离胶100 V /1.5 h,后在100 V电压下转膜1 h,置于5% BSA溶液中封闭1 h,敷一抗过夜,每10 min 用PBST洗膜,3次后敷二抗1 h,最后再3次PBST及2次PBS清洗后,通过ECL显影观察条带,实验重复3次.
1.9 激光共聚焦显微镜检测葡萄糖摄取水平变化
待野生株与突变株细胞长满后,用胰酶消化下来,用1 mL培养液富集消化的细胞,弃850 mL的细胞悬液,留150 mL的细胞悬液备用.在剩余的150 mL溶液中加入3 mL的培养液进行稀释.用镊子将浸泡在酒精中备用的载玻片取出,放在酒精灯上烘干,放置在玻璃培养皿的中央,取1 mL的稀释过后的培养液,在载玻片的中央缓慢的将培养液加入到载玻片上,每一株细胞做3组平行.待细胞生长至16 h时,用5 mL PBS冲洗载玻片, 10 mL PSS溶液饥饿细胞2 h,再将载玻片安置于载物台上,加入200 μL 浓度为100 mM的2-NBDG荧光染料,暗处孵育1 h.使用Confocal显微镜观察并圈取60株细胞记录细胞,荧光量并进行数据分析.
《村民委员会组织法》中没有规定具体的监督操作流程。由于集体经济组织资源,尤其是土地资源非常稀缺,如果仿照公司结构模式运行,那么必须设置监督委员会,否则村民利益会经常受到侵害。
1.10 统计分析
细胞转染培养48 h后,用胰酶将其消化下来,用含1% FBS的PBS重悬细胞,再将其滤过300目流式膜并收集于已灭菌的流式管中,以转入空载的细胞作为对照调节电压等参数,激发波长488 nm,而后将单个的转染后发绿色荧光的细胞分别打到每个孔事先加入了200 μL的含20%的血清和2%双抗的培养基的96孔板中.
高度集成化的E-HOUSE功能,使其优于传统的土建式电气室,既降低了成套设备对现场环境、对土建施工与设备配套的要求,又缩短了现场设备集成和调试的工期。同时,其灵活的拆装性能更方便于日后的站内改造工程,可以根据需要改变其位置,仅需重新施工基础即可。
2 结果
2.1 细胞转染结果
将标记好的各株单克隆细胞抽提基因组测序后,与GLUT4基因原始序列进行比对,结果如图2显示,只有3-6对细胞产生了明显的编辑,峰图也可见明显的套峰.
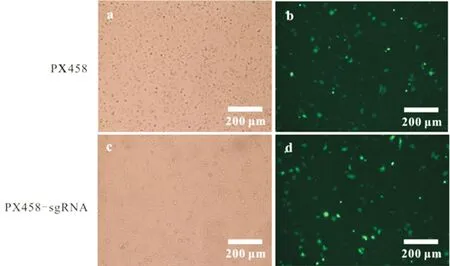
a,c)明场下视野(10×);b,d)荧光下视野(10×)图1 质粒转染的A549细胞Fig.1 A549 cells transfected by plasmid
2.2 构建敲减GLUT4基因的A549细胞株
利用lipo3000将测序比对后构建成功的重组载体PX458-sgRNAS1、S2、S3、S4分别转进A549细胞里,24 h后在荧光显微镜下观察细胞转染效率,如图1所示,由绿色荧光细胞分布密度可反映空载及重组载体均以较高效率成功转入到A549细胞中.
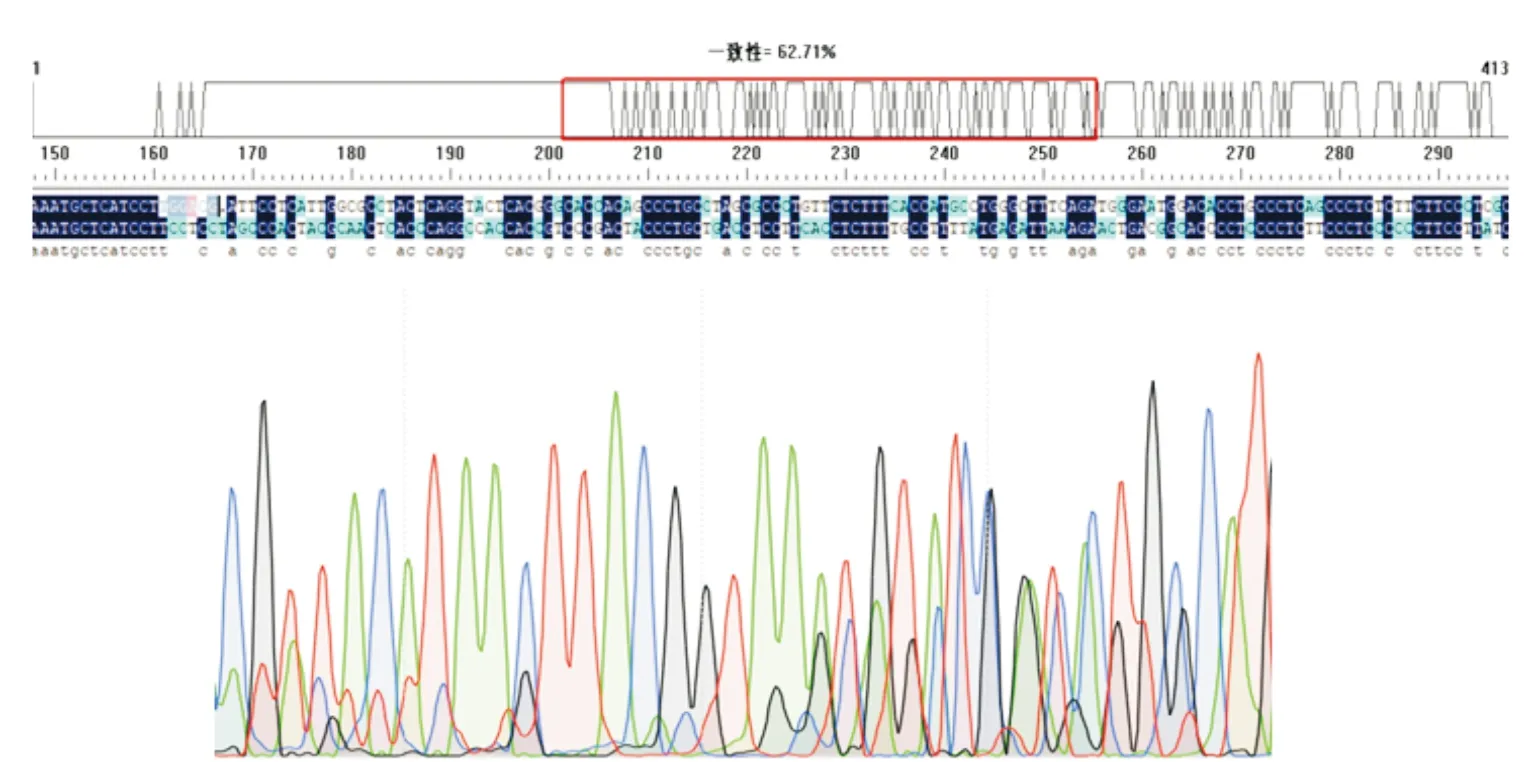
图2 PX458-sgRNA-S1的序列比对及峰图Fig.2 Sequence alignment and peak map of PX458-sgRNA-S1
2.3 Real-time PCR检测表明突变株GLUT4基因mRNA表达量显著降低
首先,我们根据他电话中提供的个人信息,核实了他是本单位在册在岗员工,查询到了他所在的作业单元。紧接着,我们联系了具体负责该项事务的劳资员,说明了有关情况。负责他所在作业单元劳资工作的员工虽显紧张,但积极且迅速地配合了我们的工作。她先查询了她负责的工资表情况,核实无误,又致电了对接其工作的财务人员,确认工资已上账,便立马将情况反馈给我们。
对野生株和突变株这两株细胞中的GLUT4基因的mRNA的表达含量进行了检测(图3),这是对基因敲减效果的初步鉴定,由mRNA表达含量的减少可知基因敲减作用十分明显,图3中与野生株相比,3-6的GLUT4基因的mRNA表达量减少了约75%,结果由3次独立重复实验获得,可进一步进行蛋白质含量的鉴定.
狗子还不肯离开。雪萤想了想,掏出50元钱递给他,“去,买糖吃,钱没花完不准回来找阿姨。”狗子高兴得跳了起来,抓过钱跑下了楼。

图3 Real-time PCR检测突变株GLUT4基因的mRNA表达量Fig.3 Detection of GLUT4 gene mRNA expression by Real-time PCR
2.4 Western blot检测表明突变株细胞GLUT4蛋白表达水平降低
将筛选出来的被编辑的突变株细胞提蛋白后,与野生型A549细胞做对比,检测其蛋白水平表达的变化,结果如图4,统计图由3次重复独立实验获得.由图4可知:3-6细胞GLUT4蛋白的表达减少了85%,证明已经成功的获得了GLUT4基因敲减的A549细胞株.
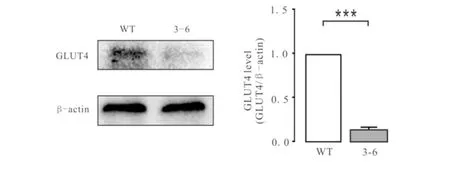
图4 Western blot 检测3-6与WT的蛋白表达差异Fig.4 Difference of protein expression between 3-6 and WT detected by Western blot
2.5 GLUT4敲减细胞株的葡萄糖摄取水平显著降低
使用激光共聚焦显微镜对贴片培养并孵育1 h 荧光染料2-NBDG的野生型A549细胞和突变型细胞进行葡萄糖摄取水平测定,并分别圈取视野下的60株细胞,对其荧光强度取均值,再用t检验比较两组间的差异性,对应的显微观测图以及荧光强度情况见图5.从图5可见:3-6细胞的荧光强度弱于野生型A549细胞,3-6细胞的平均荧光强度为5.6958,野生型A549细胞的平均荧光强度为9.55845,即3-6细胞的葡萄糖摄取量低于野生型A549细胞.
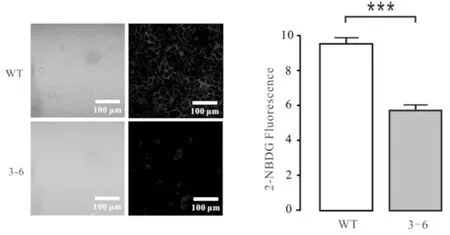
图5 激光共聚焦显微术检测葡萄糖摄取量Fig.5 Glucose uptake detected by Confocal
3 讨论
CRISPR/Cas9技术是近些年快速发展起来的基因编辑技术.在此之前,锌指核酸酶(ZFN)和TALEN技术分别占据了基因编辑技术的半壁江山.这两种基因敲除的方法主要是通过在DNA靶位点或者附近产生双链断裂之后,通过DNA的非同源性修复双链断裂来完成的[7,8].上述两种基因敲除的方法虽然成熟,但是步骤复杂,且基因敲除体系太大.然而CRISPR/Cas9则是针对目的基因设计特异性的sgRNA,后利用Cas9蛋白对靶序列进行切割从而达到编辑基因的目的[9],具有更低的成本、更简单的操作方法和更高效的编辑效率等优点.
GLUT4在调节全身葡萄糖稳态中起关键作用[10].研究表明,大网膜脂肪组织中GLUT4的表达量可能会成为结直肠癌诊断的有利生物标志物和预测靶点[11].结肠癌患者NK细胞中GLUT4表达量的减少是引起这些细胞功能失活的关键原因[12].GLUT4的缺失会损害乳腺癌细胞的增殖,并在低氧条件下严重影响细胞活力[13].另外,开发GLUT4选择性抑制剂可作为抗癌治疗药物[14],一些能够通过抑制GLUT4蛋白来调节癌细胞葡萄糖消耗的植物化学物质也渐渐被研究去作为新的治疗癌症的治疗候选药物.为了确定GLUT4对肺癌细胞正常代谢生理的作用,本文选择A549肺癌细胞来开展研究.先成功构建了pX458-sgRNA表达载体,筛选得到了一株编辑情况最好的突变株细胞3-6,对其mRNA表达量和蛋白质表达含量的测定均检验到了较大程度的敲减效果,3-6细胞株mRNA表达量减少了约83%,GLUT4蛋白表达量减少约85%.GLUT4基因敲减的3-6突变细胞株所发出的荧光没有野生型A549细胞的荧光强,说明3-6细胞的葡萄糖摄取量比正常的A549细胞低很多.实验证明:GLUT4基因的敲减对于A549细胞中GLUT4基因mRNA及蛋白的表达量产生了明显的表型影响,并且敲减后的突变细胞株在葡萄糖摄取水平上发生了明显的降低,这对肺癌及哮喘的研究开辟了新的方向,通过抑制葡萄糖的摄取,来降低细胞内ATP的产生,抑制炎症反应,起到保护肺部和气管细胞的作用.
综上所述,本文构建了GLUT4基因敲减的细胞系,为其在肺癌细胞中基因功能研究提供了工具和方法,为后续深入研究其对肺癌细胞功能的影响奠定了基础.
