慢性阻塞性肺疾病肠道微生态与炎症因子及临床指标的相关性
2020-04-18吴永红陈军罗洲
吴永红 陈军 罗洲
四川省简阳市人民医院1重症医学科,2呼吸内科(四川简阳641400)
慢性阻塞性肺疾病(chronic obstructive pulmo⁃nary disease,COPD,简称慢阻肺)是一种严重危及人类健康的慢性疾病,2018年中国40岁以上的成人慢阻肺的患病率高达13.7%,为主要医疗负担之一[1]。目前普遍认为COPD的主要病理基础是慢性非特异性炎症,炎症细胞及细胞因子在其中起着重要作用[2]。肠道菌群是近年研究的热点内容之一,目前逐渐认识到肠道微生态失衡可能与COPD慢性气道炎症间存在密切关联[3]。本研究旨在进一步明确COPD肠道微生态的多样性与慢性气道炎症的相关性,为COPD防控提供新的思路。
1 对象与方法
1.1 研究对象 2018年2月至2019年4月在我院呼吸内科病房或门诊新入院未治疗的慢阻肺急性加重患者(A组)30例,慢阻肺稳定期(S组)30例,并在我院体检中心选取正常人对照组(N组)30例。所有入选患者均要求近4周未使用过抗生素和激素,且无肠道疾病。
1.1.1 纳入标准 (1)年龄18~80岁;(2)COPD诊断标准均符合2018年中华医学会呼吸病学会制定的COPD诊断标准[1];(3)呼吸内科病房或门诊新来院尚未开始治疗的慢阻肺加重期患者及稳定期患者。
1.1.2 排除标准 (1)恶性肿瘤;(2)活动性结核;(3)其他的呼吸道疾病;(4)肠道疾病的患者;(5)妊娠期哺乳期妇女;(6)病情危重,需要气管插管机械通气患者;(7)合并多种疾病,病情不稳定患者;(8)其他原因不能配合本研究者。正常对照组为来自我院体检中心近4周未使用过抗生素与激素的无肺部感染性疾病和肠道疾病的健康体检人员。本研究经患者本人及家属知情并签字同意,医院伦理委员会批准通过。
1.2 研究方法
1.2.1 一般资料 所有入选患者均询问病史及查体,行实验室检查及肺功能检查。一般资料的指标有:性别、年龄、体质量指数(body mass index,BMI)、吸烟指数(包年)、COPD症状评分(COPD assessment test,CAT)[4];实验室检查指标有:血常规、降钙素原(procalcitonin,PCT)、C反应蛋白(C⁃reactive protein,CRP)等。肺功能检查采用德国Jaeger公司肺功能仪,测定第1秒用力呼气容积(forced expiratory volume in 1 s,FEV1)、用力肺活量(forced vital capacity,FVC)和一秒率(forced expiratory volume in 1 s/forced vital capacity,FEV1/FVC):测定时间均在早上8:00-12:00进行。测定方法参考中华医学会发布的肺功能指南的程序和标准[5]。
1.2.2 粪便标本的收集与保存 患者来院24 h内留取新鲜粪便标本,厌氧低温保存后转移至实验-80℃冰箱保存,直至使用粪便DNA微型试剂盒(MOBIO Laboratories)提取来自粪便样品的DNA。
1.2.3 血清炎症因子的测定 在开始治疗前清晨采集所有患者空腹静脉血5 mL,分离血浆,置于-20℃冰箱中冻存。采用ELISA法检测血浆中肿瘤坏死因子α(TNF⁃α)、白介素(IL⁃6)及白介素-8(IL⁃8)水平,试剂盒均购自武汉伊莱瑞特生物科技有限公司,具体步骤依据试剂盒说明书进行。
1.2.4 粪便中DNA提取和测序 抽提粪便中的DNA后用琼脂糖凝胶电泳检测DNA的纯度和浓度,进行PCR扩增。细菌多样性鉴定对应区域:16S V3⁃V4区(引物343F和798R)343F前端引物:5′⁃TACGGRAGGCAGCAG⁃3′;后端引物:798R⁃5′⁃AGGGTATCTAATCCT⁃3′,对V3⁃V4可变区进行PCR扩增,Qubit检测对PCR产物定量。纯化后产物送上海欧易公司测序,由Illumina Miseq测序。
1.2.5 生物信息学分析 使用Trimmomatic软件[6]对原始双端序列进行去杂,采用Vsearch软件[7],对参数为序列相似度≥97%被归为一个操作分类单元(operational Taxonomic Unit,OTU)。使用QIIME软件包的挑选出各个OTU的代表序列,并将所有代表序列与Silva(version123)数据库进行比对注释[8]。用组间差异显著物种分析(LEfSe)软件[9],确定组间相对丰度差异的菌群。用冗余分析(redundancy analysis,RDA)方法,找出差异菌群与炎症因子及临床指标的相关性。
1.3 统计学方法 采用SPSS 26.0软件进行统计分析。重复测量方差分析,组间比较采用独立样本t检验,正态分布数据用表示,用Spearman进行相关性分析。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 本研究共纳入A组、S组、N组患者各30例,最后完成实验且标本合格者80例,其中A组29例,S组29例,N组22例。A组与S组患者在年龄、性别、吸烟指数、CAT指数、肺功能指标等临床指标上基线一致,差异无统计学意义(P>0.05)。而BMI、严重程度分级、炎性指标差异有统计学意义(P<0.05)。见表1。
2.2 血清炎症因子指标比较及相关性分析
2.2.1 3组患者血清炎症因子水平 IL⁃8,TNF⁃α与IL⁃6差异有统计学意义,其中A组患者高于S组,且均高于N组,见表2。
2.2.2 相关性分析 IL⁃8、IL⁃6与TNF⁃α三者之间呈正相关(r=0.748、0.591、0.753,P<0.05),且炎症指标与CAP评分、疾病严重程度分级与肺功能均存在相关性,见表3。
2.3 3组患者肠道菌群LEfSe分析 该分析主要是找到组间在丰度上有显著差异的物种,不同颜色表示不同分组,可以观察3组中存在显著差异的物种,见图1。
2.4 菌群相对丰度与炎症指标相关性分析
2.4.1 A组患者肠道菌群相对丰度与炎症指标的相关性分析 在A组患者中,霍氏真杆菌、厌氧棒状菌属、毛螺旋菌属、双歧杆菌、布劳特氏菌属、柯林斯菌属、Subdoligranulum菌与TNF⁃α、IL⁃8、IL⁃6、CAT评分和严重程度分级均呈负相关,但与FEV1%呈正相关。相反,普雷沃菌属-9、肠球菌、Lachnoclostridium菌和副拟杆菌则与炎性因子、CAT评分、严重程度分级呈正相关,而与FEV1%呈负相关,见表4。
表1 两组患者临床资料比较Tab.1 Comparison of clinical data between the two groups ±s
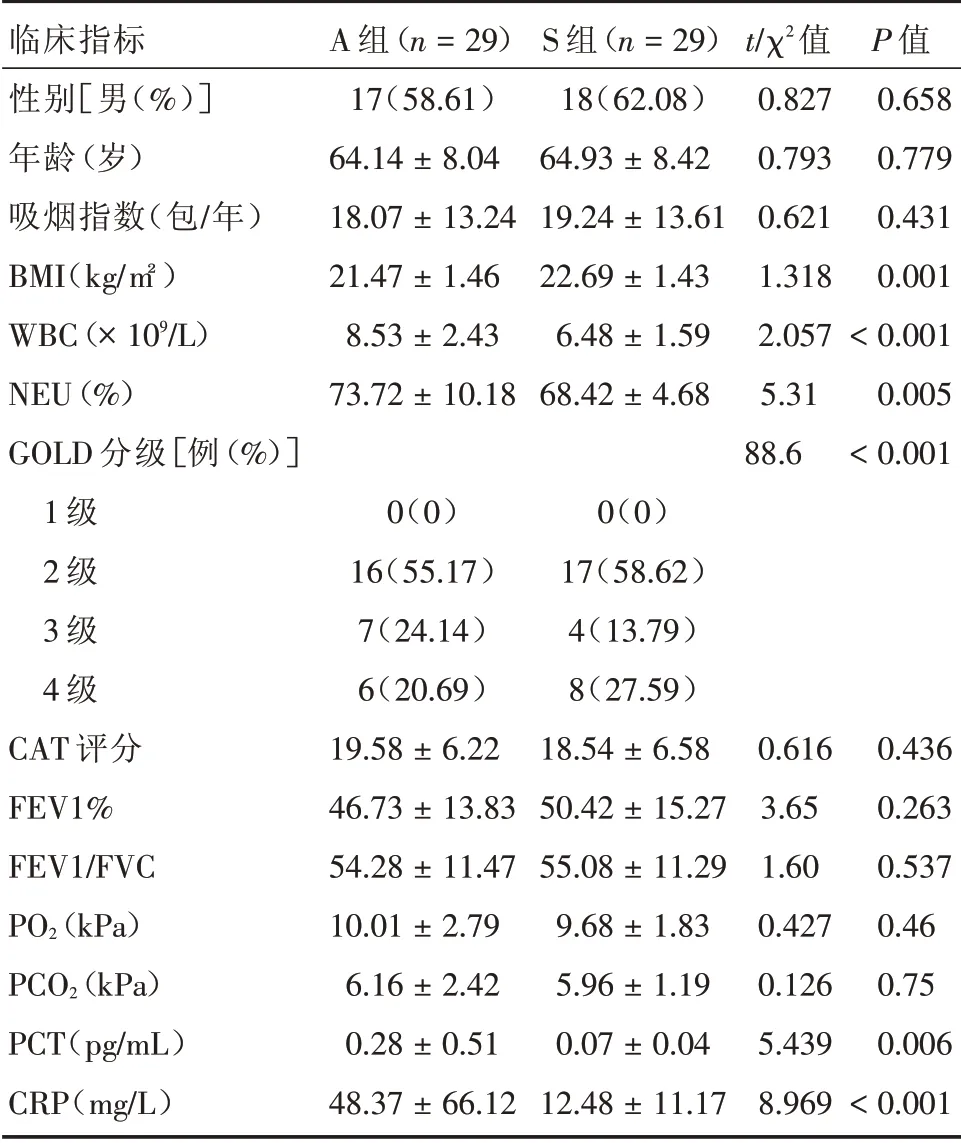
表1 两组患者临床资料比较Tab.1 Comparison of clinical data between the two groups ±s
临床指标性别[男(%)]年龄(岁)吸烟指数(包/年)BMI(kg/㎡)WBC(×109/L)NEU(%)GOLD分级[例(%)]1级2级3级4级CAT评分FEV1%FEV1/FVC PO2(kPa)PCO2(kPa)PCT(pg/mL)CRP(mg/L)A组(n=29)17(58.61)64.14±8.04 18.07±13.24 21.47±1.46 8.53±2.43 73.72±10.18 0(0)16(55.17)7(24.14)6(20.69)19.58±6.22 46.73±13.83 54.28±11.47 10.01±2.79 6.16±2.42 0.28±0.51 48.37±66.12 S组(n=29)18(62.08)64.93±8.42 19.24±13.61 22.69±1.43 6.48±1.59 68.42±4.68 0(0)17(58.62)4(13.79)8(27.59)18.54±6.58 50.42±15.27 55.08±11.29 9.68±1.83 5.96±1.19 0.07±0.04 12.48±11.17 t/χ2值0.827 0.793 0.621 1.318 2.057 5.31 88.6 0.616 3.65 1.60 0.427 0.126 5.439 8.969 P值0.658 0.779 0.431 0.001<0.001 0.005<0.001 0.436 0.263 0.537 0.46 0.75 0.006<0.001
表2 3组患者血清炎症因子指标比较Tab.2 Comparison of serum inflammatory factors among the three groups ±s

表2 3组患者血清炎症因子指标比较Tab.2 Comparison of serum inflammatory factors among the three groups ±s
组别A组S组N组F值P值例数29 29 22 IL⁃8(pg/mL)60.96±26.80 41.33±9.76 30.13±5.89 24.972<0.001 IL⁃6(pg/mL)55.90±32.70 41.65±17.69 11.82±5.07 31.276<0.001 TNF⁃α(pg/mL)31.22±11.46 24.92±7.97 11.12±4.41 42.923<0.001
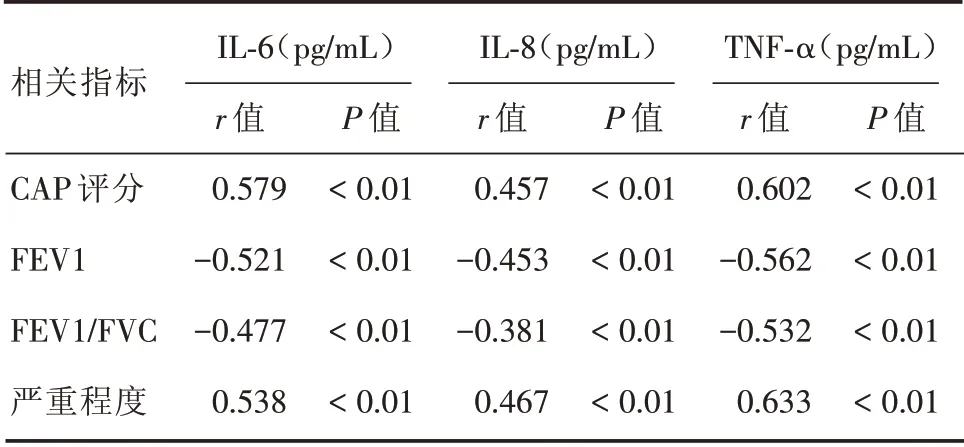
表3 血清炎症因子与临床指标的相关性分析Tab.3 The relativity analysis of serum inflammatory factors and clinical indicators
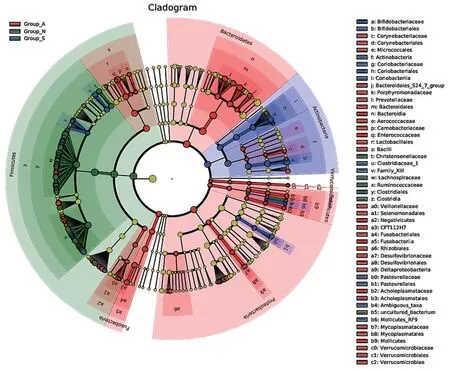
图1 LEfSe分析差异物种注释分支例图Fig.1 Example diagram of annotation branches for LEfSe analysis of different species
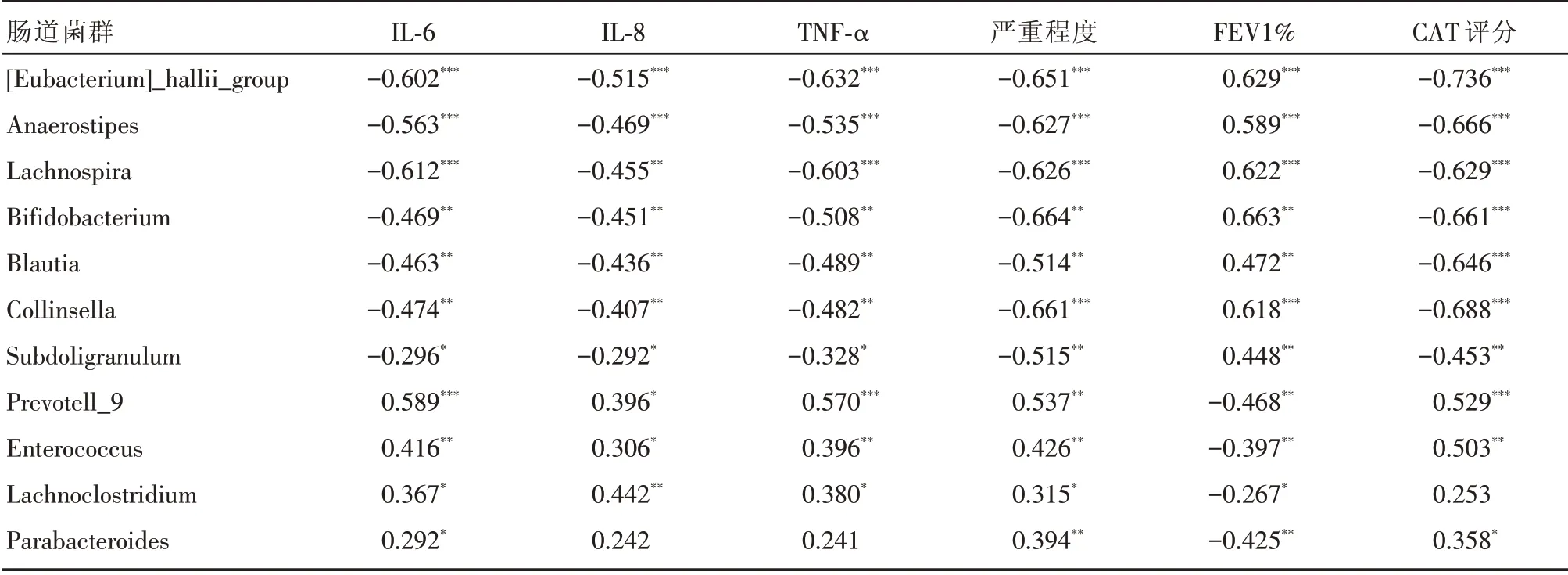
表4 A组患者肠道菌群相对丰度与炎症指标相关系数Tab.4 Correlation analysis between the abundance of intestinal flora and inflammatory indicators in group A
2.4.2 S组患者肠道菌群相对丰度与炎症指标的相关性分析 在S组患者中,双歧杆菌和Fusi⁃catenibacter菌丰度与IL⁃8水平呈负相关,Lachno⁃clostridium菌的丰度与IL⁃8及TNF⁃α水平均呈正相关,双歧杆菌与CAT评分呈负相关,与FEV1%呈正相关;双歧杆菌、Anaerostipes菌和Fusicateni⁃bacter与BMI呈正相关,见表5。
2.4.3 N组患者肠道菌群相对丰度与炎症指标的相关性分析 在N组患者中,霍氏真杆菌丰度与患者CAT评分呈负相关,与FEV1%呈正相关;罗斯氏菌丰度与IL⁃8水平及严重程度呈负相关,Fu⁃sicatenibacter菌的丰度与TNF⁃α水平均呈正相关,见表6。
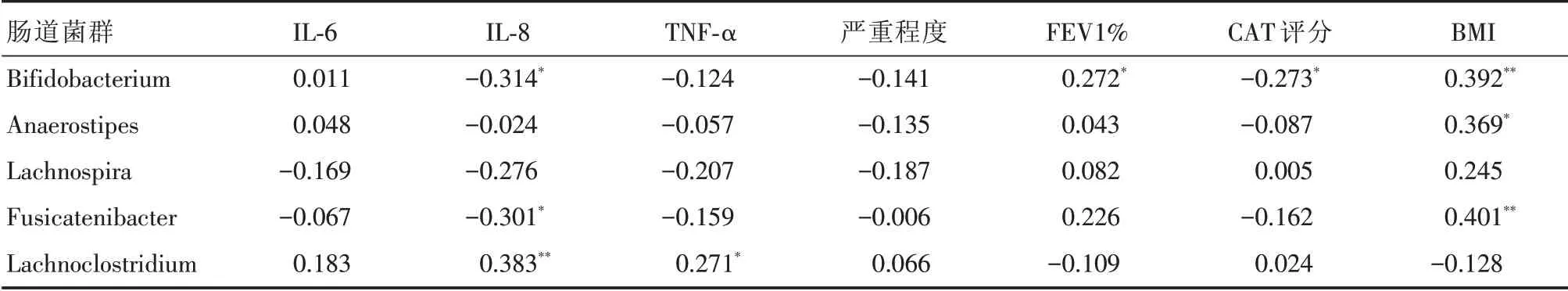
表5 S组患者肠道菌群相对丰度与临床指标及炎症因子的相关系数Tab.5 Correlation analysis between the abundance of intestinal flora and inflammatory indicators in group S
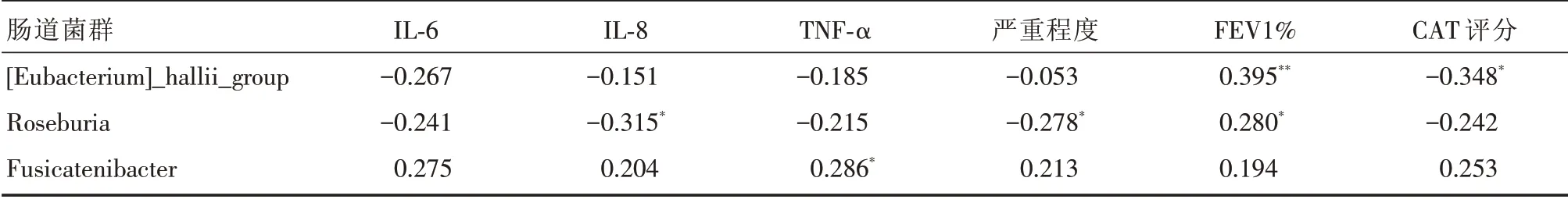
表6 N组患者肠道菌群相对丰度与临床指标及炎症因子的相关系数Tab.6 Correlation analysis between the abundance of intestinal flora and inflammatory indicators in group N
3 讨论
慢阻肺是一种由多种炎症细胞因子参与的慢性气道炎症性疾病,稳定期COPD患者仍然存在气道和全身的慢性炎症反应[1-2]。在COPD发病机制中,TNF⁃α、IL⁃8、IL⁃6是重要的致炎因子,通过诱导巨噬细胞、中性粒细胞聚集、黏附及脱颗粒,激化氧化应激反应的发生,参与或加重COPD气道炎症反应过程[10-11]。肠道菌群微生态失衡引起的内毒素及炎性介质释放,直接或间接促进COPD的发生发展。肠道和肺部通过微生物、免疫功能相互影响,实现双向调节,称为肠-肺轴[12]。肺与肠存在相同的结构来源,哺乳动物肺上皮起源于胚胎肠内胚层,是从前肠内胚层的共同的祖先细胞衍生而来[13]。而且,肠源性有害因素是通过肠道到达肺部和全身循环淋巴管[14]。而肠道益生菌则可能改善COPD病理改变。HERB等[15]研究证明,短双歧杆菌和鼠李糖乳杆菌可以改变COPD模型小鼠肺部病理特征,降低巨噬细胞的炎症反应[16]。另有研究发现,摄入能够增加短链脂肪酸生成的膳食可以预防弹性蛋白酶诱导的炎症和肺气肿的出现[17]。由上可知,肠道微生态与肺部之间可能通过代谢及免疫调节等信号通路相互影响[18]。
本研究中慢阻肺急性加重期患者的TNF⁃α,IL⁃8,IL⁃6高于稳定期患者,且均高于正常对照,表明COPD患者存在明显的炎症反应,炎症因子可能参与了COPD发病及发展过程。IL⁃8、IL⁃6、TNF⁃α三者间存在正相关,说明炎症因子的升高可能触发级联反应,启动炎症反应及刺激其他炎症介质[19],因此血清中的多种炎症因子均会出现异常升高。炎症因子升高与患者的严重程度和CAP评分存在正相关,与肺功能指标呈负相关,说明炎症因子的升高可能产生对气道、肺泡壁和肺血管的慢性损伤[20],从而引起气流受限,提示炎症因子对于判断和预测COPD急性加重及病情的严重程度均有一定的价值。
本研究中3组患者肠道菌群存在明显差异,用LEfSe分析进一步确定组间在丰度上有显著差异的物种,A组差异的物种有拟杆菌属、芽孢杆菌属、变形菌、肠球菌、普雷沃氏菌科;S组有差异的物种有:放线菌门、双歧杆菌属;N组有差异的物种有绿菌门、毛螺菌属、厚壁菌门、布劳特氏菌等。提示这些差异物种可能可作为慢阻肺分期的生物标志物。差异菌与炎症因子及临床指标的相关性分析结果显示,在慢阻肺急性加重期患者中,霍氏真杆菌、Anaerostipes菌、毛螺旋菌属、双歧杆菌、布劳特氏菌属、柯林斯菌属、Subdoligranulum菌与炎症因子、CAP评分及严重程度呈负相关,与肺功能指标FEV1%呈正相关,而普雷沃菌属-9、肠球菌、Lachnoclostridium菌和副拟杆菌却恰好相反。霍氏真杆菌、Anaerostipes菌、双歧杆菌等可产生丰富的短链脂肪酸,维护肠黏膜免疫系统的平衡,抑制炎症因子,减轻慢阻肺患者的慢性炎症损伤,从而改善患者的临床症状与肺功能[21]。普雷沃菌属-9、肠球菌、Lachnoclostridium菌和副拟杆菌等丰度的升高引起炎症因子的高表达,从而促进慢阻肺的发生发展。在稳定期的慢阻肺患者及正常对照组中,菌群的丰度与炎症因子及临床指标的相关性较弱,双歧杆菌、Fusicatenibacter菌与罗斯氏菌与气道炎症因子呈负相关,而与FEV1呈正相关,而Lachnoclostridium菌则同样得出相反的结果。进一步提示霍氏真杆菌、双歧杆菌、布劳特氏菌属等菌种可能减轻慢阻肺患者气道炎症,而普雷沃菌-9、肠球菌、Lachnoclostridium菌等则可能引起炎症因子升高,而与慢阻肺急性加重和临床指标的恶化有关。
综上所述,本研究揭示了慢阻肺患者在不同时期肠道微生态和炎症因子的变化,以及微生态与炎症因子及临床指标的相关性,找出不同分期存在的差异菌群。提示有些菌群,如霍氏真杆菌,Anaerostipes菌,毛螺旋菌属,双歧杆菌等可抑制慢阻肺的慢性炎症,或许可作为慢阻肺患者的有益菌;而普雷沃菌属-9、肠球菌、Lachnoclostridium菌和副拟杆菌等则与炎症因子高表达有关,可能促进慢阻肺的发生与进展。随着高通量测序技术进一步发展,通过改变肠道不同菌群的丰度,对慢阻肺的发生发展及急性加重的预防进行调控,可能可作为下一步的研究方向。本研究存在以下不足:肠道菌群影响因素多,研究结果可能会受到混杂因素的影响;样本量少;研究的菌种尚有限。以后尚需开展大规模的更精准的研究才能提供更多的证据。
