某三甲医院危重症病人万古霉素血药浓度监测与临床用药87例分析
2020-04-16周冉方焱苏丹
周冉,方焱,苏丹
2018年CHINET数据显示,耐甲氧西林金黄色葡萄球菌(MRSA)的检出率为34.4%,耐甲氧西林凝固酶阴性葡萄球菌(MRCNS)的检出率更高达82.6%。万古霉素属于糖肽类抗菌药物,主要通过直接与细菌细胞壁前体五肽侧链末端D-丙胺肽-D-丙氨酸结合,阻止肽聚糖的转肽作用,抑制其细胞壁合成,改变细胞膜通透性及阻碍核糖核酸合成等机制发挥抗菌作用[1],目前仍是临床治疗MRSA、MRCNS和肠球菌等耐药菌所致重症感染的一线治疗药物[2]。由于该药治疗窗窄、药动学个体差异较大,在治疗过程中易出现肾毒性、耳毒性及红人综合征等不良反应[3],这些不良反应在免疫功能低下、合并疾病多、多器官损伤的危重症病人中发生率更高[4]。根据《万古霉素临床应用剂量中国专家共识》,危重症病人建议进行万古霉素血药浓度监测,以降低肾毒性、提高疗效。故本研究采用回顾性分析方法,对190例次万古霉素的血药浓度监测结果、使用情况,病人病原学检测结果、肾功能等信息进行统计分析,为临床合理使用万古霉素提供参考。
1 资料与方法
1.1 一般资料 选择2016年1月至2018年12月期间中国科学技术大学附属第一医院(安徽省立医院)重症监护病房(ICU)使用注射用盐酸万古霉素的162例住院病人,其中有87例病人共进行190例次万古霉素血药浓度监测。本研究经病人或其近亲属知情同意,符合《世界医学协会赫尔辛基宣言》相关要求。
1.2 实验仪器及药品 全自动免疫分析仪(型号:ARCHITECT i1000sr,厂家:Abbott Laboratories);离心机(型号:北京TGL-16G,厂家:上海安亭科学仪器厂);注射用盐酸万古霉素(美国礼来公司或浙江医药股份有限公司新昌制药厂,生产批号C542247、C585408、C676732、C893139、C880387,规格0.5克/瓶)。
1.3 血药浓度监测 使用全自动免疫分析仪,采用化学发光法(CMIA)对万古霉素的血药浓度进行监测。化学发光法主要通过万古霉素抗体包被的微粒子与样本中的吖啶酯标记的万古霉素结合物结合,冲洗,加入预激发液和激发液到反应混合物中,根据其发生的化学发光反应测量万古霉素的浓度。
1.4 判断标准 根据《中国万古霉素治疗药物监测指南》[5],对于一般成年病人,建议万古霉素目标谷浓度维持在10~15μg/mL,对于严重MRSA感染(如菌血症、心内膜炎、骨髓炎、脑膜炎)的病人,建议万古霉素目标谷浓度维持在15~20μg/mL,以降低感染治疗失败率。故本研究将万古霉素血药谷浓度分为三级:<10μg/mL,10~20μg/mL,>20μg/mL。万古霉素的治疗窗为10~20μg/mL。
剔除行连续肾脏替代治疗(continuous renal replacement therapy,CRRT)的病人,运用修正的MDRD计算方法估算病人肌酐清除率(creatinine clearance,CrCl),再按照用药前CrCl将病人分为肾功能正常组CrCl≥90 mL/min、肾功能轻度下降组60 mL/min≤CrCl<90 mL/min、肾功能中度下降组 30 mL/min≤CrCl<60 mL/min、肾功能重度下降组CrCl<30 mL/min。
1.5 统计学方法 用IBM SPSS 24.0对数据进行整理和分析,计量资料用±s表示,两组比较采用独立样本t检验,多组比较采用方差分析,两两比较采用SNK方法;定性资料以例数和构成比进行统计描述,采用χ2检验分析差异性。P<0.05差异有统计学意义。
2 结果
2.1 一般情况 87名病人共监测血药浓度190例次,平均检测2.16例次;56名男性病人共监测114例次,31名女性病人共监测45例次。年龄范围为15~94岁,年龄(53.33±17.66)岁。
2.2 感染部位及病原学检查 感染部位位居前四位的是肺部感染40例(45.98%),血液感染26例(29.86%)、中枢感染5例(5.75%)、腹腔感染4例(4.60%);多名病人多部位感染。87名病人送检率为100%,阳性率为75.86%(66/87),送检标本包括脑脊液、血液、痰液、引流液等。66例阳性结果中,回报革兰阳性菌的占57.58%(38/66),位居前三分别是金黄色葡萄球菌、屎肠球菌、人葡萄球菌人亚种,而革兰阴性菌位居前三的是鲍曼不动杆菌、铜绿假单胞菌、嗜麦芽窄食单胞菌,真菌感染占16.67%(11/66)。多名病人培养出2种或2种以上病原菌。
2.3 血药浓度监测情况 190例次监测结果显示,血药浓度分布范围为1.84~94.33μg/mL,血药浓度(24.48±18.65)μg/mL,在治疗窗的占35.3%;首次监测血药浓度(25.17±21.20)μg/mL,在治疗窗内的仅占26.67%。在各浓度分布范围内,对首次浓度和非首次浓度进行比较,差异有统计学意义(χ2=10.404,P=0.006)。结果见表1。
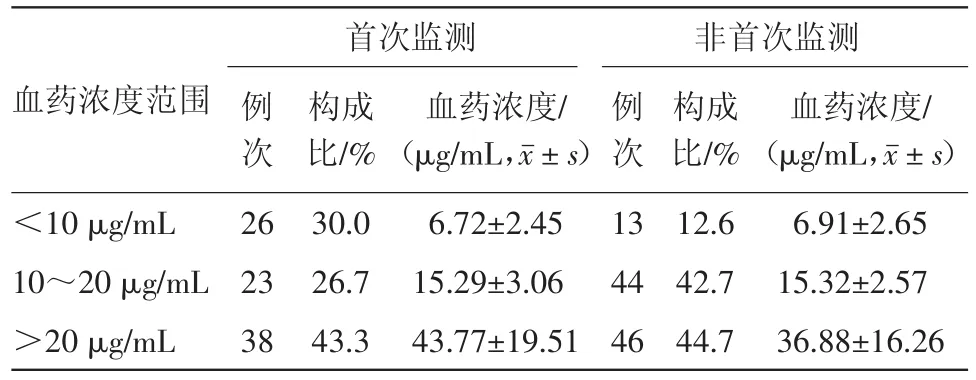
表1 万古霉素注射190例次监测结果血药浓度分布情况
2.4 日剂量与万古霉素血药浓度的关系 190例次万古霉素血药浓度,根据万古霉素使用日剂量将其分为三组,分别为日剂量<2.0 g组、=2.0 g组和>2.0 g组,比较不同日剂量对血药浓度的影响。对不同浓度范围内的不同万古霉素使用日剂量进行比较,差异有统计学意义(χ2=20.92,P<0.001)。结果见表2。
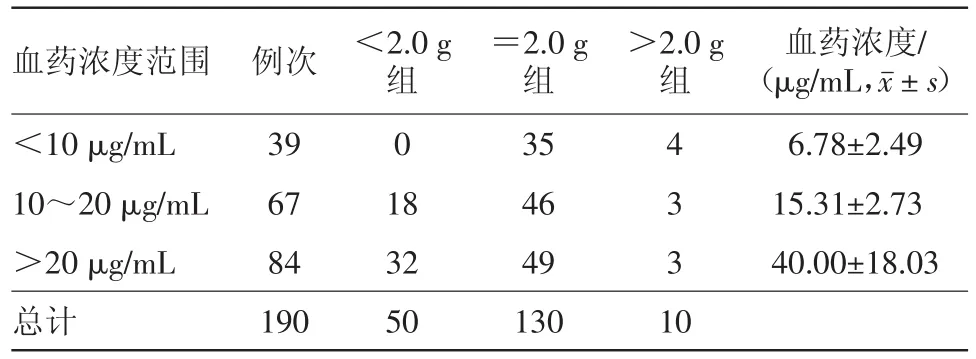
表2 万古霉素注射190例次不同日剂量万古霉素浓度分布情况
2.5 各年龄段万古霉素血药浓度的分布情况 将87名病人按照年龄分成四组:15~<18岁组、18~60岁组、60~75岁组、>75岁组,比较万古霉素血药浓度差异。结果显示:仅15~<18岁组的血药浓度在治疗窗内,而18~60岁组、60~75岁组以及>75岁组的血药浓度均值均超出治疗窗。低于10μg/mL占比最高的是15~<18岁组,在10~20μg/mL之间占比最高的是60~75岁组,高于20μg/mL占比最高的是>75岁组。老年病人中,共监测万古霉素血药浓度62次,血药浓度低于治疗窗的仅占12.9%(8/62),高于治疗窗的占48.39%(30/62)。对不同年龄段内不同浓度分布范围进行比较,差异无统计学意义(χ2=8.156,P=0.227)。年龄段组间所监测的万古霉素浓度进行比较,各组间差异无统计学意义(F=1.351,P=0.259)。结果见表3。
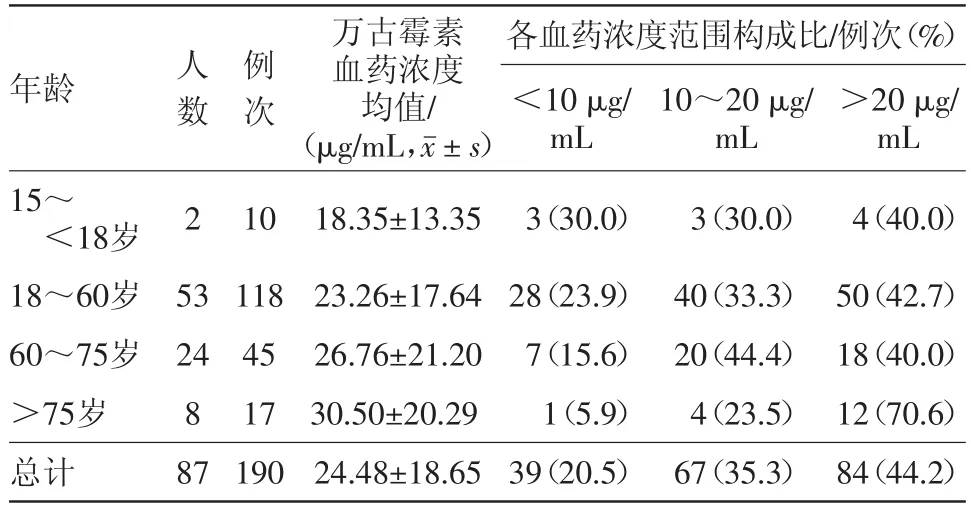
表3 万古霉素注射190例次不同年龄段病人血药浓度分布情况
2.6 肾功能变化 剔除16名行CRRT病人,按照Ccr将剩余71例病人分成四组,如表4所示。对肾功能不同组间的万古霉素浓度进行比较,差异有统计学意义(F=15.09,P<0.001);进一步观察同一肾功能下不同给药剂量对万古霉素血药浓度的影响,各组间均差异无统计学意义。结果见表4。
各组用药前后尿素氮、血肌酐、白蛋白以及肌酐清除率变化如表5所示。肾功能正常组用药后尿素氮显著高于用药前,差异有统计学意义(t=-2.183,P=0.038),肾功能轻度下降组用药后肌酐清除率显著高于用药前,差异有统计学意义(t=-2.205,P=0.048),其余各组肾功能指标在用药前后差异无统计学意义。结果见表5。
有15例万古霉素给药后发生急性肾损伤,发生率为21.13%(15/71);年龄为(51.80±19.55)岁,万古霉素血药浓度为(40.08±24.83)μg/mL,首次监测血药浓度为(36.95±27.09)μg/mL。
2.7 肾功能亢进病人血药浓度分布情况 肾功能亢进病人13例,发生率为18.31%(13/71)。肾功能亢进的病人的年龄范围是15~73岁,年龄为(50.46±20.59)岁,首次血药浓度为(9.91±4.81)μg/mL,达标率为38.46%(5/13)。
表4 万古霉素注射190例次不同肾功能组不同日剂量的血药浓度情况/±s

表4 万古霉素注射190例次不同肾功能组不同日剂量的血药浓度情况/±s
注:与肾功能正常组比较:a P<0.05,与肾功能轻度下降组比较:b P<0.05
正常轻度下降中度下降重度下降1 6.7 3±9.9 1 1 4.1 8±6.5 4 2 5.1 6±1 7.0 2_5 4 2 2 3 7 1 6 1 3.0 4±8.0 9 2 1.8 4±1 9.8 6 a 3 4.4 4±2 2.2 6 ab 3 6.1 4±2 0.3 3 ab 5 2 8 6 1 8.9 8±6.3 5 1 1.7 4±3.1 3 3 9.5 6±1 9.9 9 2 9.5 1±1 2.2 6 4 6 1 8 2 5 1 0 1 2.1 6±7.9 6 2 3.8 1±2 1.4 8 3 4.2 8±2 3.8 1 4 0.1 2±2 3.6 2 3 2 4 0
表5 不同肾功能71例用药前后肾功能指标变化/±s
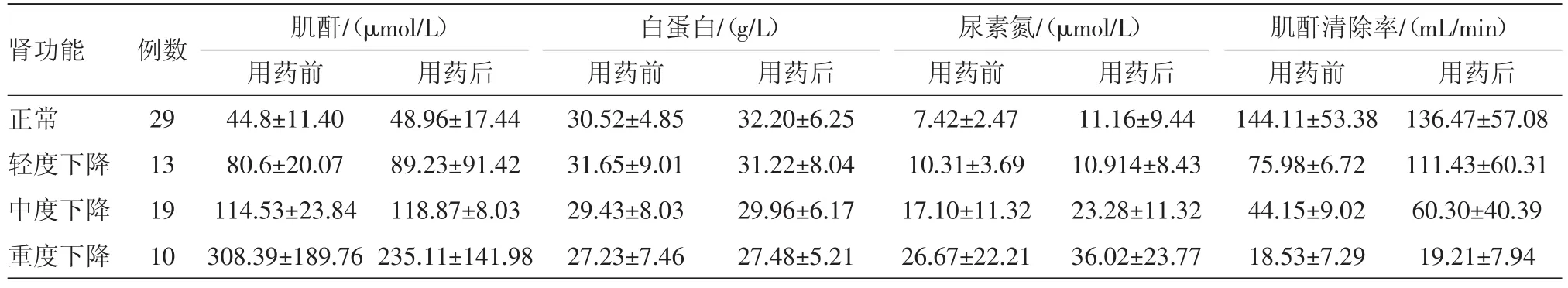
表5 不同肾功能71例用药前后肾功能指标变化/±s
肾功能正常轻度下降中度下降重度下降例数29 13 19 10肌酐/(μmol/L)白蛋白/(g/L)尿素氮/(μmol/L)肌酐清除率/(mL/min)用药前44.8±11.40 80.6±20.07 114.53±23.84 308.39±189.76用药后48.96±17.44 89.23±91.42 118.87±8.03 235.11±141.98用药前30.52±4.85 31.65±9.01 29.43±8.03 27.23±7.46用药后32.20±6.25 31.22±8.04 29.96±6.17 27.48±5.21用药前7.42±2.47 10.31±3.69 17.10±11.32 26.67±22.21用药后11.16±9.44 10.914±8.43 23.28±11.32 36.02±23.77用药前144.11±53.38 75.98±6.72 44.15±9.02 18.53±7.29用药后136.47±57.08 111.43±60.31 60.30±40.39 19.21±7.94
3 讨论
3.1 血药浓度监测人群 近年来,随着MRSA、MRCNS等耐药菌的检出率不断上升,万古霉素的使用率亦逐年增加,根据《万古霉素临床应用剂量中国专家共识》,推荐所有危重症病人均应行万古霉素血药浓度监测。但近三年本院重症监护室行万古霉素治疗的162例危重症病人中仅有87例病人进行了万古霉素血药浓度检测,检测率53.7%,该院没有充分发挥临床用药的监测作用,应当加强万古霉素血药浓度监测。
我们观察到,老年病人的万古霉素血药浓度结果在治疗窗的比例不足40%,其中低于治疗窗的占12.9%(8/62),高于治疗窗的占48.4%(30/62),该结果与何瑾等[6]、王延臣[7]研究结果相似。如表3所示,18~60岁组、60~75岁组、>75岁组的病人血药浓度均值均超出治疗窗,随着年龄的增加,平均血药浓度随之升高,可能由于老年人生理机能减退,机体对药物的吸收、分布、代谢及排泄能力下降,机体细胞膜结构变化,导致药物受体数目出现不同程度减少或受体亲和力发生改变,对药物的适应力降低,对多数药物敏感性增强[8-9]。因此,临床应重视重症病人中老年群体的万古霉素血药浓度监测,保证其用药的安全性和有效性。
3.2 万古霉素血药浓度分布情况 根据《中国万古霉素治疗药物监测指南》推荐,万古霉素的浓度应维持在10~20μg/mL。当万古霉素浓度<10μg/mL时,易增加诱导耐药风险,导致治疗失败;万古霉素浓度>20μg/mL时,肾损伤发生率显著增高[10]。本研究中,190例次万古霉素的血药浓度达标率不足40%,其原因之一可能是部分病人血药浓度的监测时机不合理,从而导致结果的不准确。对于肾功能正常的病人,建议在首次给药48 h后进行血药浓度监测,而肾功能不全病人,推荐首次给药72 h后开始血药浓度监测。此外,该结果提示该医院万古霉素血药浓度监测并未充分发挥其作用,作为临床药师,对万古霉素临床合理使用的指引和干预不够,并没有在病人治疗过程中根据血药浓度结果适时调整万古霉素给药方案,今后临床药师应更加高效、精准地参与并干预临床合理用药。
3.3 日剂量与万古霉素浓度分布情况 万古霉素常规推荐剂量是每天2 g,1 g每12小时。根据2011年美国感染病协会(IDSA)MRSA指南推荐,万古霉素给药剂量为每次15μg/mL(依据实际体质量计算),每8~12小时给药一次,单次剂量不超过2 g,日剂量一般不超过4 g。我们发现,对于肾功能正常的病人,使用常规推荐日剂量,平均血药浓度在治疗窗内,但是对于肾功能下降的病人,血药浓度大多不在治疗窗内。首次给药按照万古霉素常规推荐剂量给药的方案占比极大,达半数以上,但是达标率仅34.33%。这种常规的推荐剂量没有考虑危重症病人特殊的病理生理特点,比如低蛋白血症病人伴有毛细血管增加、组织水肿,使药物的表观分布容积显著增加,另外肾功能状态以及CRRT等支持治疗手段均能影响万古霉素的药物清除[11]。临床应综合考虑病人年龄、体质量、白蛋白及肌酐水平等指标,确定万古霉素初始剂量,后根据血药浓度结果、肾功能变化情况及时调整给药剂量,实现万古霉素个体化和精准化给药。
3.4 万古霉素血药浓度与肾功能 如表4所示,按照肾功能对病人进行分组,考察肾功能对万古霉素血药浓度的影响,结果提示随着病人肾功能水平的下降,万古霉素血药浓度结果呈上升趋势。考察同一肾功能水平下不同给药日剂量对于万古霉素血药浓度的影响发现,三种日剂量下,肾功能中度下降组和重度下降组血药浓度水平均超出治疗窗。结果表明病人肾功能对万古霉素血药浓度有影响,肾功能受损影响万古霉素药物的排泄,导致药物暴露量增加,从而增加病人万古霉素血药浓度。
在71例病人中,有15例病人发生急性肾损伤(acute kidney injury,AKI),发生率为 21.13%(15/71),该结果与Cheng 等[12]研究一致。2012年,改善全球肾脏预后(kidney disease improving global outcomes,KDIGO)工作组发布了KDIGO指南,将48 h内肌酐上升26.5μmol/L以上,尿量持续6 h少于0.5 mL·kg-1·h-1或7 d内肌酐水平增至基线1.5倍,诊断为急性肾损伤[13]。Elyasi等[14]认为,万古霉素氧化作用导致的肾小管缺血是导致其肾毒性的主要机制。研究发现,15例AKI病人的平均血药浓度较高,根据多项研究显示,万古霉素浓度是AKI发生的独立危险因素,浓度越大,对AKI预测的敏感性和特异性越强[15]。此外,这些病人较低的白蛋白水平也增加了发生AKI的可能,原因可能是低蛋白血症影响万古霉素的游离血药浓度,延长其半衰期,导致肾毒性发生率显著增加。
值得注意的是,在71例病人中,有13例肾功能亢进(augmented renal clearance,ARC)病人。肾功能亢进是指肾脏对药物的清除能力增强,CrCl>130 mL/min时考虑病人可能存在ARC,危重症病人中ARC的发生率为20%~65%[16]。本研究中,肾功能亢进的发生率为18.31%(13/71),发生率低于20%。Udy等[17]和 Campssi等[18]的研究表明,根据24 h或8 h尿肌酐计算Ccr是衡量ARC更精确的标准,血肌酐估算的Ccr预测ARC的敏感性和特异性分别是39.8%和90.8%,而本研究采用的是血肌酐,这说明某些Ccr正常的病人其实是ARC病人,这可能是本研究中肾功能亢进发生率较低的原因。Sime等[19]研究报道,ARC发生的风险因素包括年龄≤50岁、男性、脓毒症、创伤、序贯器官衰竭评分≤4分等。在本次研究中,ARC病人的平均年龄比整体病人的平均年龄偏低,说明较小的年龄发生ARC的风险较高,可能是低龄病人具有更好的基础肾脏及心脏状态,在急性疾病及应激状态出现时,更容易导致心输出量代偿性增加,肾血管灌注增加,继而发生ARC[20]。在其他研究中发现,ARC病人的平均年龄或中位年龄在34~50岁之间[21-22],但本研究ARC病人的平均年龄和中位年龄均在50岁以上,可能原因是本次ARC病人的样本数据较少(13例)所致。在13例ARC病人中,有53.85%(7/13)病人因创伤入院,在一些研究中,创伤也被描述为ARC发生的危险因素,由于肌酐是肌肉代谢的产物,在创伤的疾病早期,肌肉的高分解代谢会导致肌酐的急剧增加,代谢底物的增加致使肾小球对于肌酐的滤过率随之增加。此外,13例病人中,首次用药剂量均为每12小时1.0 g,但是首次血药浓度不达标率的占53.85%(7/13),该结果提示,ARC病人普遍存在万古霉素初始经验性用药剂量不足,万古霉素血药浓度均值明显低于整体血药浓度均值,这与Chu等[23]研究结果一致,由于病人肌酐清除率的增加,ARC病人的抗菌药物浓度难以到达治疗窗。因此对于肾功能亢进的危重症病人,需要早期给予更高剂量,根据血药浓度个体化用药,以达到目标靶浓度,确保临床疗效。
4 结论
总之,危重症病人应当加强万古霉素个体化用药,临床需综合病人的年龄、肾功能、基础疾病等情况更加审慎地确定初始剂量,并根据血药浓度结果及时调整用药剂量。此外,对于发生用药后发生AKI的病人,应及时停药;并尽早识别ARC病人,对于ARC病人应当提高万古霉素血药浓度监测水平,并扩大对于ARC病人的研究样本,使ARC病人个体化用药疗效加强,提高治愈率,使万古霉素临床用药更加安全、有效、经济。
