柴胡疏肝散调节大鼠额叶环磷酸腺苷/环磷酸腺苷反应元件结合蛋白/脑源性神经营养因子信号通路发挥抗抑郁作用研究
2020-04-16张付民刘俊
张付民,刘俊
近年来,随着人们生活节奏的加快,抑郁症发病率逐年上升,据世界卫生组织(WHO)统计,全球范围内约有4.3%的人患有抑郁症,而中国的抑郁症发病率高达5%~6%,并且发病率呈逐年上升趋势[1-3]。抑郁症会对人们的生活和工作造成严重影响,据统计抑郁及焦虑障碍每年可导致超过一万亿美元的经济损失,因此,抑郁症已日益凸显为社会和医疗问题[4-5]。但目前尚无治疗抑郁症的理想药物,因此亟待解决。抑郁症多属于中医“郁证”范围,治疗多以疏肝解郁为主。柴胡疏肝散出自《景岳全书》,为疏肝解郁的代表方剂,是现代临床治疗抑郁症的经典方和有效方[6-7]。现代药理研究也证明柴胡疏肝散具有抗抑郁、调节神经-内分泌-免疫网络、抗炎、抗氧化应激等药理作用[8]。相关研究发现前额叶皮层(Prefrontal cortex,PFC)中环磷酸腺苷/环磷酸腺苷反应元件结合蛋白/脑源性神经营养因子(cAMP/CREB/BDNF)信号通路失调是引起抑郁症发病的重要机制[9-10]。但柴胡疏肝散是否可以通过调节cAMP/CREB/BDNF信号通路进而发挥抗抑郁作用尚不明确。基于此,本实验通过慢性不可预知温和应激(Chronic unpredictable mild stress,CUMS)建立抑郁症模型,用Real time-PCR和蛋白质印迹法检测cAMP/CREB/BDNF信号通中关键因子cAMP、CREB、BDNF的基因和蛋白的表达,以期为柴胡疏肝散改善抑郁症提供实验依据。本研究自2017年1月至2018年10月研究柴胡疏肝散对CUMS抑郁症模型大鼠的抗抑郁作用及其作用机制是否与cAMP/CREB/BDNF信号通路有关。
1 材料
1.1 动物 SPF级雄性SD大鼠,40只,6~8周龄,体质量为200~220 g,由湖北省实验动物研究中心提供,许可证号:SCXK(鄂)2015-0018。饲养于独立通气笼系统,湿度控制为40%~50%,温度控制为24℃~26℃。
1.2 主要药品及试剂 草酸艾司西酞普兰片,生产批号2557798,西安杨森制药有限公司;柴胡疏肝散由陈皮、柴胡各6 g,川芎、香附、枳壳、白芍各4.5 g,炙甘草1.5 g组成,饮片购自恩施州中心医院中药房。TRIzol Reagent,生产批号15596026,美国Thermo Scientific;ReverTra Ace qPCR RT Master Mix逆转录酶试剂盒,上海基屹生物科技有限公司,生产批号 FSQ-201;SYBR Premix Ex Taq[TM],大连 Takara公司,生产批号 RR820A;一抗:cAMP、BDNF、CREB,均为兔多克隆抗体,生产批号分别为:sc-66843、sc-20981、sc-58,美国Santa Cruz公司。二抗,HRP标记山羊抗兔抗体(1∶3 000),武汉艾美捷科技有限公司,生产批号111-035-003。
1.3 主要仪器 Lumi Station 1800型多功能酶标仪(上海闪谱生物科技有限公司)、PPSQ-31A型核酸蛋白分析仪(德国岛津科学仪器有限公司)、QuantStudio Dx型实时荧光定量PCR扩增仪(美国Life Technologies公司)、ChemiScope 6000 Exp型凝胶图像成像分析系统(海勤翔科学仪器有限公司)。
2 方法
2.1 动物分组 适应性饲养1周后,采用SPSS19.0生成随机数字表,将40只大鼠随机分为空白组、模型组、艾司西酞普兰组和柴胡疏肝散组,每组10只,除空白组外,其他各组采用CUMS制备抑郁症大鼠模型。空白组大鼠以每笼5只饲养,其他各组大鼠采用单笼饲养。本研究获得恩施州中心医院实验动物伦理委员会批准,并严格执行伦理委员会的要求。
2.2 抑郁症模型的建立及给药 参考文献[11]制作抑郁症模型:抑郁症造模采用CUMS法,CUMS包括9种方法:冰水刺激(4℃)、热水刺激(45℃)、足底电刺激(2 mA)、潮湿垫料(24 h)、禁食(24 h)、禁水(24 h)、睡眠剥夺(24 h)、水平震荡、氨水刺激,上述9种刺激法随机排列,相同刺激不可连续出现,连续刺激8周。第5~8周进行灌胃,持续给药4周,艾司西酞普兰组大鼠按10.0 mg·kg-1·d-1的剂量灌胃草酸艾司西酞普兰片,柴胡疏肝散组按2.8 g·kg-1·d-1的剂量灌胃柴胡疏肝散药液,空白组和模型组灌胃等体积的生理盐水,1次/天。
2.3 指标检测
2.3.1 蔗糖偏好实验 实验前先做适应性训练,第1天,鼠笼上放置一瓶2%的蔗糖溶液和一瓶等体积的清水,禁食禁水24 h后,再次在鼠笼上放置一瓶2%的蔗糖溶液和一瓶等体积的清水,测试24 h,称量并计算糖水偏好率。

2.3.2 强迫游泳实验 自制上方开口的圆柱形玻璃容器(直径50 cm,高60 cm),向容器注水至30 cm,将实验大鼠置于容器中,记录大鼠5 min内不动的总时间。
2.3.3 旷场实验实验 将实验大鼠置于不透明钢板制成(100 cm×100 cm×40 cm)的矿产箱内,打开摄像机拍摄,使用Smart virsion 2.5软件记录大鼠5 min内行为,记录5 min内大鼠的活动路程、活动时间、休息时间、中央区域穿越格数及活动轨迹。
2.3.4 PFC区尼氏染色实验 行为学检测完毕后,选取部分大鼠进行PFC区尼氏染色:先用8%水合氯醛经腹腔注射麻醉(4 mL/kg),待麻醉好后,用4%多聚甲醛溶液经心脏灌注,端头取脑,取PFC区,置4%多聚甲醛固定24 h,用尼氏染色观察各组大鼠PFC区病理形态变化。
2.3.5 Realtime-PCR 检测 PFC中 cAMP、BDNF、CREB mRNA的表达水平 取血后冰上剥离PFC,置液氮速冻后移至-80℃冰箱保存。用Trizol法提取PFC总mRNA,提取过程参考Trizol说明书;提取后用核酸蛋白仪检测RNA纯度,读数为1.8~2.0表示提取合格;用ReverTra Ace qPCRRTMaster Mix逆转录酶试剂盒逆转录合成cDNA,合成过程参考说明书;用 SYBR Premix Ex Taq[TM]试剂进行 PCR 反应,置PCR仪进行基因扩增。用2-△△Ct表示mRNA相对表达水平。cAMP、CREB、BDNF及内参β-actin序列见表1。

表1 引物序列
2.3.6 蛋白质印迹法检测PFC中cAMP、BDNF、CREB的蛋白表达水平 称取PFC区脑组织20 mg,加入预冷的RIAP裂解液和PMSF,置4℃组织研磨机研磨,充分研磨后,置4℃离心机,以12 000 r/min离心20 min,取上清,用BCA蛋白质试剂盒检测各样本蛋白浓度;参考SDS-PAGE凝胶试剂盒说明书制作SDS-PAGE凝胶,依次加样、电泳、转膜;稀释一抗,并按抗体说明书孵育一抗 cAMP(1∶1 000)、CREB(1∶2 000)和BDNF(1∶3 000),置4 ℃冰箱过夜,TBST洗膜3次,加入二抗(1∶3 000),再次用TBST洗膜3次,ECL显色。最后置于凝胶图像成像分析系统,曝光各组蛋白条带,拍照,读取灰度值,并进行统计分析。
2.4 统计学方法 采用统计软件SPSS19.0处理,实验数据以±s表示,组间比较采用单因素方差分析,方差齐性时,多组间比较采用LSD法,P<0.05差异有统计学意义,方差不齐时,多组间比较采用Dunnett’s T3法,P<0.05差异有统计学意义。
3 结果
3.1 蔗糖偏好实验和强迫游泳实验结果 与空白组比较,模型组大鼠糖水偏好率显著下降(P=0.000),强迫游泳不动时间明显增加(P=0.000),均差异有统计学意义(P<0.01)。与模型组比较,艾司西酞普兰组大鼠糖水偏好率增加(P=0.028),强迫游泳不动时间减少(P=0.019),柴胡疏肝散组大鼠糖水偏好率也有所增加(P=0.031),强迫游泳不动时间则有不同程度减少(P=0.012),均差异有统计学意义,见表2。
表2 柴胡疏肝散对慢性不可预知温和应激(CUMS)大鼠糖水偏好率和强迫游泳实验的影响/±s

表2 柴胡疏肝散对慢性不可预知温和应激(CUMS)大鼠糖水偏好率和强迫游泳实验的影响/±s
注:与空白组比较,a P<0.01;与模型组比较,b P<0.05
组别空白组模型组艾司西酞普兰组柴胡疏肝散组不动时间/s 35.25±13.23 64.39±10.62a 50.35±16.49b 47.93±18.71b只数10 10 10 10糖水偏好率/%86.42±14.55 60.75±15.63a 74.97±8.33b 77.39±18.39b
3.2 旷场实验结果 与空白组比较,模型组大鼠运动距离和穿越中央区域次数显著减少(均P=0.000),静止时间显著增加(P=0.000),均差异有统计学意义(P<0.01)。与模型组比较,艾司西酞普兰组大鼠运动距离和穿越中央区域次数增加(P=0.000,P=0.012),静止时间减少(P=0.000),柴胡疏肝散组大鼠运动距离和穿越中央区域次数增加(P=0.000,P=0.011),静止时间减少(P=0.028),均差异有统计学意义,见表3。
3.3 尼氏染色结果 空白组大鼠PFC区神经元数目丰富,细胞形态饱满,结构完整,边缘清晰,尼氏体呈浅蓝色,多为虎斑状或细颗粒状,树突明显。模型组大鼠PFC区神经元数目减少,细胞形态不规则,排列稀疏,尼氏小体颜色较深,尼氏小体数目减少,部分尼氏体出现固缩和深染,树突数目减少或消失。艾司西酞普兰组和柴胡疏肝散组尼氏小体固缩和深染减轻,结构较完整、清晰,树突减少情况好转。
表3 柴胡疏肝散对慢性不可预知温和应激(CUMS)大鼠在旷场试验中自主活动的影响/±s

表3 柴胡疏肝散对慢性不可预知温和应激(CUMS)大鼠在旷场试验中自主活动的影响/±s
注:与空白组比较,a P<0.01;与模型组比较,b P<0.05,c P<0.01
组别空白组模型组艾司西酞普兰组柴胡疏肝散组静止时间/s 51.58±15.18 83.55±13.87a 62.64±12.85c 66.75±16.15b例数10 10 10 10运动距离/cm 654.32±67.74 400.29±40.24a 535.99±47.61c 502.59±36.13c穿越中央区域次数19.34±3.51 11.56±4.92a 16.33±4.61b 15.68±3.56b
3.4 Real time-PCR检测结果 与空白组比较,模型组大鼠PFC中cAMP、CREB、BDNFmRNA表达水平明显降低,均差异有统计学意义(均P=0.000)。与模型组比较,艾司西酞普兰组大鼠PFC中cAMP、CREB、BDNF mRNA表达水平升高(均P=0.000),柴胡疏肝散组大鼠PFC中cAMP、CREB、BDNF mRNA表达水平亦有升高(P=0.024,P=0.000,P=0.000),见表4。
表4 各组大鼠前额叶皮层中cAMP、CREB、BDNFmRNA表达水平/± s

表4 各组大鼠前额叶皮层中cAMP、CREB、BDNFmRNA表达水平/± s
注:cAMP为环磷酸腺苷,CREB为环磷酸腺苷反应元件结合蛋白,BDNF为脑源性神经营养因子;与空白组比较,a P<0.01;与模型组比较,b P<0.05,c P<0.01
BDNFmRNA 0.79±0.16 0.40±0.13a 0.61±0.21c 0.64±0.26c组别空白组模型组艾司西酞普兰组柴胡疏肝散组例数10 10 10 10 cAMPmRNA 0.81±0.28 0.37±0.16a 0.69±0.18c 0.53±0.16b CREBmRNA 0.95±0.22 0.43±0.18a 0.73±0.22c 0.79±0.15c
3.5 蛋白质印迹法检测结果 与空白组比较,模型组大鼠 PFC中 cAMP、CREB、BDNF蛋白(0.28±0.13)、(0.41±0.15)、(0.43±0.11)表达水平明显降低,均差异有统计学意义(均P=0.000)。与模型组比较,艾司西酞普兰组大鼠PFC中cAMP、CREB、BDNF蛋白(0.44±0.11)、(0.55±0.14)、(0.63±0.21)表达水平升高(P=0.000,P=0.023,P=0.000),柴胡疏肝散组大鼠PFC中cAMP、CREB、BDNF蛋白(0.47±0.27)、(0.59±0.11)、(0.58±0.15)表达水平亦有升高(P=0.000,P=0.011),均差异有统计学意义,见表5和图1。
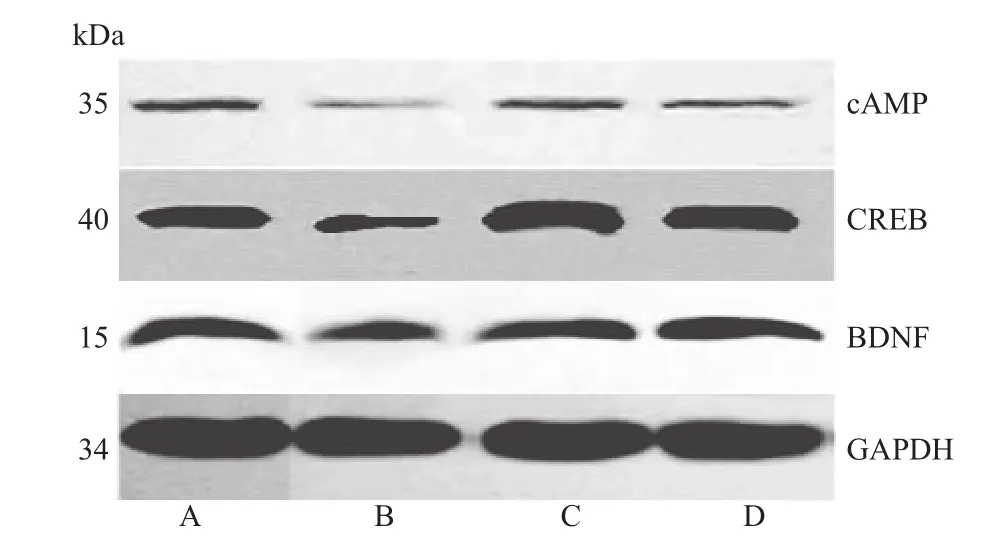
图1 各组大鼠前额叶皮层(PFC)中cAMP、CREB、BDNF的蛋白条带:A为空白组,B为模型组,C为艾司西酞普兰组,D为柴胡疏肝散组
表5 各组大鼠前额叶皮层中cAMP、CREB、BDNF的灰度值分析/± s
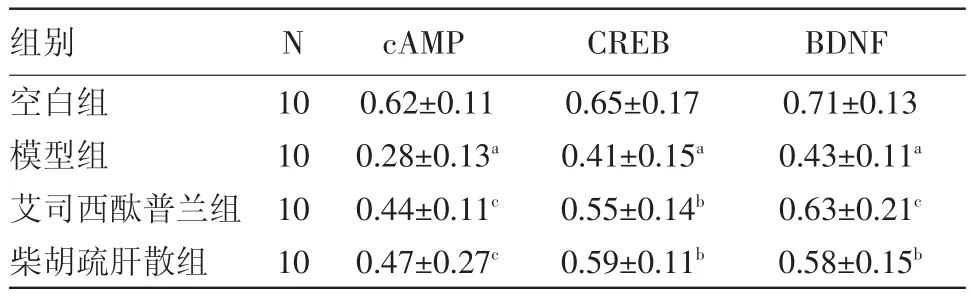
表5 各组大鼠前额叶皮层中cAMP、CREB、BDNF的灰度值分析/± s
注:cAMP为环磷酸腺苷,CREB为环磷酸腺苷反应元件结合蛋白,BDNF为脑源性神经营养因子;与空白组比较,a P<0.01;与模型组比较,b P<0.05,c P<0.01
BDNF 0.71±0.13 0.43±0.11a 0.63±0.21c 0.58±0.15b组别空白组模型组艾司西酞普兰组柴胡疏肝散组N 10 10 10 10 cAMP 0.62±0.11 0.28±0.13a 0.44±0.11c 0.47±0.27c CREB 0.65±0.17 0.41±0.15a 0.55±0.14b 0.59±0.11b
4 讨论
抑郁症是以显著而持久的心境低落为主要临床特征的精神类疾病,其症状与中医的“郁证”“百合病”“脏躁”“梅核气”等病证相近[12]。中医学认为其病位主要在肝,肝气郁结为其基本病机,治疗当以疏肝解郁为主[13]。柴胡疏肝散为疏肝解郁的代表方剂,出自《景岳全书》。方中柴胡疏肝解郁,为君药。香附疏肝理气止痛,川芎行气活血止痛,为臣药。陈皮、枳壳理气行滞,芍药养血柔肝缓急止痛,为佐药。甘草调和诸药,为使药[14]。近年来,学者多从调节脑内单胺类神经递质的含量和脑源性神经营养因子表达水平等方面来研究柴胡疏肝散的抗抑郁作用[15-17],但学者对其神经可塑性、神经再生和细胞信号通路等方面的研究较少,基于此,本研究将神经可塑性作为研究柴胡疏肝散抗抑郁作用的研究对象。
快感缺失是抑郁症病人的核心行为表现,因此抑郁症动物模型是否存在快感缺失就成为评价抑郁症造模成功与否的重要评价指标[18]。本研究采用经典的CUMS法诱导建立抑郁症模型,通过应用蔗糖偏好实验、强迫游泳实验和旷场实验等经典动物抑郁样状态评价方法,我们发现模型组大鼠糖水偏好率、运动距离和穿越中央区域次数显著减少(P<0.01),强迫游泳不动时间和静止时间显著增加(P<0.01),这说明本实验成功通过CUMS诱导建立了抑郁症大鼠模型。给予模型大鼠柴胡疏肝散组后,大鼠糖水偏好率、运动距离和穿越中央区域次数均有所增加(P<0.01,P<0.05),强迫游泳不动时间和静止时间均有所减少(P<0.01,P<0.05),这说明柴胡疏肝散具有抗抑郁的作用。
大脑是人体控制情绪的核心部位,情绪的变化是大脑各个分区协同作用的结果。PFC是工作记忆和情绪控制的核心脑区[19]。脑的功能影像和脑刺激研究表明抑郁症病人PFC区有明显的病理性改变,这说了PFC与抑郁症的密切关系[20-21]。本研究发现模型组大鼠PFC区神经元数目减少,细胞形态不规则,排列稀疏,尼氏小体颜色较深,尼氏小体数目减少,部分尼氏体出现固缩和深染,树突数目减少或消失。而给予模型大鼠柴胡疏肝散后,大鼠尼氏小体固缩和深染减轻,结构较完整、清晰,树突减少情况好转,这说明柴胡疏肝散具有神经保护的作用。cAMP/CREB/BDNF信号通路是影响抑郁症发病机制的重要信号转导通路[22]。腺苷酸环化酶(AC)活化会催化三磷酸腺苷(ATP)生产cAMP,cAMP会激活促使蛋白激酶A(PKA)激活,PKA激活会使其下游靶标环磷腺苷反应元件结合蛋白(CREB)磷酸化,CREB磷酸化从而促进了BDNF的表达,最终发挥生物学效应[23-24]。本研究发现,模型组大鼠PFC中cAMP、CREB、BDNF的基因和蛋白表达水平降低(P<0.01,P<0.05),这说明应激可以抑制cAMP/CREB/BDNF信号通路的表达,而给予模型大鼠柴胡疏肝散后,大鼠PFC中cAMP、CREB、BDNF的基因和蛋白表达升高(P<0.01,P<0.05),这说明柴胡疏肝散可以上调cAMP/CREB/BDNF信号通路
综合上述分析,柴胡疏肝散具有抗抑郁的作用,并有保护神经的作用,其机制可能与其上调cAMP/CREB/BDNF信号通路有关。
中药抗抑郁具有疗效确切、服用方便、毒副作用小等优点,但我国对中药抗抑郁的机制研究仍不够细致深入,因此本研究也为中药抗抑郁的研究提供了一定的经验[25]。
