肾气丸对缺血再灌注损伤小鼠肾细胞凋亡的作用及机制研究
2020-04-16赵峰綦海燕肖程程蒋楠吴帅
赵峰,綦海燕,肖程程,蒋楠,吴帅
急性肾损伤(acute kidney injury,AKI)是一种常见且危重的临床疾病,发生在约5%的住院病人中,总死亡率在45%~70%之间[1-3]。而肾缺血再灌注(ischemiareperfusion,I/R)损伤是急性肾损伤的主要病因之一,常发生于肾移植、肾动脉栓塞及休克病人[4-6]。研究表明,细胞内活性氧(reactive oxygen species,ROS)、促炎性细胞因子和促凋亡因子在肾I/R损伤中起重要作用[7-8]。肾气丸出自《金匮要略》,具有温补肾阳的功效。研究表明肾气丸具有抗生精细胞、肝细胞凋亡的作用[9-10],但其对肾脏I/R损伤的保护作用及机制尚不明确。本研究于2018年4—7月研究肾气丸在小鼠I/R诱导的急性肾损伤中的保护作用及机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 8周龄健康雄性C57BL6小鼠40例,清洁级,体质量20~25 g,购于北京华阜康生物科技股份有限公司。过程中对动物的处置严格遵守2006年科学技术部发布的《关于善待实验动物的指导性意见》。
1.1.2 药品与试剂 肾气丸中所含中药饮片均一次性购于青岛市中医医院门诊中药局。制备:中药浸泡2 h,第1煎200 mL,30 min,取汁;第2煎200 mL,20 min,取汁;第3煎200 mL,20 min,取汁。将3次所煎取的药液混合,浓缩至100%浓度,即1 g/mL。血清肌酐(SCr)、尿素氮(BUN)测试盒,购自上海微蒙生物科技有限公司;丙二醛(MDA)、超氧化物歧化酶(SOD)试剂盒均购自南京建成生物制品公司;β-actin,Bcl-2和Caspase-3购自艾博抗上海贸易有限公司。磷脂酰肌醇3-激酶(P13K)、蛋白质丝氨酸苏氨酸激酶信号通路(AKT)抗体购自Cell signaling tecnology公司,二抗购自Santacrus公司。
1.2 分组与模型建立
1.2.1 分组 将小鼠在20℃~26℃实验室喂养2 d,利用随机数字表法分为4组,每组10例:①假手术组;②肾缺血再灌注组(肾I/R组);③肾气丸低剂量组;④肾气丸高剂量组。肾气丸低剂量组和高剂量组均给予肾气丸中药液灌胃,每天剂量分别为10.5 g/kg和21.0 g/kg,治疗持续2周[11]。假手术组和肾I/R组使用生理盐水进行灌胃,2周后构建肾I/R损伤的小鼠模型。
1.2.2 模型建立 本次实验构建肾I/R损伤模型,10%水合氯醛腹腔麻醉,剖腹手术,游离双侧肾蒂。肾I/R组和肾气丸组(低剂量组和高剂量组)小鼠夹闭双侧肾蒂,夹闭时间为30 min,之后摘掉动脉夹以恢复肾组织血流的灌注,再对小鼠腹壁进行缝合[12-14]。假手术组开腹并游离双侧肾蒂但不夹闭血管,其余操作相同。肾组织血流再灌注24 h后,对各组小鼠进行腹主动脉采血,分离并提取血清,各组标本分别保存在冰箱中,待检测血清Scr、BUN含量。然后摘取左肾,仔细剪除附着的脂肪组织和筋膜,一部分迅速置于-80℃冰箱中保存,另一部分固定液经固定后,常规石蜡包埋。
1.3 检测方法
1.3.1 肾组织匀浆制备 制备匀浆前除去组织血液,用滤纸吸干,准确称重。将干净、干燥的匀浆管置于冰水混合物中,把组织块放于匀浆管中,做到尽快剪碎组织,然后按1∶9(W/V)加入冰生理盐水,进行组织匀浆。而后将匀浆移入干燥试管,置于4℃离心机中,以3 000 r/min的速度离心10 min。取上清液储存待测。
1.3.2 生化检查 Scr、BUN、MDA含量及SOD活性检测,以上指标均按照相应试剂盒说明书进行检测。
1.3.3 HE染色 取称量后的左侧肾组织,于4%的多聚甲醛溶液中固定72 h后经石蜡包埋、切片(厚度为5μm)、脱蜡水化处理后行常规苏木精-伊红(hematoxylin-eosin staining,HE)染色,使用倒置光学显微镜对各组小鼠肾组织的病理形态进行观察并评估损伤程度。
1.3.4 TUNEL染色 石蜡组织切片经脱蜡水化处理后,修复抗原37℃与Proteinase K作用,封闭非特异性反应加上胎牛血清和小牛血清白蛋白,用PBS漂洗,加入TUNEL缓冲液,PBS漂洗,给予3%甲醇溶液对内源性过氧化物酶进行阻断,PBS漂洗,再次封闭非特异性抗原加入羊血清,使用PBS进行漂洗,加1∶2稀释的POD,PBS进行漂洗,使用DAB显色及苏木精衬染,采用光学显微镜观察标本,细胞核黄染为阳性着色
1.3.5 PCR及免疫组化检测Bcl-2、Caspase-3表达水平 RNA提取试剂盒提取组织总RNA,各组取等量RNA进行反转录,通过PCR扩增Bcl-2、Caspase-3及内参β-actin的cDNA。每个检测点设3个平行反应管,以cDNA为模板对Bcl-2、Caspase-3基因进行定量PCR扩增。引物序列如下:Bcl-2,正向5′-GCCATATGGCGCACGCTGGGAGAA-3′,反向 5′-GCGCTCGAGTCACTTGTGGCCCAGATA-3′;Caspase-3,正向5′-TGGACCTGTTGACCTGAAA-3′,反向5′-ACAAAGCGACTGGATGAACC-3′;β-actin,正向5′-CTGAGAGGGAAATCGTGCGT-3′,反向5′CCACAGGATTCCATACCCAAGA-3′。根据各反应管的靶基因循环阈值(Ct)和内参基因Ct值,采用比较Ct值法(2-ΔΔCt)计算E-Bcl-2、Caspase-3水平。
1.3.6 蛋白质印迹法检测PI3K、AKT蛋白表达组织蛋白的提取 将标本储存于-80℃低温冰箱中,在蛋白提取前,先对标本进行称重,每100 mg组织中加入1 mL RIPA,加入1 0μL PMSF,组织匀浆,低温离心15 min,10 000~14 000 r/min,取上清加入5×蛋白上样缓冲液,煮沸5 min分装,-70℃保存,现用现取。将蛋白提取以后,进行灌胶上样,加样后先使用恒流(10 mA),再使用恒压(100 V)电泳至溴酚蓝到凝胶的底部。至电泳结束以后,把凝胶移到PVDF膜上,转移使用100 V电压,时间2 h。上述操作结束后,把PVDF膜转移到平皿中,其内含有封闭液,在室温条件下,于摇床上摇动封闭2 h。取出PVDF膜,加入稀释后的一抗(1∶1 000)冰箱里4℃过夜。然后在室温条件下,使用TBST脱色摇床上洗涤3次,每次时间10 min。然后加入1∶1 000比例稀释的辣根酶标记羊抗兔IgG抗体,在室温下进行孵育,时间1 h,再使用TBST脱色摇床上洗涤5次,每次时间10 min。其后在PVDF膜上滴加显色剂,进行显色照相。最后用quantity one软件对条带进行分析。
1.4 统计学方法 用SPSS23.0统计学软件进行统计分析。计量资料采用±s表示,多组间比较采用单因素方差分析,多组间两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 肾气丸对BUN和Scr含量的影响 与假手术组比较,肾I/R组肾功能受损明显,BUN和Scr含量均增高,差异有统计学意义(P<0.05)。与I/R组比较,肾气丸组(低剂量组和高剂量组)BUN和Scr含量降低,差异有统计学意义(P<0.05)。与肾气丸低剂量组比较,肾气丸高剂量组中BUN和Scr含量降低,差异有统计学意义(P<0.05),见表1。
表1 C57BL6小鼠Scr、BUN的比较/±s
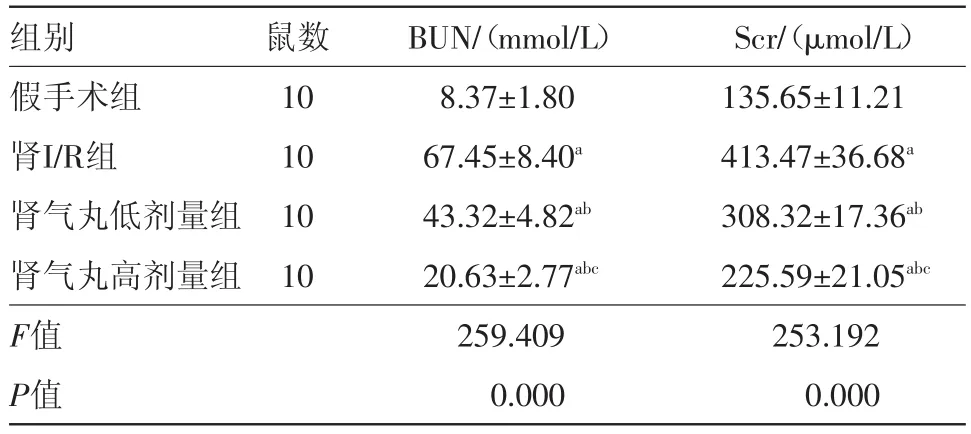
表1 C57BL6小鼠Scr、BUN的比较/±s
注:BUN为尿素氮,Scr为血清肌酐。与假手术组比较,a P<0.05;与肾I/R组比较,b P<0.05;与肾气丸低剂量组比较,c P<0.05
Scr/(μmol/L)135.65±11.21 413.47±36.68a 308.32±17.36ab 225.59±21.05abc 253.192 0.000组别假手术组肾I/R组肾气丸低剂量组肾气丸高剂量组F值P值鼠数10 10 10 10 BUN/(mmol/L)8.37±1.80 67.45±8.40a 43.32±4.82ab 20.63±2.77abc 259.409 0.000
2.2 肾气丸对MDA含量及SOD活性的影响 肾I/R组和肾气丸组(低剂量组和高剂量组)中肾组织SOD活性均低于假手术组(P<0.05),MDA含量高于假手术组(P<0.05),均差异有统计学意义;与肾I/R组相比,肾气丸组(低剂量组和高剂量组)SOD活性升高(P<0.05),MDA含量减少(P<0.05),差异有统计学意义;与肾气丸低剂量组比较,肾气丸高剂量组中SOD活性升高(P<0.05),MDA含量减少,差异有统计学意义(P<0.05),见表2。
表2 C57BL6小鼠MDA、SOD的比较/±s
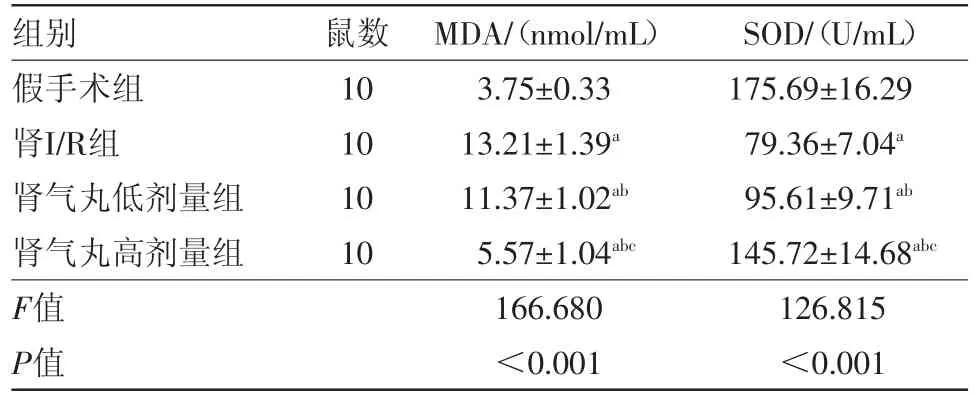
表2 C57BL6小鼠MDA、SOD的比较/±s
注:MDA为血清丙二醛,SOD为超氧化物歧化酶;与假手术组比较,a P<0.05;与肾I/R组比较,b P<0.05;与肾气丸低剂量组比较,c P<0.05
SOD/(U/mL)175.69±16.29 79.36±7.04a 95.61±9.71ab 145.72±14.68abc 126.815<0.001组别假手术组肾I/R组肾气丸低剂量组肾气丸高剂量组F值P值鼠数10 10 10 10 MDA/(nmol/mL)3.75±0.33 13.21±1.39a 11.37±1.02ab 5.57±1.04abc 166.680<0.001
2.3 各组肾I/R小鼠肾组织结构的比较 HE染色显示,假手术组小鼠肾组织结构完整、肾小管结构清晰、肾间质无水肿、管腔无管型;与假手术组比较,肾I/R组小鼠肾小管结构出现上皮细胞水肿、脱落、小管结构肿胀、小管腔凝固坏死等病变;肾气丸低剂量和高剂量组小鼠肾细胞组织损伤程度减轻,肾小管的上皮细胞肿胀、脱落及凝固坏死等病变损伤减轻,高剂量组较低剂量组损伤程度更轻。TUNEL染色显示,与假手术组比较,肾I/R组、肾气丸低剂量和高剂量组细胞凋亡增加;与肾I/R组比较,肾气丸低剂量和高剂量组细胞凋亡减轻,且高剂量组细胞凋亡程度更轻,见图1。
2.4 PCR及免疫组化检测Bcl-2、Caspase-3表达水平 与假手术组比较,肾I/R组小鼠的Bcl-2表达降低[(1.96±0.18)比(0.61±0.09)],Caspase-3表达增高[(0.45±0.06)比(1.76±0.19)];与肾I/R组比较,肾气丸低剂量和高剂量组小鼠的Bcl-2表达增高[(0.61±0.09)比(0.94±0.11)、(1.52±0.16)],Caspase-3表达降低[(1.76±0.19)比(1.35±0.16)、(0.89±0.11)];与肾气丸低剂量比较,肾气丸高剂量组小鼠的Bcl-2表达增高[(0.94±0.11)比(1.52±0.16)],Caspase-3表达降低[(1.35±0.16)比(0.89±0.11)],见图2~4。
2.5 各组肾组织中PI3K、AKT蛋白表达测定 蛋白质印迹法(Western blot)蛋白含量检测显示,与假手术组组比较,肾I/R组PI3K、AKT蛋白表达均显著降低[(0.81±0.09)比(0.09±0.01),(0.86±0.11)比(0.11±0.01),P<0.05];与肾I/R组比较,肾气丸组PI3K、AKT蛋白表达升高,差异有统计学意义[(0.09±0.01)比(0.23±0.02)比(0.45±0.05),(0.11±0.01)比(0.27±0.03)比(0.53±0.06),P<0.05];与肾气丸低剂量组比较,肾气丸高剂量组中PI3K、AKT蛋白表达升高,均差异有统计学意义[(0.23±0.02)比(0.45±0.05),(0.27±0.03)比(0.53±0.06),P<0.05],见图5。
3 讨论
肾缺血再灌注损伤是急性肾损伤(AKI)的主要病因,目前没有可靠有效的治疗方法改善预后及降低死亡率[15-16]。肾I/R损伤的有多种发病机制,其中肾组织中氧自由基等活性氧的增多是导致肾I/R损伤的主要原因之一,在疾病发生、发展的过程中起到重要作用[17]。当机体发生肾I/R时,会产生大量氧自由基,同时,机体清除氧自由基的能力下降,导致氧自由基大量堆积,从而诱导细胞凋亡,最终导致机体组织功能障碍[18-19]。超氧化物歧化酶(SOD)和丙二醛(MDA)是抗氧化机制中两个非常重要的衡量指标[20-21]。在损伤过程中细胞凋亡的发生亦十分关键,相关因子Bcl-2、Caspase-3均参与其中,并且,研究发现Bcl-2可激活促凋亡因子Caspase-3等其它因子,引起凋亡的发生[22]。
肾气丸出自《金匮要略》,是治疗肾气亏虚证的经典方,具有阴阳双补、肾虚得复、元气充足等功效,能够延缓损伤、激活组织器官功能。研究发现肾气丸可减少肝细胞的脂性凋亡及抗生精细胞凋亡[9-10]。本研究发现,与假手术组比较,肾I/R损伤组小鼠肾组织中SOD活性显著降低,MDA含量显著升高;与肾I/R损伤组比较,肾气丸低、高剂量组小鼠肾组织中SOD活性显著升高,MDA含量显著降低,表明经肾气丸干预后,可提高肾组织细胞对ROS的清除能力,结果提示肾气丸可能通过抑制肾组织细胞的氧化应激,从而对肾I/R损伤具有保护作用。并且,通过HE及TUNEL染色表明,与肾I/R组相比,肾气丸低剂量和高剂量组小鼠肾细胞组织损伤程度减轻,肾小管的上皮细胞肿胀、脱落及凝固坏死等病变损伤减轻,高剂量组较低剂量组损伤程度更轻。结果提示肾气丸可有效抑制肾组织细胞损伤及凋亡。免疫组化可见,与假手术组比较,肾I/R组小鼠的Bcl-2表达降低,Caspase-3表达增高;与肾I/R组比较,肾气丸低剂量和高剂量组小鼠的Bcl-2表达增高,Caspase-3表达降低;与肾气丸低剂量比较,肾气丸高剂量组小鼠的Bcl-2表达增高,Caspase-3表达降低。本研究结果提示肾气丸可抑制氧化应激反应,降低肾组织细胞凋亡,减轻小鼠I/R诱导的急性肾损伤,从而为临床使用肾气丸治疗急性肾损伤治疗提供了坚实的理论基础。
P13K/Akt信号通路在细胞生长、发育、分化和凋亡等生理过程中发挥重要作用。经过活化的P13K通过激活Akt,进而调控下游的多条信号通路,如Caspase、Bax/Bcl-2等信号通路,产生级联反应,参与细胞的多种生理过程[23]。其中,作为P13K/Akt信号通路的下游,Bcl-2是常见的抗凋亡蛋白[24],Caspase-3作为核心关键酶参与细胞凋亡级联反应,Caspase-3酶的水解活性超细蛋白作用可直接诱导细胞凋亡,并能损伤DNA加速凋亡[25-26]。本研究发现,肾I/R损伤后,小鼠肾组织中PI3K和AKT蛋白表达水平显著下降;与肾I/R损伤组比较,肾气丸低、高剂量组小鼠肾组织中PI3K和AKT蛋白水平显著升高;与肾气丸低剂量组比较,肾气丸高剂量组小鼠肾组织中PI3K和AKT蛋白水平显著升高,这提示肾气丸可激活PI3K/AKT信号通路,抑制ROS生产,保护I/R所致的肾组织损伤。
综上所述,本研究从体内水平研究肾气丸在肾I/R损伤的保护机制,发现肾气丸可通过激活PI3K/AKT信号通路对小鼠I/R诱导的急性肾损伤具有保护作用。但对临床的指导意义仍存在不足,如给药浓度及剂量还有待进一步完善。中药复方肾气丸在辨证论治的整体思想指导下进行配伍组方,往往可以通过多途径、多靶点综合作用于多个病理环节,从整体上有效保护肾I/R损伤。进一步深入研究肾气丸对肾损伤的完整保护机制,将为临床防治肾缺血再灌注损伤提供新的实验依据。
(本文图1~5见插图4-2)
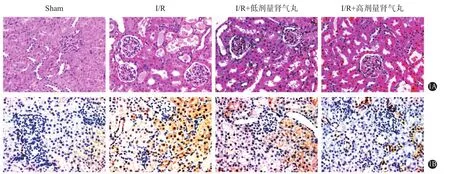
图1 各组小鼠肾组织形态结构、细胞凋亡情况比较:1A为HE染色(×400),1B为TUNEL染色(×400)
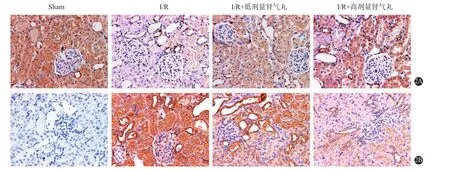
图2 免疫组纷织化学检测B淋巴细胞癌-2(Bcl-2)(2A)、半胱氨酸天冬蛋白酶3(Caspase 3)(2B)表达水平(×400)
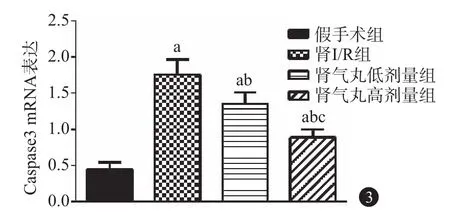
图3 半胱氨酸天冬蛋白酶3(Caspase 3)mRNA表达情况
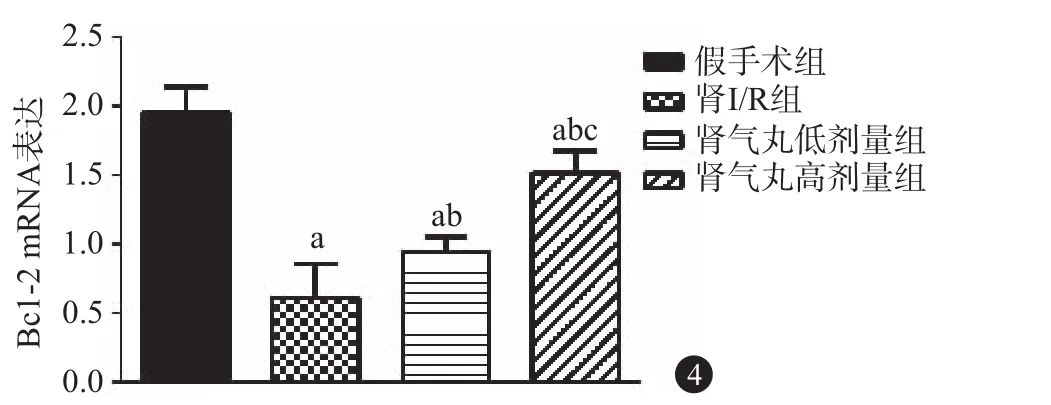
图4 B淋巴细胞癌-2(Bcl-2)mRNA表达情况
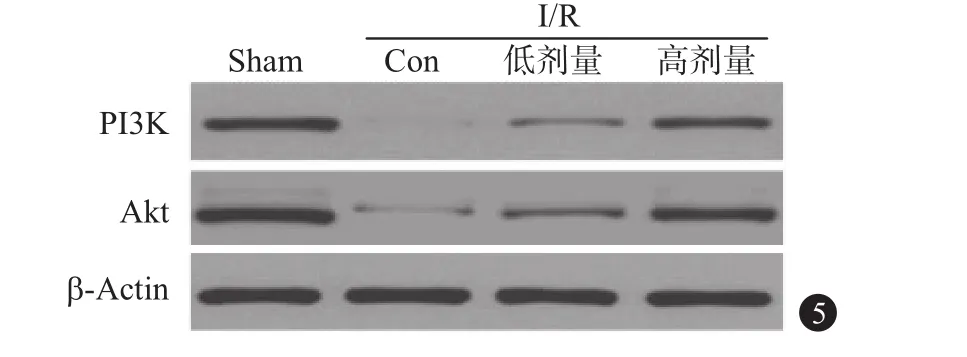
图5 各组小鼠肾组织PI3K、AKT蛋白表达比较:P13K为磷脂酰肌醇3-激酶、AKT为蛋白质丝氨酸苏氨酸激酶信号通路
