2型猪链球菌河南株cps2J基因的遗传进化关系分析
2020-04-14张青娴徐引弟王治方朱文豪王克领
张青娴,徐引弟,王治方,朱文豪,许 峰,王克领
(1.河南省农业科学院畜牧兽医研究所,河南 郑州 450002;2.河南省畜禽繁育与营养调控重点实验室,河南 郑州 450002)
猪链球菌是世界范围内养猪业重要的细菌性疾病之一,2型猪链球菌(Streptococcus suis serotype2,S.suis2)是一种人畜共患病原体,可引发仔猪和人类的败血症、脑膜炎[1-3]。目前认为猪链球菌毒力因子主要有荚膜多糖(Capsular polysaccharide,cps)、溶血素(suilysin,sly)、溶菌酶释放蛋白(muramidase-released protein,mrp)、胞外因子(extracelluar protein factor,ef)、谷氨酸脱氢酶(Glutamate dehydrogenase,gdh)、纤连结合蛋白(ibronectin-binding proteins,fbns)以及黏附素(adhesin)等[1-3]。其中,gdh位于猪链球菌菌体细胞壁上,是一种新近发现的极其保守的种特异性抗原成分[3],对细菌的致病性具有重要意义,不同血清型之间编码gdh的氨基酸序列同源性高达99%~100%。猪链球菌的临床菌株通常具有荚膜多糖(capsular polysaccharide,cps),cps是2型猪链球菌感染宿主的重要毒力因子,是传统上用于血清分型的基础。根据荚膜抗原的差异,猪链球菌被分为35种血清型(1型至34型和1/2型)[4-7]。大多数国家患病猪中分离出的菌株主要属于2型血清型,其次是 3、4、5、7、8 和 1/2 型[8-10]。某些欧洲国家分离到较多的血清型9猪链球菌[10-11]。其中血清型2菌株的致病力最强,在人类中具有高度毒性。
2019年5月河南某猪场发生一起疑似猪链球菌疫情,断奶仔猪发生呼吸困难、脑膜炎及关节炎等症状,发病率约6%,部分病猪后期衰竭死亡。收集临床病料经细菌分离培养、PCR鉴定和cps2J基因序列分析,确定分离到一株2型猪链球菌,命名为HNTY1。本试验研究了2型猪链球菌的流行病学特点和遗传进化关系,为更好地防控本病提供科学依据。
1 材料与方法
1.1 病料与试验动物
试验于2019年5—10月在河南省农业科学院畜牧兽医研究所传染病研究室进行。病料来源于2019年5月河南省某规模化猪场具有疑似猪链球菌症状的断奶仔猪群,无菌采集濒死猪的脑脊液、肺脏、肝脏、心血和关节液等病料。
1.2 主要试剂
革兰氏染色液购自珠海贝索生物技术有限公司;胰蛋白胨大豆琼脂培养基(tryptic soy agar,TSA)、胰蛋白胨大豆肉汤培养基(tryptic soybroth,TSB)购自Difco公司。新生牛血清购自郑州益康生物工程有限公司;微量生化试管购自杭州滨河微生物试剂有限公司;2×Taq Master Mix、DL 2 000 DNA Marker等PCR试剂购自宝生物工程(大连)有限公司。
1.3 细菌分离纯化
将无菌采集的组织病料接种于TSA平皿(含5%新生牛血清)中,置于37℃温箱培养18~24 h,挑取TSA平皿上可疑的单个链球菌菌落进行革兰氏染色镜检,选取疑似链球菌的单菌落纯化培养后保存备用。
1.4 PCR分型
根据参考文献[12-14]设计猪链球菌保守基因gdh和荚膜多糖基因cps2J的特异性引物(表1),由上海生工生物工程有限公司合成。设立灭菌去离子水为空白对照。将纯化菌株接种于含5%新生牛血清的TSA平皿,37℃恒温培养18 h后,挑取单菌落于100 μL灭菌超纯水中,旋涡混匀,100℃煮沸10 min,12 000 r/min离心10 min,取上清液提取DNA作为PCR 模板备用。 PCR 体系如下:13 μL 2×Taq PCR master mix、上下游引物各 1 μL、2 μL 模板、8 μL 超纯水。反应条件:94℃变性5 min后,94℃45 s、55℃45 s、72℃ 30 s进行35个循环,72℃延伸10 min后,4℃保存。将PCR产物于1%琼脂糖凝胶电泳,取阳性产物送至上海生工生物工程有限公司测序。测序结果经ClustalW算法与NCBI网站2型猪链球菌参考序列(表2)进行同源性分析,并在MEGA6.0软件使用Neighbor-Joining Method绘制系统发育进化树,Bootstrap数为1 000。
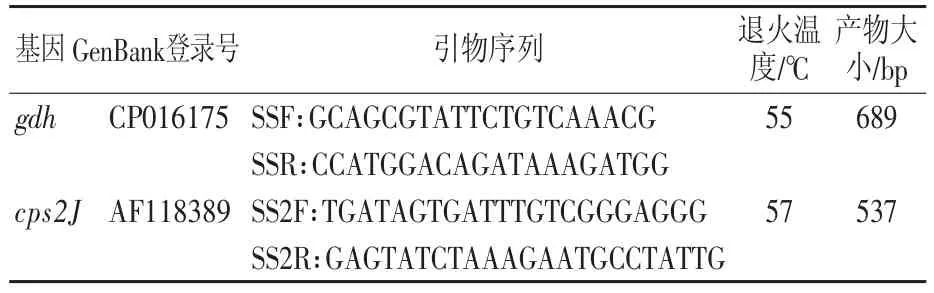
表1 猪链球菌PCR分型引物序列及相关信息
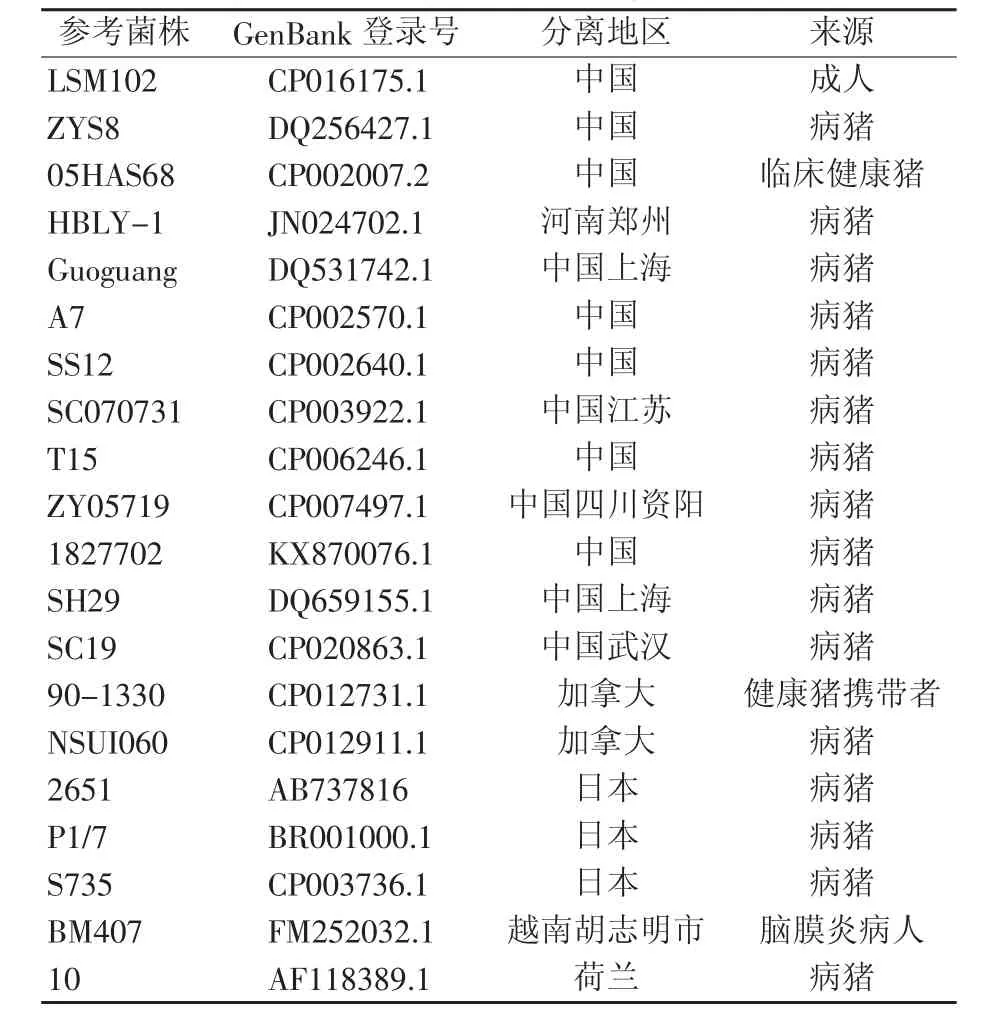
表2 构建系统进化发育树的参考菌株
2 结果
2.1 细菌形态
经24 h培养后,在含5%新生牛血清的TSA平皿上长出直径 0.2~0.8 mm、圆形、光滑、湿润、边缘整齐、半透明、灰白色略带蓝色荧光的小菌落,革兰氏染色为阳性圆形、卵圆形菌,呈单个、成对或短链状(图1)。将该菌株命名为HNTY1。
2.2 PCR鉴定
PCR产物经1%琼脂糖凝胶电泳后,扩增片段与预期设计大小一致,gdh基因和cps2J基因分别在689 bp和537 bp处扩增出阳性条带,均呈阳性;PCR产物测序结果与GenBank上gdh基因和cps2J基因参考菌株的序列同源性超过99.0%,证明分离株为血清2型猪链球菌(图2、图3)。
2.3 cps2J基因序列分析
HNTY1株cps2J基因序列测定结果如下:AAAGAAGCCTATTGTATAAATACTTAAATATATGC AATTTCTTTGGAAGCGATTCATCTCCATTTTTGAAC ATTAATAAGCTATAATAAATAATATGCCACTGTAG CGTCTCTTTAAAAACAGAAAATTCATATTGTCCAC CAAATATTTTAACAAACAAATCAAAAGTTTTTTCTT CTAAATTTTCTAATTGAATAAAAA CATCTTTTTTAA ACGTATTTGTAGTACTTTGTATACCTCTTCTAGCAA AATAAAGATTTCTGTTTACATAGCTGACTTTTTTTA TATTCTTTAAATAATTTAGATTAAATAATAAGTCCT CTCCTAACCACTGTTCAGTGTCAAAACCTTTGTTTA TATATATATTCTTATAAAGTTTGCAACAAGGGCTAT TAAAGATACCGCTCATATAATGATTTGGAAAATTT TCATTTCCTAAGTCTCGCACCTCTTTTATCTCTTCCAA ATCAATTTGACACTTTtGCAGCTCAGATTCTTGATA ATTTCCATCAAAAGTAGCAAGTAACCCTCCGAC AA。
通过分子生物学软件DNAStar和MEGA6.0,将HNTY1株与另外20株国内外2型猪链球菌菌株进行序列对比和同源性分析,并绘制系统发育进化树(图4)。结果显示,与多数参考菌株相比,HNTY1株在7 bp处缺失一个T核苷酸,即缺失了天冬酰胺(Asparagine,N 或 Asn);532 bp处缺失一个C核苷酸,即缺失了脯氨酸(Proline,P或Pro)。 HNTY1 株与上海株(SH29、Guoguang)同源性分别为99.41%和99.82%;与中国其他地区分离株(LSM102、ZYS8、05HAS68、T15、ZY05719、1827702、A7、SS12、HBLY-1、SC19) 同源性 99.4%~99.6%;与日本株(P1/7、S735、2651)同源性 99.6%;与加拿大株(90-1330、NSUI060)同源性 99.6%;与越南株BM407同源性100%;与荷兰株10同源性98.0%。
3 讨论
2型猪链球菌为高致病性人畜共患病,近年来给养猪业带来较大经济损失。猪链球菌的gdh基因非常保守,在猪链球菌的35个血清型中均存在该基因,建立gdh基因与cps2J基因的二重PCR方法,能显著提高临床2型猪链球菌鉴别的准确性[15-18]。本研究所分离的HNTY1株cps2J基因及其氨基酸序列分析表明,该分离株为2型猪链球菌,与GenBank收录的国内外大多数分离株同源性达98%以上,表明cps2J基因极度保守,不同时空猪链球菌2型无显著差异,说明这些菌株很可能具有相同起源;与NCBI收录的大多数参考株相比,HNTY1株在7 bp和532 bp处分别缺失了核苷酸T、C,即分别缺失了天冬氨酸(Asn)和脯氨酸(Pro);与上海株guoguang相比,在461 bp处由C→T,是否2型猪链球菌出现了新的流行趋势,有待进一步研究。HNTY1株与人源猪链球菌分离株LSM102同源性达99.6%,提示2型猪链球菌对公共卫生有一定威胁性。
本试验所建立的2型猪链球菌的PCR鉴定方法及遗传进化分析,可用于猪链球菌病的流行病学调查与检测,为进一步研究2型猪链球菌病的流行病学和防控本病提供科学依据。
