基于NLRP3炎性小体通路探讨金樱子乙醇提取物对系膜增生性肾小球肾炎大鼠的保护作用①
2020-04-13林艳梅彭庆海林小小
林艳梅 彭庆海 陈 杰 林小小
(萍乡市人民医院药物临床试验机构,萍乡 337000)
系膜增生性肾小球肾炎(mesenchymal prolifer-ative glomerulonephritis,MsPGN)属于临床常见肾小球病变疾病,MsPGN好发于青少年,其病隐匿,部分患者发展为终末期肾脏疾病[1]。MsPGN发病机制较复杂,其中NALP3炎性体(NACHT-LRR-PYD-containing proteins-3,NALP3)的上调与MsPGN的发生密切相关[2]。金樱子(Rosa laevigata michx.,RLM)属于蔷薇科植物,具有活血化瘀、消肿止痛、利尿补肾的功效,对肾炎、糖尿病肾病具有一定的改善作用[3,4],推测其对MsPGN可能也具有一定的作用。本研究通过复制MsPGN大鼠模型,并给予金樱子乙醇提取物治疗,旨在探究其对MsPGN大鼠肾脏的保护作用,并初步探究其可能的作用机制,为MsPGN治疗提供一定的参考。
1 材料与方法
1.1材料
1.1.1实验动物 8周龄SPF级SD大鼠,体质量200~220 g,购自河南省实验动物中心,动物许可证号:SCXK(豫)2018-0003。所有大鼠统一饲养在温度18~22℃,湿度45%~60%,良好通风环境内,饲养期间大鼠自由摄食、饮水,适应性饲养1周后进行模型制备。
1.1.2实验试剂与仪器 金樱子购自南宁医药有限公司;醋酸泼尼松购自天津天药药业股份有限公司,批号:180224;牛血清白蛋白(bovine serum albumin,BSA)购自北京Solarbio公司,货号:A8020;IL-1β和IL-18 ELISA检测试剂盒购自南京建成生物工程研究所,货号C013-2,C011-2;RIPA裂解液、苏木素-伊红(hematoxylin-eosin,HE)染色试剂盒购自碧云天生物技术研究所,货号:C0105、P0013B;鼠抗NLRP3、ASC、caspase-1抗体购自美国CST公司,货号15101,17507,24232;HRP标记IgG抗体、β-actin购自美国Abcam公司,货号ab205719,ab156302;免疫组化试剂盒购自上海优宁维生物科技股份有限公司,货号:TL-015-QHD;DxC全自动生化仪购自贝克曼库尔特公司;1658001型垂直电泳仪、ChemiDoc XRS凝胶成像仪均购自美国Bio-Rad公司;CKX53光学显微镜购自奥林巴斯公司。
1.2方法
1.2.1动物模型制备 参考文献[5]复制MsPGN大鼠,随机挑选73只大鼠进行造模,腹腔注射0.3 ml/100 g 10%水合氯醛,经背切除左肾,休养7 d后皮下注射BSA/弗式完全佐剂混合液(比例3 mg∶1 ml),1周末、2周末再次加强注射,3周末连续注射BSA,剂量分别为0.5 mg、1 mg、1.5 mg、3 mg,共注射4次,每次间隔1 h,次日注射2 mg BSA。第4周开始腹腔、尾静脉交替注射BSA,尾静脉注射起始剂量为0.5 mg,每次增加0.5 mg,当注射剂量为2.5 mg后每周增加0.5 mg,到每次剂量为5 mg。腹腔注射剂量为尾静脉的2倍,至剂量10 mg为止。模型结束后1周收集大鼠24 h尿液检测,尿蛋白阳性代表模型复制成功,本次3只大鼠造模未成功,死亡10只,共60只造模成功。另设置假手术组(Sham)12只,麻醉处理后仅暴露左肾,其他处理与模型组相同。
1.2.2动物分组与给药 金樱子乙醇提取物制备:将金樱子果实切碎,去除种子,干燥处理,将2 kg干燥后的金樱子果实置于80%食用乙醇溶液中浸润24 h,过滤后减压回收得到100 mg/L金樱子乙醇提取液。造模后MsPGN大鼠分为5组,模型组(MsPGN)、金樱子乙醇提取物低、中、高剂量组(RLM-L、RLM-M、RLM-H)、醋酸泼尼松组(Prednis-one acetate),每组12只。RLM-L、RLM-M、RLM-H组:模型制备结束后,灌胃金樱子乙醇提取液,剂量分别为2、4、8 mg/(kg·d)[6],连续给药4周。阳性药物组(醋酸泼尼松组,Prednisone acetate):模型制备结束后,灌胃剂量为5 mg/(kg·d)[7],连续4周。Sham、MsPGN组大鼠灌胃等量生理盐水,连续4周。
1.2.3观察指标与检测方法
1.2.3.1样本收集 末次给药结束后采集各组大鼠24 h尿液,麻醉处死大鼠后,收集血液,获得肾脏,一部分组织用4%多聚甲醛固定;另一部分置于-80℃保存。
1.2.3.224 h蛋白尿量测定 将尿液3 000 r/min离心10 min,收集上清,采取考马斯亮蓝法检测24 h尿蛋白量,双缩脲法检测总蛋白(TP)水平;微量酶标仪法检测血清白蛋白(ALB)水平。
1.2.3.3血清中生化指标检测 采用肌氨酸氧化酶法检测血清肌酐(serum creatinine,Scr)水平,二乙酰肟法检测尿素氮(blood urea nitrogen,BUN)水平。
1.2.3.4HE染色观察大鼠肾组织病理形态学变化 常规制备肾组织石蜡切片,烘烤后、脱蜡脱水,依据HE染色试剂盒对肾组织石蜡切片进行染色,经脱水、透明处理后,置于光学显微镜下观察组织变化情况。参考文献[7]对肾组织损伤情况进行评估,主要包括肾小球、肾小管病理形态学,根据系膜分布、增生情况将肾小球损伤分为4个等级评分为0~3分;肾小管间质损伤比例评分为0~4分。
1.2.3.5蛋白免疫印迹法(Western blot,WB)检测肾组织中NLRP3、ASC、caspase-1蛋白表达 取出保存肾脏组织,使用RIPA蛋白提取试剂裂解肾脏组织,提取蛋白质。4℃经100 g/L SDS-PAGE分离蛋白,将蛋白质转移到PVDF膜上,转膜反应后于脱脂牛奶中封闭1 h,添加NLRP3、ASC、caspase-1一抗(1∶300稀释),4℃孵育过夜;添加二抗(1∶5 000稀释),室温孵育1 h,经ECL发光显色,采用Life Technologies Quantity One软件定量各蛋白相对表达量。
1.2.3.6免疫组化检测肾组织中NLRP3、ASC、caspase-1蛋白阳性表达 切片脱蜡脱水后置于柠檬酸钠溶液中进行抗原修复,3%过氧化氢溶液中进行内源过氧化酶活性消除,经山羊血清封闭后添加NLRP3、ASC、caspase-1一抗4℃孵育过夜,与碱性磷酸酶(AP)偶联的IgG二抗室温孵育1 h,清洗后,添加 DAB溶液,在显微镜下观察直至切片显色,利用Image软件评估NLRP3、ASC、caspase-1蛋白阳性表达情况。
1.2.3.7肾组织IL-1β和IL-18水平检测 取1 g肾组织添加9 ml生理盐水于玻璃匀浆器中研磨,12 000 r/min 离心20 min,取上清,采用ELISA检测IL-1β和IL-18含量,严格参照ELISA试剂盒说明书操作。
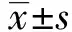
2 结果
2.1金樱子乙醇提取物对MsPGN大鼠一般情况的影响 Sham组大鼠饮水、毛发、精神状况良好;MsPGN组大鼠毛发干枯,活动量减少,精神不振;经不同剂量RLM、Prednisone acetate干预后毛发逐渐恢复光泽度,饮食、活动量有所增加,反应灵敏。与Sham组相比,MsPGN组大鼠体重显著降低(P<0.05);与MsPGN组相比,RLM-L、RLM-M、RLM-H、Prednisone acetate组大鼠体重显著升高(P<0.05),见表1。
2.2金樱子乙醇提取物对大鼠肾功能的保护 与Sham组相比,MsPGN组大鼠24 h尿蛋白、血清BUN、Scr水平显著升高,TP、ALB水平显著降低(P<0.05);与MsPGN组相比,RLM-L、RLM-M、RLM-H、Prednisone acetate组大鼠24 h尿蛋白、血清BUN、Scr水平显著降低,TP、ALB水平显著升高(P<0.05),见表2。
2.3金樱子乙醇提取物对MsPGN大鼠肾组织形态学的影响 HE染色显示Sham组肾小管、肾小球形态、结构正常,未出现炎性细胞浸润;MsPGN组肾间质出现大量炎性细胞浸润,血管壁增厚,炎症周围可见增生胶原,肾小管有明显蛋白管型,肾小球可见炎性细胞,系膜区增宽,系膜细胞增生,见图1。与MsPGN组相比,给药组肾间质炎性细胞浸润数减少,血管壁变薄,肾小球可见炎性细胞数减少,系膜区变窄,系膜增生减少。其中金樱子乙醇提取物高剂量组、Prednisone acetate组改善较明显。与Sham组相比,MsPGN组肾组织损伤评分显著升高(P<0.05); 与MsPGN组相比,RLM各组、Prednisone acetate组肾组织损伤评分显著降低(P<0.05),见表3。
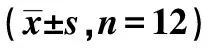
Tab.1 Comparison of body weight of rats in each group
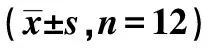
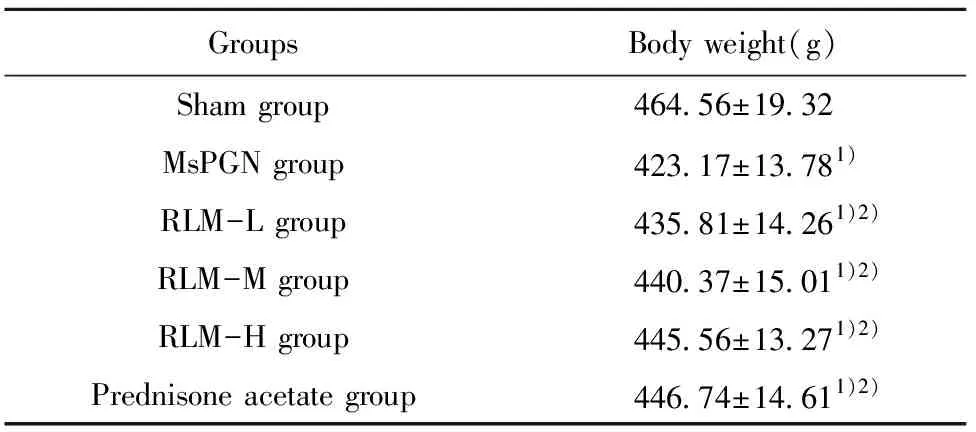
GroupsBody weight(g)Sham group464.56±19.32MsPGN group423.17±13.781)RLM-L group435.81±14.261)2)RLM-M group440.37±15.011)2)RLM-H group445.56±13.271)2)Prednisone acetate group446.74±14.611)2)
Note:Compared with sham group,1)P<0.05;compared with MsPGN group,2)P<0.05.
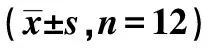
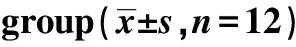
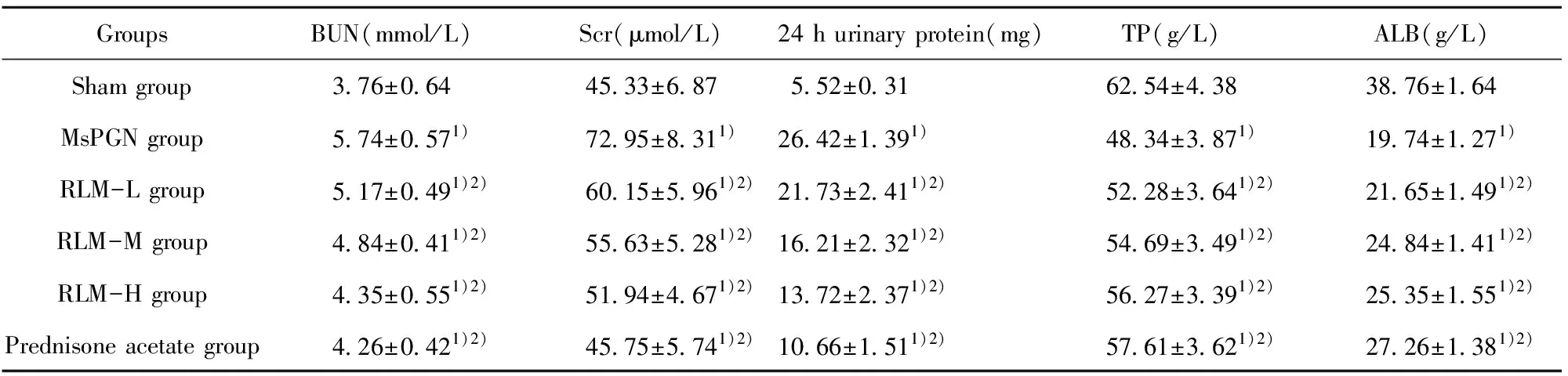
GroupsBUN(mmol/L)Scr(μmol/L)24 h urinary protein(mg)TP(g/L)ALB(g/L)Sham group3.76±0.6445.33±6.875.52±0.3162.54±4.3838.76±1.64MsPGN group5.74±0.571)72.95±8.311)26.42±1.391)48.34±3.871)19.74±1.271)RLM-L group5.17±0.491)2)60.15±5.961)2)21.73±2.411)2)52.28±3.641)2)21.65±1.491)2)RLM-M group4.84±0.411)2)55.63±5.281)2)16.21±2.321)2)54.69±3.491)2)24.84±1.411)2)RLM-H group4.35±0.551)2)51.94±4.671)2)13.72±2.371)2)56.27±3.391)2)25.35±1.551)2)Prednisone acetate group4.26±0.421)2)45.75±5.741)2)10.66±1.511)2)57.61±3.621)2)27.26±1.381)2)
Note:Compared with sham group,1)P<0.05;compared with MsPGN group,2)P<0.05.
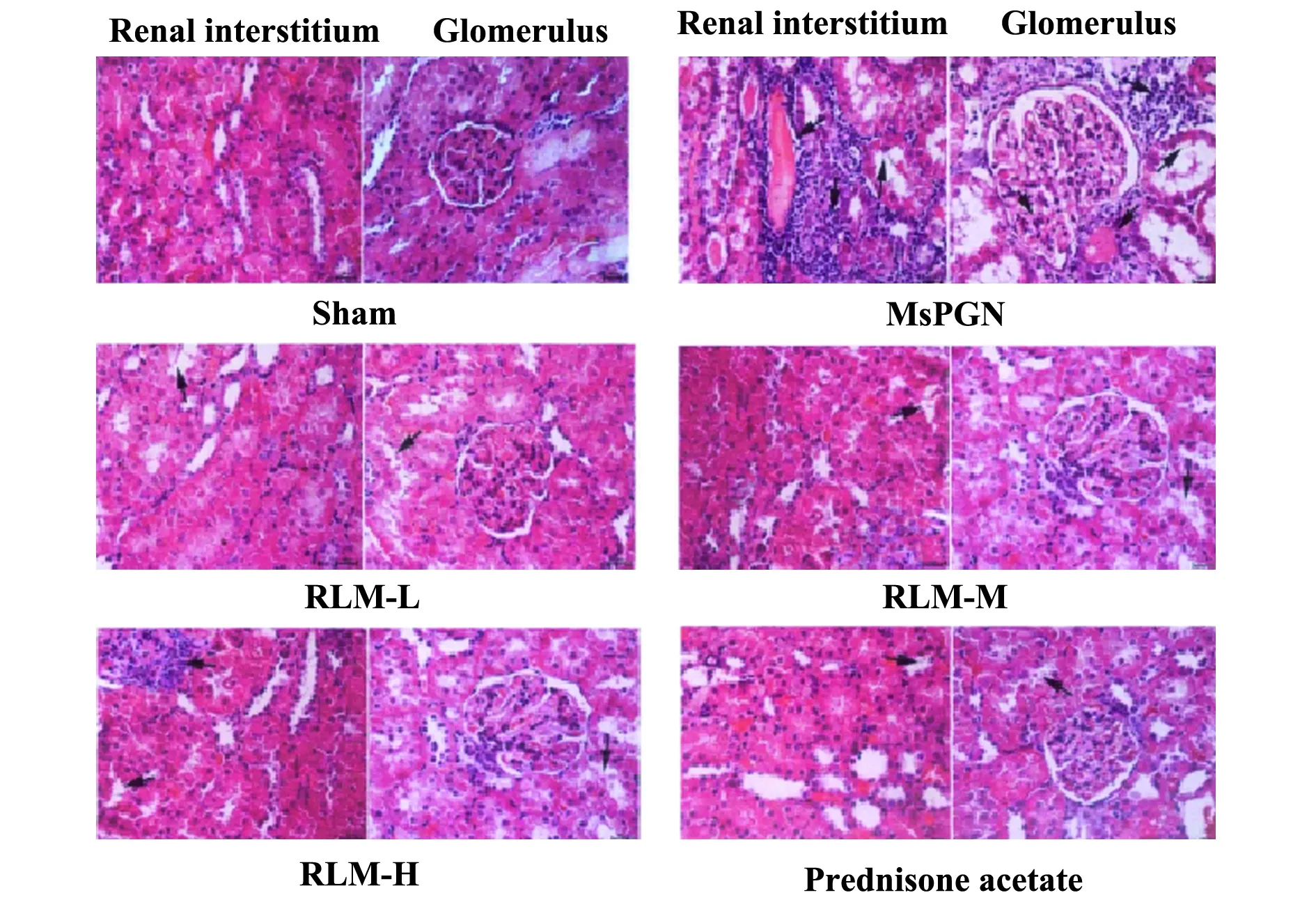
图1 HE 染色观察肾组织病理形态学变化(×400)Fig.1 Pathological and morphological changes of renal tissue observed by HE(×400)
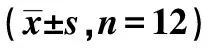

GroupsTubulointerstitialinjury score(score)Glomerularinjury score(score)Sham group0.35±0.060.24±0.03MsPGN group3.04±0.161)2.82±0.491)RLM-L group2.37±0.181)2)2.44±0.652)RLM-M group1.54±0.191)2)1.76±0.512)RLM-H group1.26±0.221)2)1.28±0.242)Prednisone acetate group1.19±0.241)2)0.96±0.192)
Note:Compared with sham group,1)P<0.05;compared with MsPGN group,2)P<0.05.
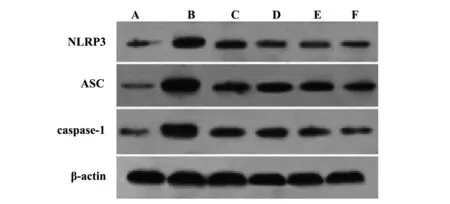
图2 Western blot检测肾组织中NLRP3、ASC和caspase-1蛋白表达Fig.2 Expression of NLRP3,ASC and caspase-1 protein in renal tissue detected by Western blotNote: A.Sham group;B.MsPGN group;C.RLM-L group;D.RLM-M group;E.RLM-H group;F.Prednisone acetate group.
2.4金樱子乙醇提取物对MsPGN大鼠肾组织中NLRP3炎性小体通路的影响
2.4.1金樱子乙醇提取物对MsPGN大鼠肾组织中
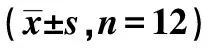
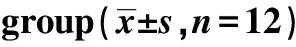

GroupsNLRP3/β-actinASC/β-actincaspase-1/β-actinSham group0.14±0.030.18±0.040.20±0.04MsPGN group0.86±0.091)1.13±0.121)1.06±0.151)RLM-L group0.48±0.071)2)0.74±0.071)2)0.65±0.081)2)RLM-M group0.37±0.051)2)0.67±0.081)2)0.56±0.071)2)RLM-H group0.25±0.041)2)0.48±0.081)2)0.42±0.051)2)Prednisone acetate group0.21±0.031)2)0.45±0.051)2)0.33±0.041)2)
Note:Compared with sham group,1)P<0.05;compared with MsPGN group,2)P<0.05.

图3 免疫组化检测肾组织中NLRP3、ASC、caspase-1蛋白表达(×200)Fig.3 Expression of NLRP3,ASC and caspase-1 protein in renal tissue detected by immunohistochemistry(×200)
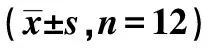
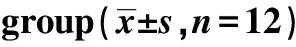
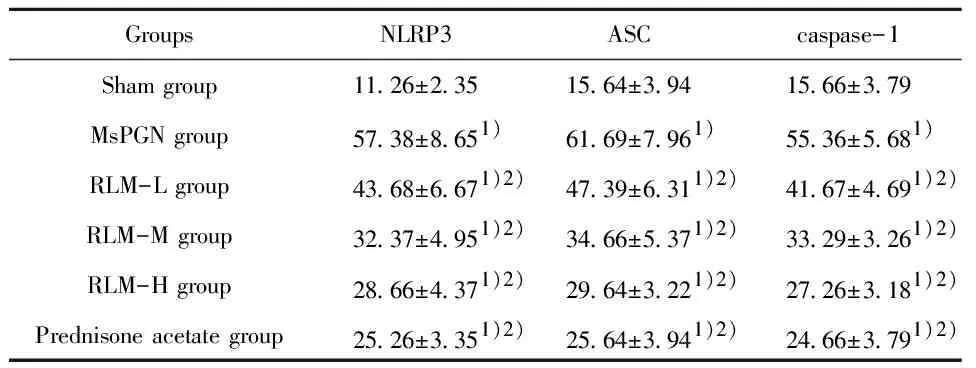
GroupsNLRP3ASCcaspase-1Sham group11.26±2.3515.64±3.9415.66±3.79MsPGN group57.38±8.651)61.69±7.961)55.36±5.681)RLM-L group43.68±6.671)2)47.39±6.311)2)41.67±4.691)2)RLM-M group32.37±4.951)2)34.66±5.371)2)33.29±3.261)2)RLM-H group28.66±4.371)2)29.64±3.221)2)27.26±3.181)2)Prednisone acetate group25.26±3.351)2)25.64±3.941)2)24.66±3.791)2)
Note:Compared with sham group,1)P<0.05;compared with MsPGN group,2)P<0.05.
NLRP3、ASC和caspase-1蛋白表达 与Sham组相比,MsPGN组肾组织中NLRP3、ASC和caspase-1蛋白表达显著升高(P<0.05)。与MsPGN组相比,RLM各组、Prednisone acetate组肾组织中NLRP3、ASC和caspase-1蛋白表达显著降低(P<0.05),见图2、表4。
2.4.2金樱子乙醇提取物对MsPGN大鼠肾组织中NLRP3、ASC和caspase-1阳性表达的影响 与Sham组相比,MsPGN组肾组织中NLRP3、ASC和caspase-1蛋白阳性表达率显著升高(P<0.05)。

GroupsIL-1β(pg/ml)IL-18(pg/ml)Sham group15.03±2.0514.34±3.11MsPGN group163.74±28.461)179.28±22.651)RLM-L group136.25±16.341)2)132.47±19.321)2)RLM-M group104.53±15.481)2)83.62±15.441)2)RLM-H group80.39±11.651)2)68.56±5.071)2)Prednisone acetate group74.47±11.161)2)62.66±5.511)2)
Note:Compared with sham group,1)P<0.05;compared with MsPGN group,2)P<0.05.
与MsPGN组相比,RLM各组、Prednisone acetate组肾组织中NLRP3、ASC和caspase-1蛋白阳性表达率显著降低(P<0.05),见图3,表5。
2.5金樱子乙醇提取物对NLRP3炎性小体通路下游炎性因子的影响 与Sham组相比,MsPGN组组织匀浆中IL-1β、IL-18水平显著升高(P<0.05)。与MsPGN组相比,RLM各组、Prednisone acetate组组织匀浆中IL-1β、IL-18水平显著降低(P<0.05),见表6。
3 讨论
MsPGN病理特征主要表现为系膜基质增多、系膜细胞增生等。以往研究显示大鼠连续皮下注射高浓度BSA能够加速免疫复合物介导肾炎的形成,该模型制备法具有造模成功率高、实用性强、周期短,与人肾小球肾炎发生过程相似程度高等优点[8]。尿蛋白为MsPGN患者临床表现之一,当肾脏基底膜受损后,肾小球滤膜通透性增加,造成蛋白尿渗出,而蛋白量超出肾小管重吸收后,就会形成蛋白尿;此外肾脏受损后血液中的BUN、Scr无法排出体外造成水平升高[9]。本研究采用改良慢性病性血清法制备MsPGN大鼠,结果显示与Sham组相比,大鼠体重降低,24 h尿蛋白、BUN、Scr水平升高,肾小管伴有充血、肿胀,肾组织细胞变性,肾小球基底膜增厚,出现大量炎性细胞浸润,提示MsPGN大鼠肾组织受损、肾功能受损,与过往研究相符[10],提示MsPGN模型复制成功。正常生理状态下机体内大分子物质不能透过肾小球滤膜,当滤膜损伤后,血液中TP、ALB均会排出体外形成蛋白尿,因此两者可以反映肾小球损伤情况[11]。本研究发现与Sham组相比,MsPGN组大鼠尿液中TP、ALB水平显著升高,提示肾小球受损、肾功能障碍。
金樱子为岭南特色中药,其果实具有利尿、补肾功效,叶子具有消肿解毒功效,根茎具有活血散瘀、祛风除湿、固精涩肠之功效,药理学研究显示其具有降血糖、抗氧化、抗肿瘤的活性[12]。基础研究发现对糖尿病肾病、肾炎大鼠肾功能具有保护作用[13]。然而其是否对MsPGN大鼠肾脏具有保护作用,目前尚不清楚。本研究发现金樱子乙醇提取物治疗后能够改善肾组织损伤,降低尿液中24 h尿蛋白量,升高TP、ALB水平,降低血清中 BUN、Scr水平,提示金樱子乙醇提取物可能通过缓解肾组织损伤发挥对肾功能的保护。
NLRP3炎性小体在调控机体炎性反应及自身免疫疾病中发挥重要作用。近期研究发现NLRP3炎性小体参与肾病的发生发展过程[14,15]。已有研究证实,正常肾脏组织中NLRP3 mRNA、蛋白表达较少,而在肾脏疾病组织中NLRP3表达明显升高,提示NLRP3炎性小体可能参与肾病的发生[16]。另外,有文献报道NLRP3炎性小体通路激活后可促进肾损伤中重要炎症介质IL-1β、IL-6,进而参与肾损伤发生发展[17]。Wang等[18]研究显示抑制NLRP3炎症小体活化能够减轻慢性肾病患者的肾损伤和纤维化。此外有研究表明,caspase-1蛋白酶抑制剂及NLRP3敲除能够抑制败血症引发的急性肾损伤中的中性粒细胞浸润[19]。然而,NLRP3炎性小体在MsPGN大鼠肾组织损伤中的作用尚未有研究。本研究发现,与Sham组相比,MsPGN组大鼠肾组织中NLRP3蛋白表达明显升高,且肾组织中NLRP3阳性细胞表达率也明显升高,经金樱子乙醇提取物治疗后肾组织中NLRP3蛋白、NLRP3阳性细胞数量均显著降低,推测NLRP3炎性小体可能参与MsPGN肾损伤发生,金樱子乙醇提取物可通过抑制NLRP3表达缓解肾组织损伤。
当受到炎症信号刺激后,NALP3的LRR结构能够识别特定信号,暴露NACHT结构域,使NALP3在ATP作用下发生聚合反应形成NALP3蛋白寡聚体,同时招募ASC、caspase-1前体,经切割后形成成熟的caspase-1,成熟后caspase-1能够活化IL-1β、IL-18前体形成成熟的IL-1β、IL-18并分泌至胞外,这些细胞因子均能够进一步引发炎症反应,加重动物模型中的肾损伤[20]。本研究结果显示,金樱子乙醇提取物能够抑制MsPGN大鼠肾组织中ASC、caspase-1蛋白表达,同时降低肾组织中ASC、caspase-1阳性细胞数量,进一步对下游因子检测发现金樱子乙醇提取物能够抑制NLRP3炎症依赖性细胞因子IL-18、IL-1β升高,提示金樱子乙醇提取物可能是通过抑制肾组织中NLRP3炎症小体活化,进而抑制caspase-1的成熟及炎性因子IL-1β、IL-18的分泌,发挥缓解肾组织损伤的作用。
综上所述,金樱子乙醇提取物对MsPGN大鼠肾组织损伤具有保护作用,这种作用可能通过抑制NLRP3炎性小体的活化,从而抑制通路介导的促炎介质IL-1β和IL-18的分泌,最终缓解肺组织损伤。然而,本研究中金樱子乙醇提取物仅能部分缓解肾功能损伤,并非完全逆转组织损伤,这可能与药物剂量相关,也有可能与其他途径引起MsPGN大鼠肾组织损伤有关,因此还有待在后续深入探究,以期提供更充足的理论依据。