金樱子种核微观结构鉴别及活性成分分析
2018-08-27程金生黄靖瑜万维宏陈楚茹黎嘉珠郭淑仪
程金生,黄靖瑜,万维宏,陈楚茹,黎嘉珠,郭淑仪
(韶关学院英东食品科学与工程学院,广东韶关 512005)
金樱子(RosalaevigataMichx)属蔷薇科蔷薇属植物,又名糖钵、刺梨、糖罐子、野石榴、白玉带、下山虎、刺藤棘、刺螂子树、螳螂子树等,在历代医书及本草如《蜀本草》《雷公炮炙论》《开宝本草》《梦溪笔谈》《本草纲目》《植物名实图考长编》等均有记载,其果实、花、叶和根均入药,用药最多部位为果实,味酸、甘,性平, 用于治疗肾虚尿频、带下、脾虚泄泻等症[1]。金樱子广泛分布于我国广东、广西、湖南、江西、福建、浙江等南方诸省,民间利用已有上千年,也是原国家卫生部公布的88种药食同源资源之一[2-5],符合现代健康理念,具有重要的开发价值。
金樱子种核为金樱子果实空腔内若干棕色粒状物,形状类压扁的肾形。国内外针对金樱子的相关研究主要围绕金樱子去核果肉、根或叶等部位[6-8],而对位于空腔内的种核相关研究较少,尤其是对金樱子种核的微观结构研究目前鲜见报道。笔者通过扫描电镜(scanning electron microscope,SEM)观察了金樱子种核微观结构,并通过GC-MS分析了金樱子种核中脂溶性活性成分[9],为金樱子种核综合利用提供借鉴。
1 材料与方法
1.1试验试剂所用试剂除特殊说明外,均为分析纯,购自阿拉丁上海有限公司;试验用水为蒸馏水。金樱子为广东省韶关市曲江区大塘镇附近山区采集。
1.2金樱子微观结构的表征在日立台式电镜TM3030上进行的,放大倍率:×15~60 000;设定观察条件:5 kV/15 kV/EDX;观察模式:标准模式、减电荷模式;检测器:高灵敏度半导体四分割BSE探测器;电子枪:预对中灯丝。
1.3色谱条件GC-MS选用美国Agilent6890-5973型气相色谱联用仪,通过分析不同组分保留时间和质谱碎片,得到金樱子种核中脂溶性活性物质含量信息。色谱柱为HP-5MS石英毛细管色谱柱(30 m×0.25 mm×0.25 μm);程序升温:从室温25 ℃以10 ℃/min 升温至85 ℃,再以10 ℃/min 升温至180 ℃,最后以5 ℃/min 升温至250 ℃(保持5 min);进样口和检测器(FID)温度均为250 ℃;分流比:30∶1;柱流量1 mL/min,载气为高纯氮气;质谱条件为:高纯氦气,EI离子源,电离电压70 eV;离子源温度250 ℃,传输线温度250 ℃;扫描范围40~500 amu;柱流量1.0 mL/min;质谱标准库:Nist谱图库。
1.4金樱子种核萃取工艺采摘秋季新鲜的金樱子,采用电子秤称重;按照《中华人民共和国药典》(2015年版)[10]要求进行优选,除去质量较差金樱子;优选出的金樱子必须符合无霉变、无异味、无杂质;将优选出的金樱子洗净后,真空干燥,用多功能粉碎机粉碎:先将切片机的刀调到最大限度,将金樱子送入,将切制后的金樱子筛去绒毛,再倒入清水中淘洗沉种核,捞出,40 ℃下恒温烘干48 h。将烘干的金樱子种核利用洁净布袋强力捣碎,随后再在中药细粉机上进一步粉碎,制成金樱子种核干粉,用40目筛子过筛,得筛选后的金樱子种核干粉。取粉碎后的金樱子种核粉末75 g;加入无水甲醇300 mL,利用索氏提取器回流提取5~6 h,过滤得提取液A;过滤后的残渣加入300 mL无水甲醇,在40~60 ℃下于超声波功率为80 W的超声波仪中超声时间2 h,得提取液B;合并提取液A和B,利用旋转蒸发仪旋转蒸发除去乙醇溶剂,得到黏稠的金樱子种核萃取物,随后将该萃取物在40 ℃下真空干燥12 h得最终萃取物。
2 结果与分析
2.1金樱子种核微观结构研究应用高分辨日立台式电镜对简单分离出的金樱子种核(图1)进行微观结构观察,结果见图2。从图2可以看出,金樱子种核呈压扁肾形(图2a),每枚种核约4.0 mm×2.5 mm。种核表面无光泽,有一系列细小纵向褶皱(图2b中内嵌图)。种核表面密布长度不同的细长茸毛,每枚种核分布有茸毛约数十枚(图2b),茸毛长度1.0~1.5 mm(图2c)。进一步放大图显示,金樱子茸毛易折断,末端尖细。与种核母体相连部分粗壮,直径约50 μm,且越向外伸展直径越小(图2d)。上述微观形貌特征可用于金樱子种核鉴别。

注:中间棕色粒状物即为金樱子种核Note:The middle brown granule is the seed nucleus of Rosa laevigata Michx图1 金樱子果实Fig.1 Fruit of Rosa laevigata Michx

注:a.完整种核;b.种核局部;c.种核表面茸毛;d.种核茸毛放大图Note:a.Complete seed nucleus; b.Local seed nucleus; c.Seed nucleus surface hair; d.Magnified view of the seed nucleus hair图2 金樱子种核扫描电镜Fig.2 SEM image of seed nucleus of Rosa laevigata Michx
2.2金樱子种核活性物质GC-MS分析按照“1.4”方法所述工艺制备金樱子种核萃取物,选用美国Agilent6890-5973型气相色谱联用仪,应用HP-5MS石英毛细管色谱柱,通过分析不同组分保留时间和质谱碎片,得到金樱子种核中脂溶性活性物质含量信息。按“1.3”色谱条件下得到的金樱子种核GC-MS分析总离子流图(图3),共计32个成分被积分得到。应用美国Nist质谱数据库的质谱数据进行计算机检索比对,并进行人工图谱解析,19个主要成分得到鉴定,其中相对质量分数较高的有亚油酸(25.23%)、油酸(11.67%)、α-亚麻酸(10.51%)、8,10-二甲氧基十八烷酸(8.76%)、棕榈酸(7.91%)、10,15-二甲氧基花生酸(5.49%)、三十一烷(2.14%)等,未鉴定成分中无含量较高成分,鉴定结果见表1。
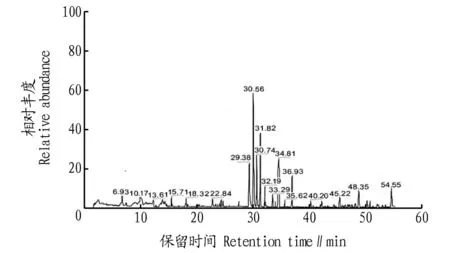
图3 GC-MS检测金樱子果核中脂溶性活性成分总离子图Fig.3 Total ion chromatogram of GC-MS analysis of liposoluble components in seed nucleus of Rosa laevigata Michx
Table1GC-MSanalysisofliposolublecomponentsinseednucleusofRosalaevigataMichx
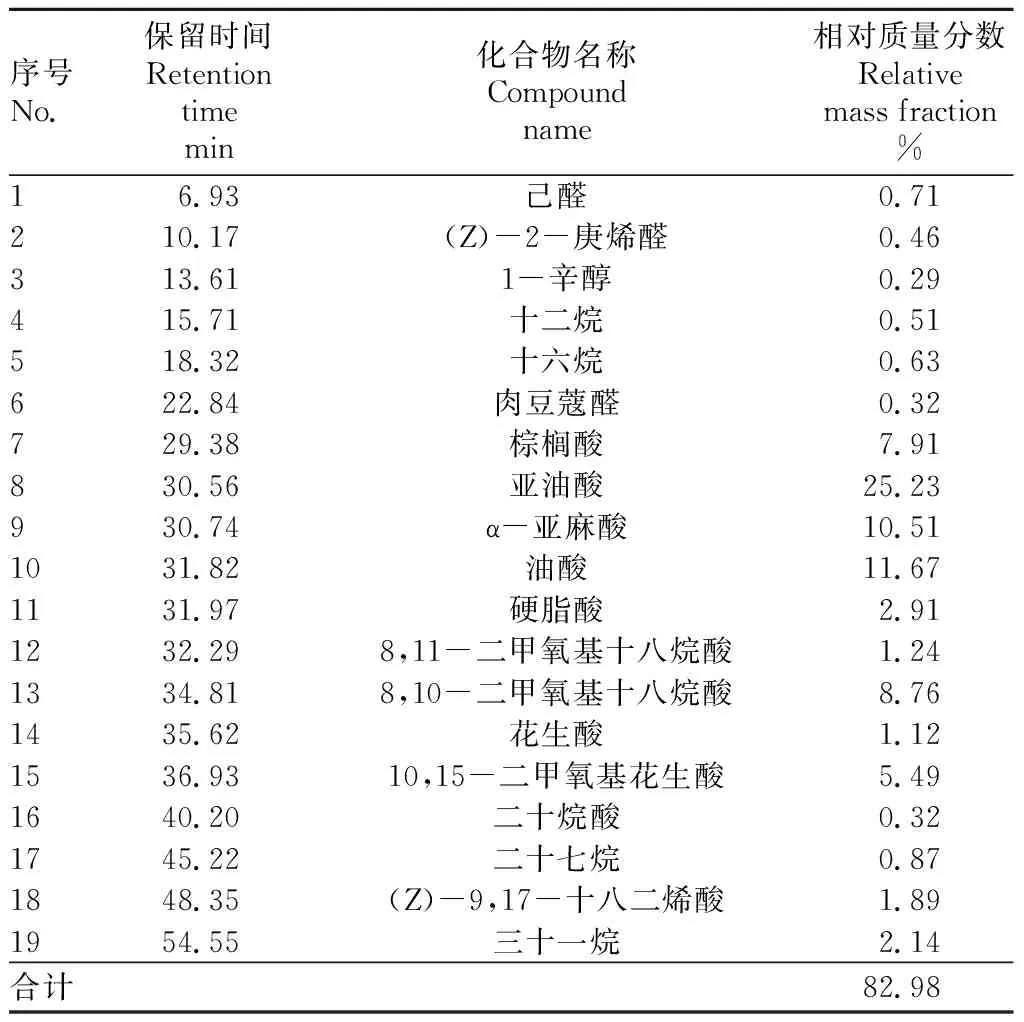
序号No.保留时间Retention timemin化合物名称Compound name相对质量分数Relative mass fraction%16.93己醛 0.71210.17(Z)-2-庚烯醛0.46313.611-辛醇0.29415.71 十二烷0.51518.32十六烷0.63622.84肉豆蔻醛0.32729.38棕榈酸7.91830.56亚油酸25.23930.74α-亚麻酸10.51 1031.82油酸11.671131.97硬脂酸2.911232.298,11-二甲氧基十八烷酸1.241334.818,10-二甲氧基十八烷酸8.761435.62花生酸1.121536.9310,15-二甲氧基花生酸5.491640.20二十烷酸0.321745.22二十七烷0.871848.35(Z)-9,17-十八二烯酸1.891954.55三十一烷2.14合计 82.98
金樱子种核中,不饱和脂肪酸如亚油酸、α-亚麻酸等不饱和脂肪酸含量丰富,显示该种核有很高的营养价值。但值得注意的,金樱子种核中也存在(Z)-2-庚烯醛、己醛、肉豆蔻醛等一些有毒醛类物质,在开发利用金樱子种核时有必要进行适当前处理,除去有毒性醛类物质。
3 结论
该研究通过台式扫描电镜观察了金樱子种核微观结构,发现金樱子种核呈压扁肾形,每枚种核约4.0 mm×2.5 mm,种核表面无光泽,有细小纵向褶皱。种核边缘密布长度不同的细长茸毛,茸毛长度1.0~1.5 mm。GC-MS分析显示,金樱子种核中含有19种主要活性成分,其中相对质量分数较高的有亚油酸(25.23%)、油酸(11.67%)、α-亚麻酸(10.51%)、8,10-二甲氧基十八烷酸(8.76%)、棕榈酸(7.91%)、10,15-二甲氧基花生酸(5.49%)等。研究结果表明,金樱子种核中,亚油酸、α-亚麻酸等不饱和脂肪酸丰富,仅人体不能合成的亚油酸含量就高达25.23%,显示金樱子种核有较高的营养价值,有望应用于化妆品、医药、食品等领域。该研究相关数据有望为金樱子种核显微鉴别及综合利用提供一定借鉴。
