宫颈癌组织及细胞株中长链非编码RNA CCAT1的表达水平及意义①
2020-04-13王圣坦朱根海陈春英
王圣坦 朱根海 纪 武 洪 澜 王 雁 陈春英 王 康
(海南省人民医院妇科,海口 570311)
宫颈癌在发展中国家发病率居高不下,是妇科生殖道常见恶性肿瘤之一,我国宫颈癌发病率已高达万分之一,且其发病年龄逐渐年轻化,严重威胁女性生命健康[1]。宫颈癌的发病机制复杂,涉及遗传、环境等多种因素的影响,现有的医疗手段治疗效果均不佳,近几年随着肿瘤分子学的发展,肿瘤分子靶点成为研究热点[2]。研究显示,长链非编码RNA在肿瘤的发生发展中有着重要的调控作用[3];肠癌相关转录因子1(colorectal cancer associated transcription factor 1,CCAT1)是一种长链非编码RNA,据报道CCAT1参与多种肿瘤的发生发展[4,5],但国内关于CCAT1与宫颈癌的报道较少,故本研究观察了CCAT1在宫颈癌组织中表达情况和CCAT1对宫颈癌细胞增殖的影响,并初步分析其可能作用机制。
1 材料与方法
1.1材料
1.1.1标本和细胞株 宫颈癌组织及对应癌旁正常组织(距癌<3 cm)取自2015年1月至2017年6月接受宫颈癌根治术的48例宫颈癌患者,所有患者术前均未接受放化疗,且标本经病理学检查确诊为宫颈癌;人正常宫颈鳞状细胞系ECT1/E6E7,宫颈癌细胞株Hela、C33A长期冻存于实验室液氮罐中,本研究已通过医院伦理委员会批准,且患者均签署知情同意书。
1.1.2试剂与仪器 DMEM培养基、胎牛血清、青链霉素购自美国Gibco公司;Lipofectamine 2000试剂盒、PCR引物购自美国Invitrogen公司;CCK-8试剂盒购自日本同仁公司;PimeScript RT Reagent Kit逆转录试剂盒购自日本TaKaRa公司;Quanti-FastSYBR Green PCRKit荧光定量RCR试剂盒购自德国Qiagen公司;Tublin、RASSF1A、cyclin D1蛋白一抗购自美国Cell signaling technology公司;实时荧光定量PCR仪、酶标仪、全自动凝胶成像系统购自美国伯乐公司;流式细胞仪购自美国贝克曼库尔特公司。
1.2方法
1.2.1qRT-PCR检测组织和细胞中CCAT1的表达 采用TRIzol法提取宫颈癌组织、癌旁正常组织及细胞样本中总RNA,并用紫外分光光度计进行RNA定量及纯度分析;参照PimeScript RT Reagent Kit说明书进行逆转录得到cDNA;参照QuantiFastSYBR Green PCRKit说明书进行qRT-PCR检测;通过熔解曲线观察PCR产物特异性,采用2-ΔΔCt法以GADPH mRNA的表达为内参,分析CCAT1的相对表达水平。基因序列[6]如下:CCAT1上游引物:5′-TTTATGCTTGAGCCTTGA-3′,下游引物:5′-CTTGCCTGAAATACTTGC-3′;GAPDH上游引物:5′-GGGAGCCAAAAGGGTCAT-3′,下游引物:5′-GAGTCCTTCCACGATACCAA-3′。反应条件为:92℃、3 min预变性,92℃、30 s变性,58℃、15 s退火,72℃、1 min延伸,共39个循环。
1.2.2细胞培养 宫颈癌细胞株Hela、C33A解冻后,应用 DMEM培养基+10%胎牛血清+1%青链霉素混匀,于37℃、5%CO2培养箱中恒温培养,取生长状态良好的细胞用于后续实验,并作保种冻存。
1.2.3细胞分组与转染 将细胞按适宜密度接种至6孔板,分组为正常对照组(Con)、siRNA-NC组和siRNA-CCAT1组,正常培养Hela、C33A细胞为Con组,Con组不作转染处理;siRNA-NC组和siRNA-CCAT1组细胞用无抗生素培养基培养,每6 h 换1次培养基,当细胞融合至40%~60%时,参照Lipofectamine 2000试剂盒说明书进行转染;转染24 h 后通过qRT-PCR检测CCAT1的表达,选择沉默效率较高的细胞用于后续实验。
1.2.4CCK-8检测细胞增殖 将转染后细胞按适宜密度接种至96孔板,参照CCK8试剂盒说明书检测细胞增殖率,将Con组、siRNA-NC组和siRNA-CCAT1组细胞分别培养24 h、48 h和72 h,每个时间点作5个复孔;每孔加入10 μl CCK-8试剂,37℃孵育1 h后终止培养,应用酶标仪测定每孔在450 nm波长处的吸光值,并绘制折线图。
1.2.5流式细胞仪检测细胞周期 待转染后细胞融合至80%时收集起来,用预冷PBS缓冲液清洗细胞后,固定于甲醇中,4℃下孵育30 min,加入碘化丙啶染液,染色30 min,流式细胞仪进行细胞周期检测。
1.2.6Western blot检测细胞中RASSF1A、cyclin D1的表达 收集转染后细胞,采用RIPA法提取样品总蛋白,BCA法进行蛋白定量;取70 μg蛋白点样至SDS-PAGE凝胶中电泳,当溴酚蓝电泳至电泳仪底部时终止,再将凝胶中蛋白电转至PVDF膜上,浸没于5%脱脂奶粉中,37℃下封闭1 h;适度清洗后浸没于相应蛋白一抗(Tublin稀释比为1∶1 500、RASSF1A稀释比为1∶1 000、cyclin D1稀释比为1∶1 000)中,4℃下孵育过夜;适度清洗后浸没于二抗(稀释比为1∶8 000)中,室温下孵育40 min;适度清洗后加入ECL发光液,于全自动凝胶成像系统中检测蛋白图像,并绘制柱状图。
2 结果
2.1CCAT1在宫颈组织和细胞中的表达情况 如图1,通过检测宫颈组织和细胞中CCAT1的表达,发现宫颈癌组织中CCAT1的表达显著高于癌旁正常组织(2.28±0.85比1.15±0.53,t/P=7.816/0.000);宫颈癌细胞Hela、C33A中CCAT1的表达分别显著高于正常宫颈鳞状细胞ECT1/E6E7(1.83±0.15比1.00±0.09,t/P=3.452/0.009;1.72±0.17比1.00±0.09,t/P=8.370/0.000)。
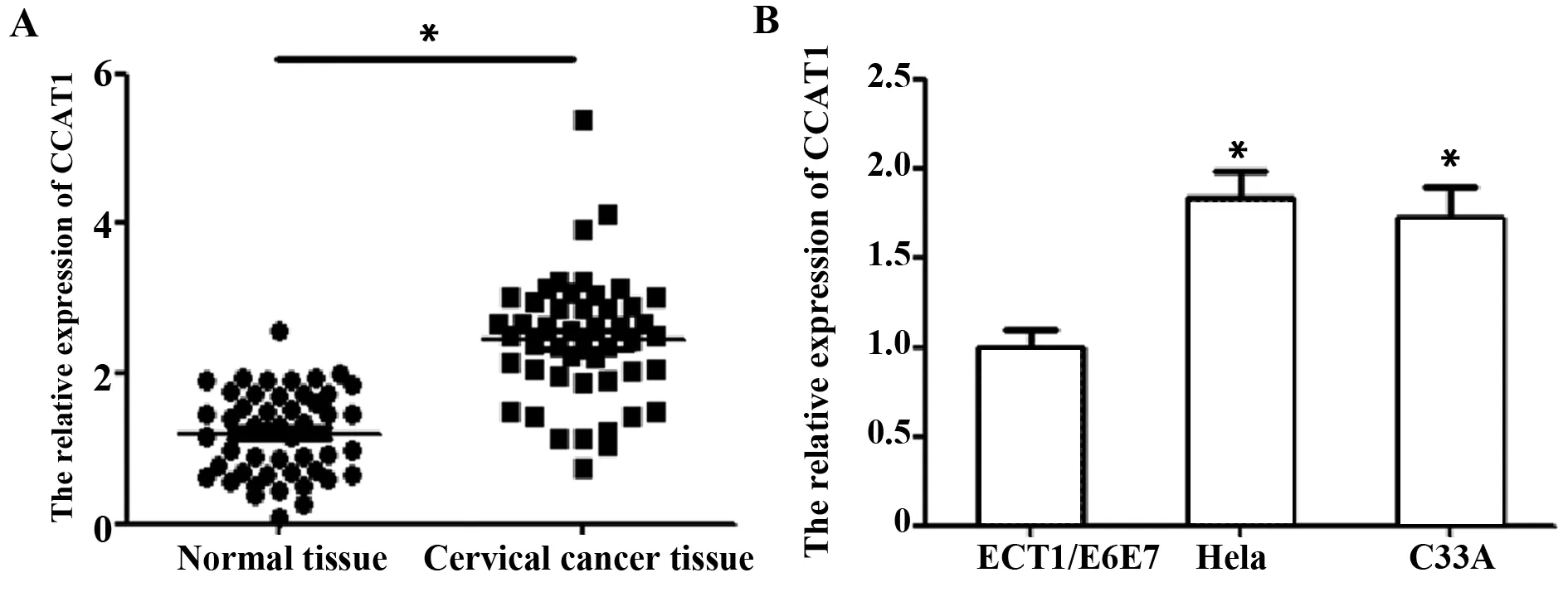
图1 CCAT1在宫颈组织和细胞中的表达情况Fig.1 CCAT1 expression in cervical tissues and cellsNote: A.CCAT1 expression in cervical tissues;B.CCAT1 expression in cervical cells.Compared with normal cervical tissues or cells,*.P
表1 宫颈癌中CCAT1的表达与临床病理表征的关系
Tab.1 Relationship between expression of CCAT1 in cervical cancer and clinicopathological features
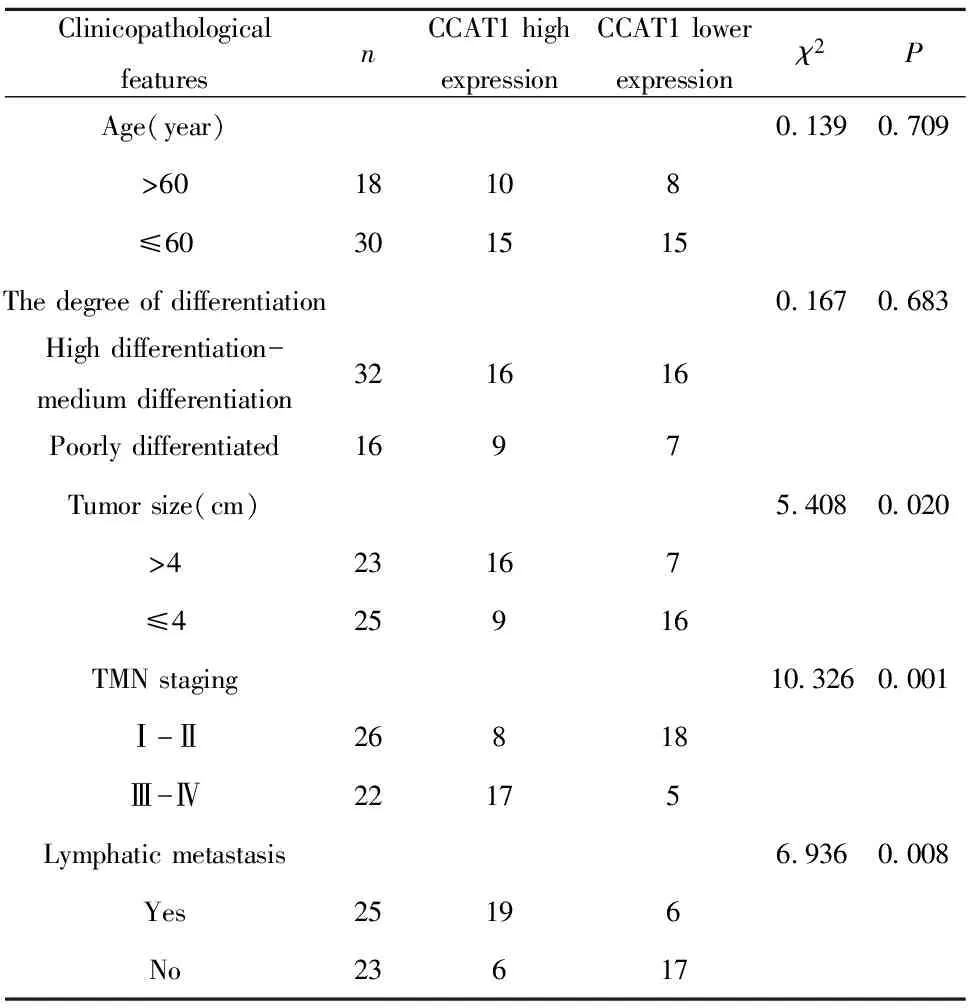
ClinicopathologicalfeaturesnCCAT1 highexpressionCCAT1 lowerexpressionχ2PAge(year)0.1390.709>6018108≤60301515The degree of differentiation0.1670.683High differentiation-medium differentiation321616Poorly differentiated1697Tumor size(cm)5.4080.020>423167≤425916TMN staging10.3260.001Ⅰ-Ⅱ26818Ⅲ-Ⅳ22175Lymphatic metastasis6.9360.008Yes25196No23617
2.2宫颈癌中CCAT1的表达与临床病理表征的关系 根据宫颈癌组织中CCAT1相对表达量的平均数为2.28,将48例宫颈癌患者分为CCAT1高表达组(CCAT1相对表达量>2.28)和CCAT1低表达组(CCAT1相对表达量≤2.28),分别为25例和23例,分析CCAT1表达与宫颈癌临床病理特征的关系,结果表明TMN分期较晚、肿瘤大、有淋巴结转移的宫颈癌患者宫颈癌组织中CCAT1相对表达量更高(均P<0.05);不同年龄、分化程度患者中CCAT1的表达无显著性差异(均P>0.05),见表1。
2.3沉默CCAT1后对Hela、C33A细胞中CCAT1表达的影响 如图2,应用siRNA转染细胞Hela、C33A后,发现siRNA-CCAT1组细胞中CCAT1表达明显低于siRNA-NC组(Hela细胞:0.31±0.08比0.98±0.12,t/P=30.463/0.000;C33A细胞:0.36±0.07比1.05±0.11,t/P=33.266/0.000);siRNA-NC组和Con组中CCAT1表达差异无显著统计学意义(均P>0.05)。

图2 沉默CCAT1后对Hela、C33A细胞中CCAT1表达的影响Fig.2 Effects of silencing CCAT1 on CCAT1 expression in Hela and C33A cellsNote: Compared with siRNA-NC group,*.P

图3 沉默CCAT1后对Hela、C33A细胞增殖的影响Fig.3 Effects of silencing CCAT1 on proliferation of Hela and C33A cellsNote: A.Hela cell;B.C33A cell.Compared with siRNA-NC group,*.P
2.4沉默CCAT1后对Hela、C33A细胞增殖的影响 如图3,通过CCK-8法检测转染后Hela、C33A细胞培养24 h、48 h及72 h的增殖活性,随着培养时间的延长,细胞增殖的越缓慢,siRNA-CCAT1组细胞增殖活性明显低于siRNA-NC组(均P<0.05),siRNA-NC组和Con组中CCAT1表达差异无显著统计学意义(均P>0.05),具体吸光度值见表2。
2.5沉默CCAT1后对Hela、C33A细胞周期的影响 如图4,通过流式细胞仪检测Hela、C33A细胞周期,siRNA-CCAT1组处于G0/G1期细胞百分比显著高于siRNA-NC组(均P<0.05),而S期和G2/M期细胞百分比与siRNA-NC组差异无显著统计学意义(均P>0.05),具体值见表3。
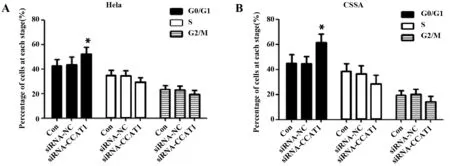
图4 沉默CCAT1后对Hela、C33A细胞周期的影响Fig.4 Effects on cell cycle of Hela and C33A after silenc-ing CCAT1Note: A.Hela cell;B.C33A cell.Compared with siRNA-NC group,*.P
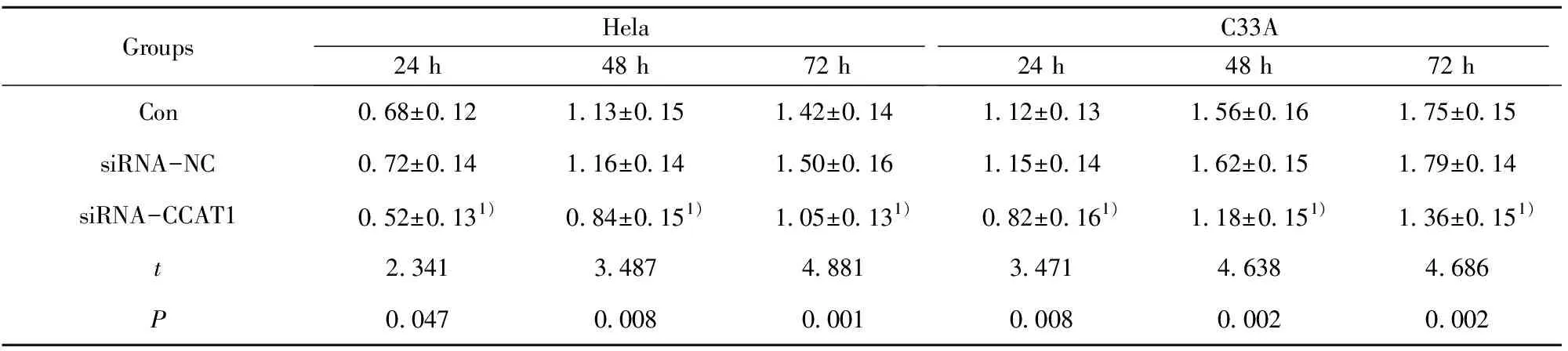
GroupsHela24 h48 h72 hC33A24 h48 h72 hCon0.68±0.121.13±0.151.42±0.141.12±0.131.56±0.161.75±0.15siRNA-NC0.72±0.141.16±0.141.50±0.161.15±0.141.62±0.151.79±0.14siRNA-CCAT10.52±0.131)0.84±0.151)1.05±0.131)0.82±0.161)1.18±0.151)1.36±0.151)t2.3413.4874.8813.4714.6384.686P0.0470.0080.0010.0080.0020.002
Note:Compared with adjacent normal tissues,1)P<0.05.
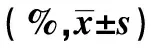
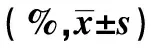
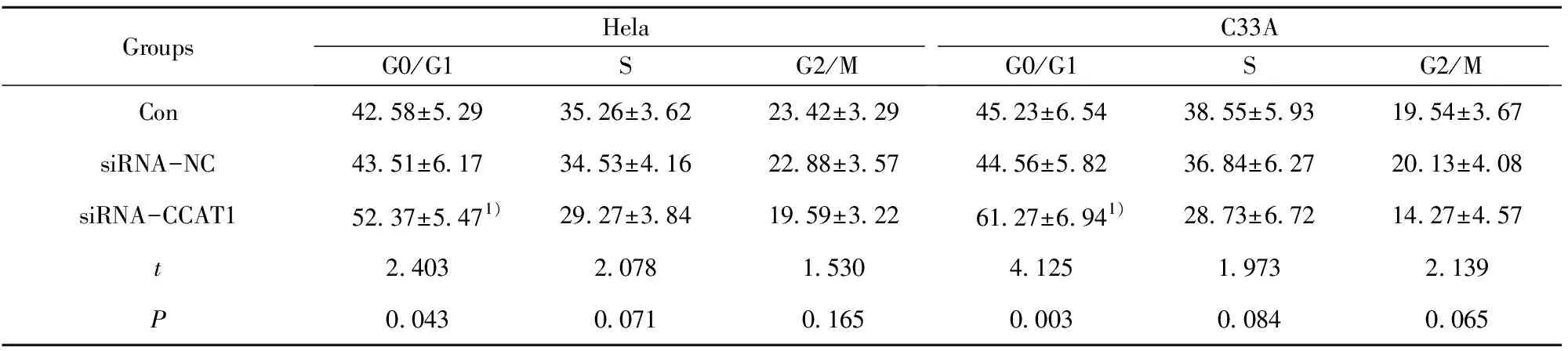
GroupsHelaG0/G1SG2/MC33AG0/G1SG2/MCon42.58±5.2935.26±3.6223.42±3.2945.23±6.5438.55±5.9319.54±3.67siRNA-NC43.51±6.1734.53±4.1622.88±3.5744.56±5.8236.84±6.2720.13±4.08siRNA-CCAT152.37±5.471)29.27±3.8419.59±3.2261.27±6.941)28.73±6.7214.27±4.57t2.4032.0781.5304.1251.9732.139P0.0430.0710.1650.0030.0840.065
Note:Compared with adjacent normal tissues,1)P<0.05.
表4 沉默CCAT1后Hela、C33A细胞RASSF1A、cyclin D1表达情况
Tab.4 Expression of RASSF1A and cyclin D1 in Hela and C33A cells after silencing CCAT1
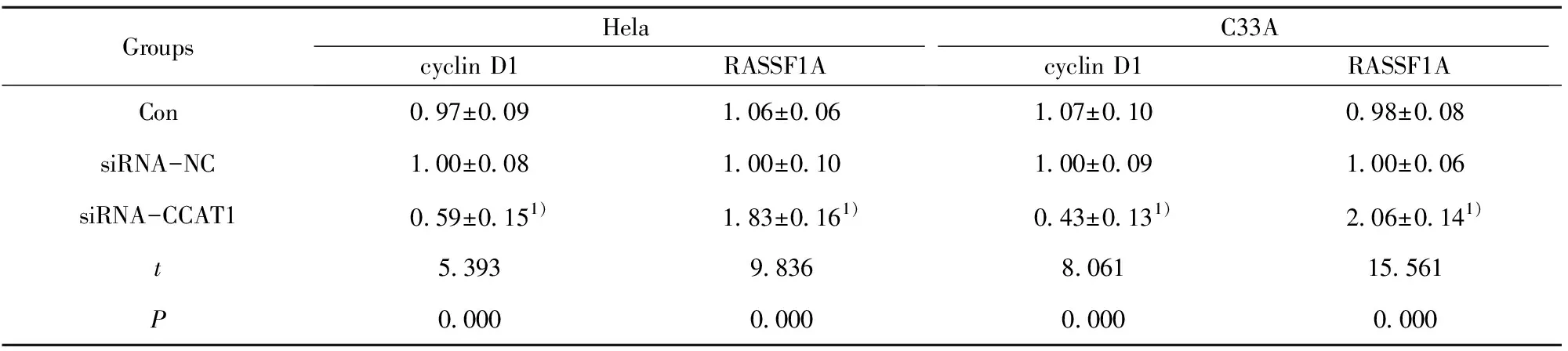
GroupsHelacyclin D1RASSF1AC33Acyclin D1RASSF1ACon0.97±0.091.06±0.061.07±0.100.98±0.08siRNA-NC1.00±0.081.00±0.101.00±0.091.00±0.06siRNA-CCAT10.59±0.151)1.83±0.161)0.43±0.131)2.06±0.141)t5.3939.8368.06115.561P0.0000.0000.0000.000
Note:Compared with adjacent normal tissues,1)P<0.05.
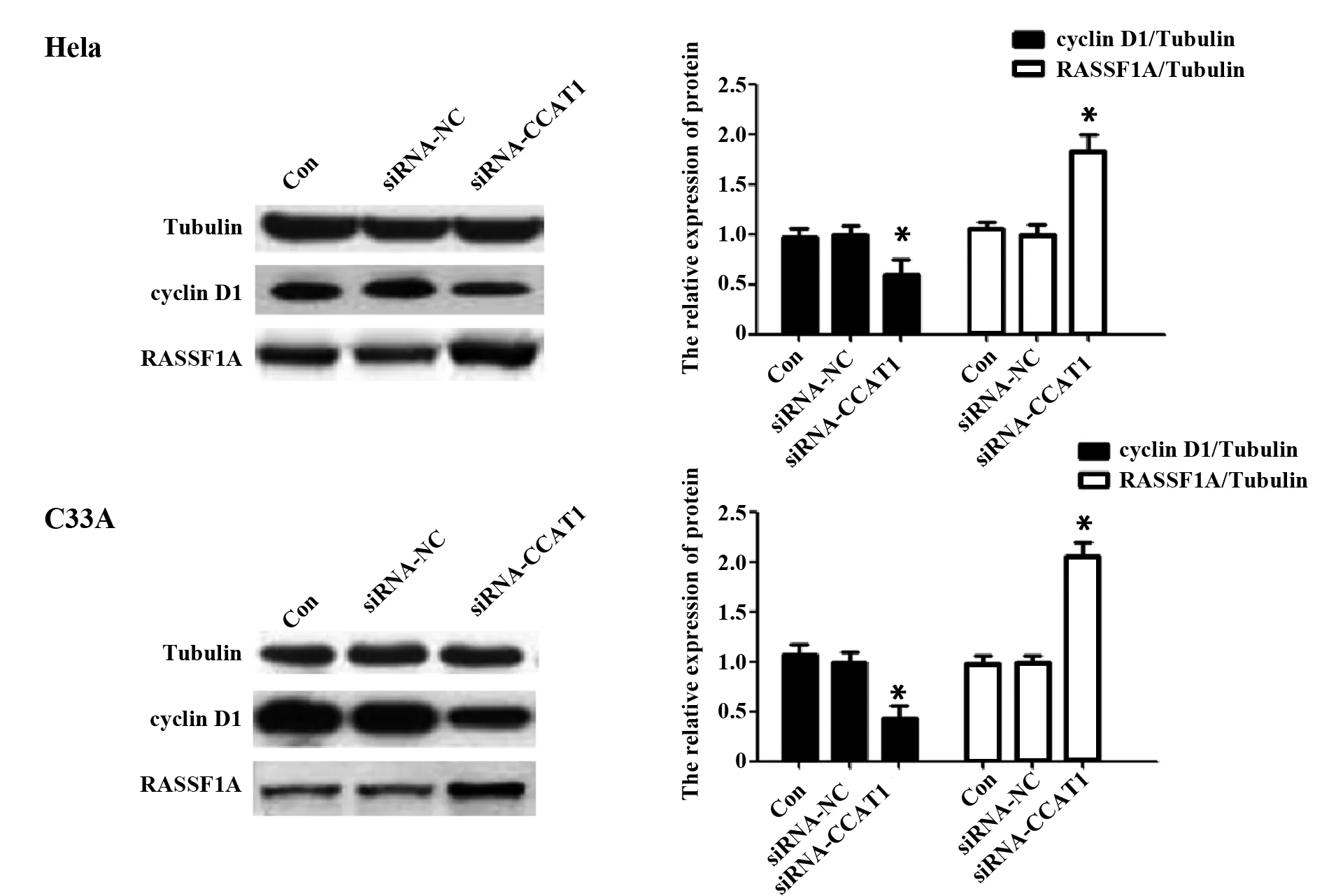
图5 沉默CCAT1后对Hela、C33A细胞中RASSF1A、cyclin D1表达的影响Fig.5 Effects of silencing CCAT1 on expression of RASSF1A and cyclin D1 in Hela and C33A cellsNote: Compared with siRNA-NC group,*.P
2.6沉默CCAT1后对Hela、C33A细胞中RASSF1A、cyclin D1表达的影响 如图5,与siRNA-NC组相比,siRNA-CCAT1组中cyclin D1表达显著下调,RASSF1A表达显著上调(均P<0.05);siRNA-NC组和Con组中RASSF1A、cyclin D1的表达差异无显著统计学意义(均P>0.05),见表4。
3 讨论
长链非编码RNA是一类高度保守、特异性强的长序列转录本,其生理活性丰富,涉及机体多种生理过程,甚至参与调控肿瘤的发生发展[7]。长链非编码RNA尿路上皮癌相关分子(UCA1)[8]、X染色体失活特异转录子(XIST)[9]均在宫颈癌组织中异常高表达,且其表达水平与宫颈癌患者临床病理特征存在一定的关系,提示长链非编码RNA可能参与宫颈癌的发生、发展。CCAT1 是一个长度为2 628 nt、位于癌基因cMyc附近的长链非编码RNA[10];研究发现,CCAT1可通过促进肿瘤细胞增殖、迁移和侵袭过程,而参与胃癌[11]、结直肠癌[12]及前列腺癌[13]的发生发展。因此,猜想CCAT1在宫颈癌中可能具有相似作用。本研究发现,CCAT1在宫颈癌组织和细胞中异常高表达,且不同TMN分期、肿瘤大小、淋巴结转移情况患者中CCAT1表达有显著差异,提示CCAT1可能与宫颈癌的发生发展有关,与Zhang等[14]研究报道相似。
人体正常细胞在癌变、增殖、转移、复发等过程中伴随着多种基因的变异,从而引起相关功能蛋白表达的紊乱,故RNA干扰技术常应用于肿瘤的基因治疗与研究。本研究通过构建CCAT1低表达细胞系,探究沉默CCAT1后对宫颈癌细胞Hela、C33A增殖的影响,结果显示沉默CCAT1会显著抑制宫颈癌细胞的增殖,并使细胞停滞于G0/G1期。RAS相关区域家族1A蛋白(RAS correlation region family 1A,RASSF1A)是一种抑癌基因,其表达缺失会促进肿瘤的发生发展,可能通过诱导细胞周期停滞或引起细胞恶性转换;张秀平等[15]研究显示RASSF1A在宫颈癌组织中异常低表达,并抑制宫颈癌细胞的增殖和侵袭。细胞周期蛋白D1(Cyclin D1)可与多种蛋白相互作用,促使细胞周期由G1期进入S期,诱导细胞的分裂与增殖;研究发现,Cyclin D1异常过表达与恶性肿瘤的发生发展密切相关,且与肿瘤患者临床病历特征及预后相关。廖铭心等[16]研究显示沉默hnRNP A2/B1基因通过下调cyclin D1的表达,抑制宫颈癌细胞增殖及生长。据报道,CCAT1可通过与miR-181a-5p互补配对调控上调RASSF1A、下调cyclin D1的表达,从而发挥抑癌作用[17],本研究发现沉默CCAT1表达后会上调Hela、C33A细胞中RASSF1A、下调cyclin D1的表达,可能因此影响宫颈癌细胞的增殖能力。
宫颈癌的发生发展机制错综复杂,CCAT1作为一个新型的肿瘤调控分子,其具体作用机制尚不清楚。本研究发现沉默CCAT1表达可抑制宫颈癌细胞的增殖,使细胞停滞于G0/G1期,可能与调控RASSF1A、cyclin D1的表达有关,为揭示宫颈癌发生发展机制打下基础,但本文仅初步分析其具体作用机制,后期随着CCAT1与宫颈癌的深入研究,CCAT1将有望成为治疗宫颈癌的重要靶点。