miR-221靶向AdipoR1基因对LPS诱导的肺泡上皮细胞A549炎症分泌及凋亡影响
2020-04-13亓水芹冯向功
亓水芹 冯向功
(郑州澍青医学高等专科学校病原生物与免疫学教研室,郑州 450064)
急性肺损伤是肺内外各种因素导致的急性炎症性肺损伤,可进展为急性呼吸窘迫综合征,病死率高达50%~70%[1]。肺泡上皮细胞损伤是急性肺损伤的主要病理特征之一,因此研究肺泡上皮细胞损伤分子机制对治疗急性肺损伤具有重要意义[2,3]。
MicroRNA(miRNA)是真核生物中高度保守的一类非编码小分子RNA,通过与靶mRNA的3′UTR区互补结合抑制基因转录后翻译以调节基因表达,参与急性肺损伤后炎症反应、细胞凋亡及肺泡液体清除等整个病理过程[4,5]。miR-221是一种具有类似癌基因功能的miRNA,近年来研究报道,miR-221与细胞炎症因子分泌也有关[6,7]。脂联素是脂肪细胞分泌的一种细胞因子,通过与脂联素受体(adiponectin receptor,AdipoR)结合参与抵抗炎症反应、调节葡萄糖和脂肪酸代谢等生命过程[8]。目前,miR-221和AdipoR1在急性肺损伤中的作用尚未见报道。
脂多糖(lipopolysaccharide,LPS)是革兰氏阴性菌细胞壁中的重要成分,可诱导宿主细胞炎性反应继而造成免疫功能障碍。国内外研究表明,气管内滴注LPS可造成大鼠急性肺损伤[9,10]。因此本研究采用LPS体外干预人肺泡上皮细胞A549,模拟肺损伤,研究miR-221和AdipoR1对肺泡上皮细胞炎症因子分泌和凋亡的影响,并初步探讨其潜在作用机制。
1 材料与方法
1.1材料 人肺泡上皮细胞A549由中国科学院上海细胞库提供;LPS(Sigma公司);高糖DMEM培养基和胎牛血清(Gibco公司);Trizol试剂和RIPA裂解液(Invitrogen公司);Lipofectamine 2000转染试剂、Annexin V-FITC/PI细胞凋亡检测试剂盒(碧云天生物技术研究所);酶联免疫吸附法(ELISA)IL-1β、IL-6、肿瘤坏死因子-α(tumor necrosis factor,TNF-α)检测试剂盒购自北京索莱宝生物科技有限公司;AdipoR1抗体、Bax抗体、Bcl-2抗体和β-antin抗体Ⅰ抗及相应Ⅱ抗购自武汉博士德生物工程有限公司;双荧光素酶报告基因检测试剂盒购自北京全式金生物技术有限公司;miR-221模拟物(miR-221 mimics)及无义序列模拟物(mimics control)、miR-221抑制物(miR-221 inhibitor)及无义序列抑制物(inhibitor control)、AdipoR1小干扰RNA(siRNA-AdipoR1)及siRNA无义序列(siRNA control)由广州市锐博生物科技有限公司设计并合成。
1.2方法
1.2.1细胞培养、分组 将人肺泡上皮细胞A549接种于含10%胎牛血清的高糖DMEM培养基,放于37℃,5%CO2培养箱中培养,当细胞培养至80%~90%融合时,用0.25%胰蛋白酶消化细胞,进行传代培养。
将细胞随机分组:对照组(NC组,为正常培养细胞);LPS组(取对数生长期的细胞,加入浓度为10 μg/ml的LPS处理24 h);LPS+转染组[取生长密度达50%~60%的细胞,使用Lipofectamine 2000转染试剂将inhibitor control(anti-miR-con)、miR-221-inhibitor(anti-miR-221)、mimics control(miR-con)、miR-221-mimics(miR-221)、siRNA control(si-con)、siRNA-AdipoR1(si-AdipoR1)、pcDNA3.1空载体、pcDNA3.1-AdipoR1(pcDNA-AdipoR1)分别转染至细胞,转染培养24 h后,加入LPS处理24 h]。实验中LPS处理浓度参考施荣等[11]方法。
1.2.2细胞中miR-221和AdipoR1 mRNA检测 采用RT-qPCR法检测细胞中miR-221和AdipoR1 mRNA表达。使用Trizol试剂抽提处理后各组细胞总RNA,紫外分光光度计下检测RNA样品的纯度和浓度,2%琼脂糖凝胶电泳检测RNA样品的完整性。按照TaKaRa逆转录试剂盒说明进行逆转录反应,合成cDNA,以cDNA为模板进行qPCR反应。miR-21上游引物序列5′-GCCCGCTAGCTTATCAGACTGATG-3′,下游引物序列5′-GTGCAGGGTCCGAGGT-3′;AdipoR1上游引物序列5′-GGCTGAAAGACAATGACTAC-3′,下游引物序列5′-TCAAGATTCCCAGAAAGAG-3′;U6上游引物序列5′-GCGCGTCGTTAAGCGTTC-3′,下游引物序列5′-GTGCAGGGTCCGAGGT-3′;β-antin上游引物序列5′-TCACCCACACTGTGCCCCATCTACGA-3′,下游引物序列5′-CAGCGGAACCGCTCATTGCCAATGG-3′。结果分别以U6和β-antin为内参基因,采用2-ΔΔCT法计算miR-221和AdipoR1 mRNA相对表达水平。
1.2.3细胞中AdipoR1蛋白和凋亡相关蛋白检测 蛋白检测采用Western blot法。使用含1%苯甲基磺酰氟(PMSF)的RIPA裂解液提取处理后各组细胞总蛋白,BCA法检测蛋白样品浓度并定量,取50 μg 蛋白样品进行SDS-PAGE电泳分离目的蛋白,湿转法转移至硝酸纤维素膜(NC膜)上。室温下5%脱脂奶粉封膜1 h,分别加入稀释后的AdipoR1抗体、Bax抗体、Bcl-2抗体和β-antin抗体Ⅰ抗,4℃孵育过夜,洗膜,然后加入稀释后的相应Ⅱ抗,室温孵育2 h。洗膜,加入ECL发光液中显色10 min,Odyssey红外激光成像系统下曝光,拍照,应用Image-Pro Plus软件分析蛋白条带灰度值并计算目的蛋白相对表达水平。
1.2.4细胞凋亡检测 采用双染法流式细胞术检测细胞凋亡率。收集处理后的各组细胞,重悬细胞并调整细胞密度为2×106个/ml,取1 ml细胞重悬液加入流式管中,离心后弃上清,使用PBS溶液洗涤2次。1×Binding Buffer重悬细胞后,分别加入5 μl Annexin V-FITC和碘化丙啶(PI)混匀,室温避光反应15 min,流式细胞仪检测细胞情况并计算细胞凋亡率。
1.2.5细胞上清液中炎性因子检测 收集各组细胞培养上清液,采用ELISA法检测上清液中IL-1β、IL-6、TNF-α浓度,检测方法严格参照试剂盒说明书进行。
1.2.6双荧光素酶报告基因实验 为证实miR-221是否靶向AdipoR1,本研究将AdipoR1的3′UTR区(CGCCCACCATGCACTTTACTAT)构建质粒载体,分别于miR-con、miR-221-mimics共转染正常培养的细胞,常规培养48 h后,收集培养上清液,使用双荧光素酶报告基因检测试剂盒检测荧光素酶活性。
2 结果
2.1miR-221和AdipoR1在LPS诱导的肺泡上皮细胞A549中的表达 与对照组比较,LPS组肺泡上皮细胞中miR-221相对表达水平上调(P<0.05,图1A),AdipoR1 mRNA和蛋白相对表达水平下调(P<0.05,图1B、C和D)。
2.2抑制miR-221对LPS诱导的肺泡上皮细胞A549中炎症因子分泌的影响 与对照组比较,LPS组肺泡上皮细胞培养上清液中IL-1β、IL-6、TNF-α浓度明显升高(P<0.05);与LPS+anti-miR-con组比较,LPS+anti-miR-221组细胞培养上清液中IL-1β、IL-6、TNF-α浓度明显降低(P<0.05)。见图2。
2.3抑制miR-221对LPS诱导的肺泡上皮细胞A549凋亡的影响 与对照组比较,LPS组肺泡上皮细胞凋亡率明显升高(P<0.05),细胞中Bax蛋白表达水平明显升高(P<0.05),Bcl-2蛋白表达水平明显降低(P<0.05);与LPS+anti-miR-con组比较,LPS+anti-miR-221组细胞凋亡率明显降低(P<0.05),细胞中Bax蛋白表达水平明显降低(P<0.05),Bcl-2蛋白表达水平明显升高(P<0.05)。见图3。

图1 LPS诱导肺泡上皮细胞A549中miR-221和Adipo-R1表达变化Fig.1 Expression of miR-221 and AdipoR1 in alveo-lar epithelial cells A549 was induced by LPSNote:A,B.The expressions of miR-221 and AdipoR1 mRNA were detected by qPCR;C,D.The protein expression of AdipoR1 was detected by Western blot.Compared with NC group,*.P
2.4miR-221靶向AdipoR1 生物信息学软件分析显示(图4A),miR-221能够与AdipoR1的3′UTR区结合。双荧光素酶报告实验结果(图4B),过表达miR-221明显抑制AdipoR1的转录活性,而将AdipoR1的3′UTR区突变后抑制作用消失。
Western blot实验结果(图4C),过表达miR-221后细胞中AdipoR1蛋白表达明显降低(P<0.05),而

图2 ELISA检测细胞培养上清液中IL-1β、IL-6和TNF-α表达水平Fig.2 Expression levels of IL-1β,IL-6 and TNF-α in cell culture supernatants by ELISANote:Compared with NC group,*.P P

图3 干扰miR-221对LPS诱导肺泡上皮细胞A549凋亡的影响Fig.3 Effect of interference with mir-221 on apoptosis of alveolar epithelial cells A549 induced by LPSNote:A,B.Apoptosis of alveolar epithelial cells A549 was detected by flow cytometry;C,D.The expressions of apoptosis-related proteins Bax and Bcl-2 were detected by Western blot.Compared with NC group,*.P P
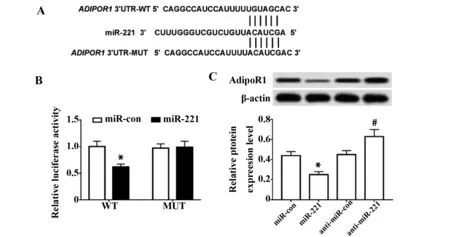
图4 miR-221靶向调控AdipoR1的表达Fig.4 miR-221 targets and regulates expression of AdipoR1Note:A.miR-221 complements the 3′UTR of AdipoR1; B.Luciferase activity was detected; C.Effect of miR-221 expression on AdipoR1 protein expression.Compared with miR-con group,*.P P
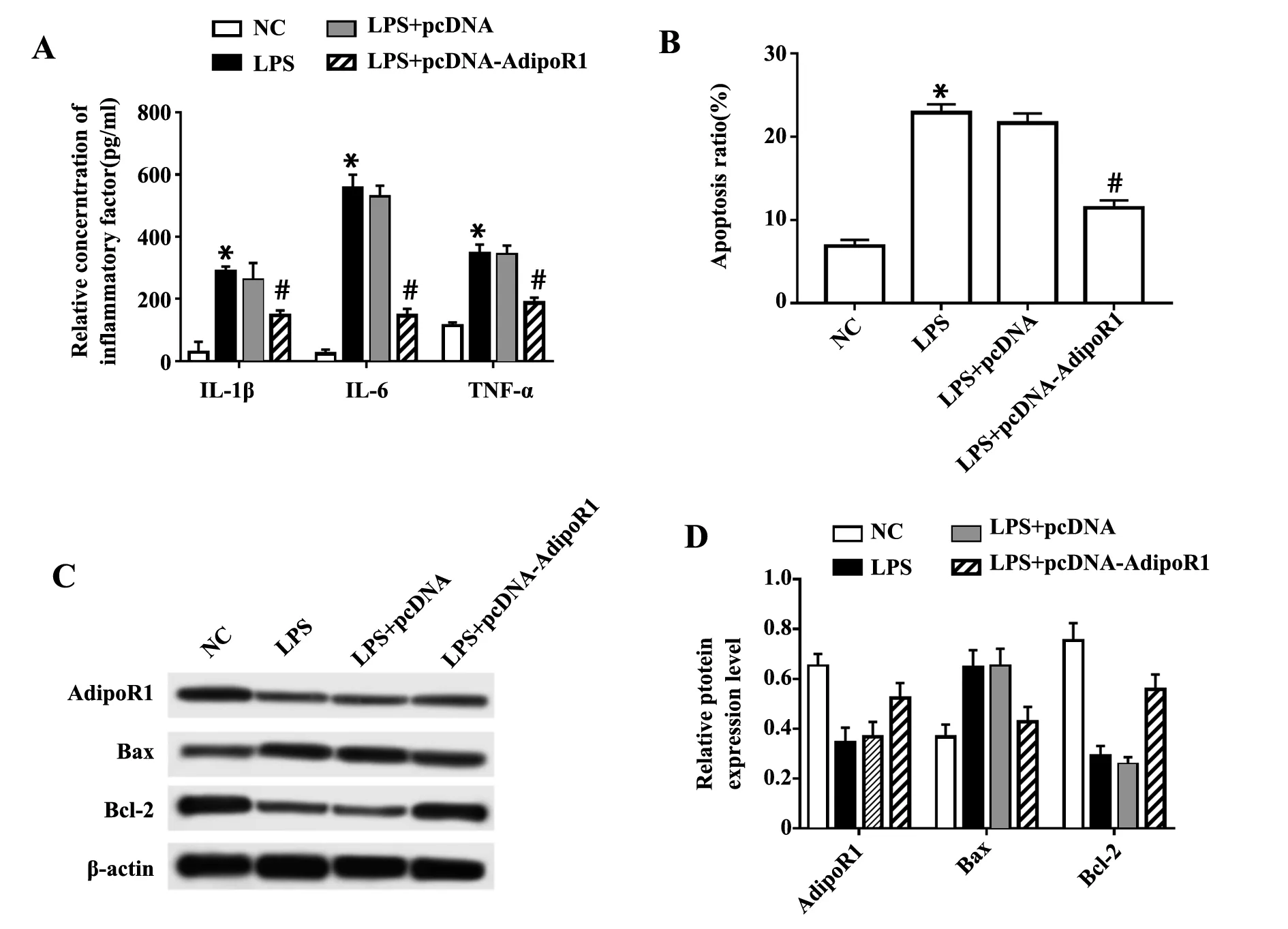
图5 沉默AdipoR1对LPS诱导肺泡上皮细胞A549炎症因子水平和细胞凋亡的影响Fig.5 Effect of silenced AdipoR1 on inflammatory factor level and apoptosis of alveolar epithelial cells A549 induced by LPSNote:A.The expression levels of IL-1β, IL-6 and TNF-α in cell culture supernatant were detected by ELISA; B.Apoptosis of alveolar epithelial cells A549 was detected by flow cytometry; C,D.The protein expressions of AdipoR1, Bax and Bcl-2 were detected by Western blot.Compared with NC group,*.P P
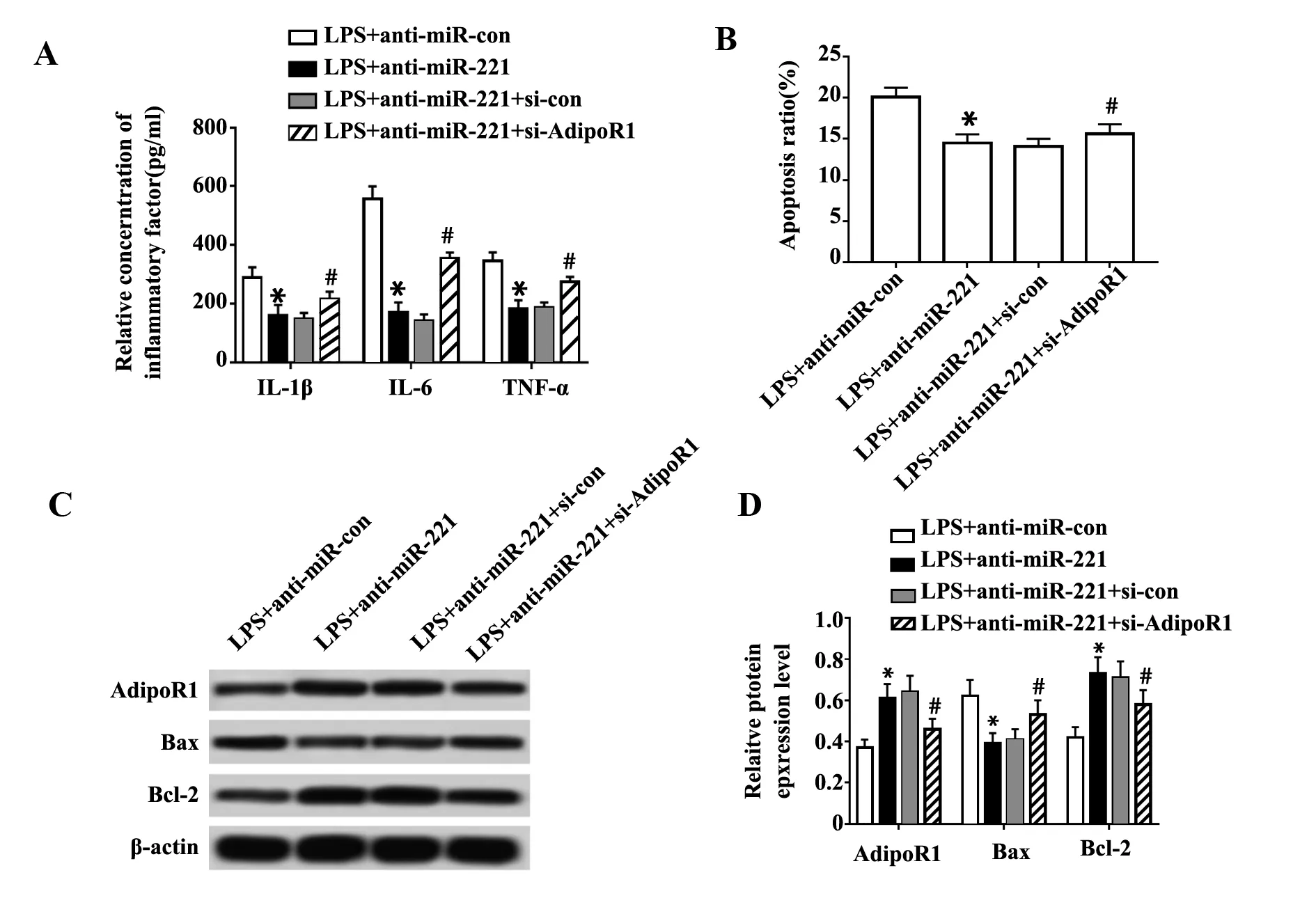
图6 过表达AdipoR1和转染anti-miR-221对LPS诱导肺泡上皮细胞A549炎症因子和细胞凋亡的影响Fig.6 Effects of over-expression of AdipoR1 and transf-ection of anti-miR-221 on inflammatory factors and apoptosis of A549 alveolar epithelial cells induced by LPSNote:A.The expression levels of IL-1β, IL-6 and TNF-α in cell culture supernatant were detected by ELISA; B.Apoptosis of alveolar epithelial cells A549 was detected by flow cytometry; C,D.The protein expressions of AdipoR1, Bax and Bcl-2 were detected by Western blot.Compared with LPS+anti-miR-con group,*.P P
抑制miR-221表达后细胞中AdipoR1蛋白表达明显升高(P<0.05)。
2.5过表达AdipoR1对LPS诱导的肺泡上皮细胞A549炎症因子和细胞凋亡的影响 与LPS+pcDNA组比较,LPS+pcDNA-AdipoR1组细胞中AdipoR蛋白表达明显升高(P<0.05),细胞培养上清液中IL-1β、IL-6、TNF-α浓度明显降低(P<0.05),细胞凋亡率明显降低(P<0.05),细胞中Bax蛋白表达明显降低(P<0.05),Bcl-2蛋白表达明显升高(P<0.05)。见图5。
2.6抑制miR-221和干扰AdipoR1对LPS诱导的肺泡上皮细胞A549炎症因子和细胞凋亡的影响 与LPS+anti-miR-221+si-con组比较,LPS+anti-miR-221+si-AdipoR1组细胞中AdipoR1蛋白表达降低(P<0.05),细胞培养上清液中IL-1β、IL-6、TNF-α浓度升高(P<0.05),细胞凋亡率升高(P<0.05),细胞中Bax蛋白表达升高(P<0.05),Bcl-2蛋白表达降低(P<0.05)。见图6。
3 讨论
miRNA异常改变与炎症信号通路、免疫反应、细胞生理等生物过程密切相关,因此miRNA在人类疾病的靶向治疗中具有潜在的应用前景。Knyazev等[12]报道,miR-221在TNF-α诱导的人脐静脉内皮细胞炎症反应中表达上调,通过作用于靶基因调控细胞周期和炎症反应状态等。Peng等[13]报道,miR-221肥胖脂肪组织中过表达通过靶向抑制SIRT1蛋白表达,引起炎症和胰岛素抵抗,而抑制miR-221则改善炎症和胰岛素敏感性。提示miR-221可能具有促炎作用。本研究结果,LPS诱导肺泡上皮细胞中miR-221表达上调,细胞分泌炎性因子IL-1β、IL-6、TNF-α水平升高;而抑制miR-221后,LPS诱导的细胞炎性因子IL-1β、IL-6、TNF-α分泌明显减少,说明靶向miR-221能够有效抑制LPS诱导的肺泡上皮细胞炎症反应。临床研究表明,在急性肺损伤发生的不同时期均有细胞凋亡现象,细胞过度凋亡将会加重急性肺损伤的病理变化[14,15]。本研究发现,LPS诱导肺泡上皮细胞凋亡率明显升高,而抑制miR-221后有效抑制LPS诱导的细胞凋亡。说明靶向miR-221能够缓解LPS诱导的肺泡上皮细胞损伤,可能对急性肺损伤有改善作用。
目前,脂联素在肺病理中的作用尚存在争议。Chen等[16]报道,脂联素通过AdipoR1/2依赖性刺激细胞溶质磷脂酶A2(cPLA2)和环加氧酶2(COX-2)表达及细胞内活性氧产生,促进过敏原或臭氧诱导的肺部炎症反应。而Nigro等[17]报道,脂联素以剂量和时间依赖性的方式降低TNF-α和IL-1β对人肺泡上皮细胞A549的毒性作用,从而改善细胞活力并减少细胞凋亡,并通过AdipoR1介导抑制NF-κB转录激活而诱导抗炎细胞因子表达。本研究结果,LPS诱导后,肺泡上皮细胞中AdipoR1表达降低,而过表达AdipoR1后明显抑制LPS诱导的细胞凋亡和炎症反应。可能因为过表达AdipoR1有助于脂联素作用发挥,在LPS诱导的肺泡上皮细胞损伤中起到抗炎、抗凋亡作用,其作用与Nigro等研究结果相似。
Liu等[18]报道,miR-6835在LPS诱导的人脐静脉内皮细胞炎症过程中起促进作用,其机制与直接靶向抑制AdipoR1的表达,并调节其下游信号蛋白表达有关。提示靶向干预AdipoR1的表达可能对LPS诱导的细胞炎症反应有改善作用。本研究通过生物信息学软件分析和相关实验证实AdipoR1是miR-221的靶基因,进一步分析发现同时抑制miR-221和AdipoR1基因的肺泡上皮细胞,经LPS处理后,细胞培养上清液中炎性因子IL-1β、IL-6、TNF-α浓度升高,凋亡蛋白Bax表达增多,Bcl-2蛋白表达降低,细胞凋亡率升高,说明抑制AdipoR1基因后,抑制miR-221对LPS诱导的肺泡上皮细胞炎症反应和凋亡的抑制作用消失。因此推测miR-221对LPS诱导的肺泡上皮细胞炎症反应和凋亡的影响是通过靶向AdipoR1基因实现的。
综上所述,LPS诱导的肺泡上皮细胞中miR-221表达上调,AdipoR1表达下调,miR-221可以靶向调控AdipoR1的表达影响LPS诱导的肺泡上皮细胞炎症反应和凋亡,提示miR-221和AdipoR1可能参与LPS诱导的肺泡上皮细胞损伤,有望成为急性肺损伤诊断及治疗的潜在靶点。