过表达配对相关同源框1(PRRX1)通过调控Wnt/β-catenin通路抑制肝癌细胞体内致瘤性①
2020-04-13尹润龙尹东亮卢沛林李柱威林志强
尹润龙 尹东亮 卢沛林 李柱威 林志强
(东莞市人民医院肝胆外科,东莞 523059)
肝细胞癌(hepatocellular carcinoma,HCC)是全球范围内第五大常见癌症和癌症相关性死亡的第三大原因[1]。HCC约占原发性肝癌的90%,每年约有100万人罹患HCC,且已成为全球性的健康问题[2]。尽管外科手术在过去的几十年里取得了较大进步,但HCC患者仍面临较高的术后复发或转移的发生率[3]。因此,探讨HCC发生发展的分子机制并寻求新的治疗措施已成为国内外科研人员的热议话题。越来越多的证据表明,癌症的转移是由处于浸润期的原发性癌症的上皮-间质转化(epithelial-mesenchymal transition,EMT)特性所介导的[4,5]。而EMT被认为是由细胞因子[6]、转化因子[7]和其他因素[8,9]所诱导的侵袭和转移过程中的重要步骤。Wnt/β-catenin信号通路能够调控原胚肠形成、心脏瓣膜形成甚至是癌症发生过程中的EMT[10,11]。激活Wnt/β-catenin通路在胃癌的EMT过程中扮演重要作用[12]。配对相关同源框1(paired-related homoeobox 1,PRRX1)是最近被确认的一种新的EMT诱导物[13]。临床研究表明,PRRX1的异常表达与多种实体肿瘤的不良预后相关;高表达的PRRX1与乳腺癌的低转移率和良好预后显著相关[14],而在结直肠癌和胃癌中却观察到相反的关系[15,16]。此外,下调PRRX1的表达能通过获取肿瘤干细胞样属性促进乳腺癌和HCC患者的不良预后[14,17]。因此,我们推测上调PRRX1的表达极有可能通过Wnt/β-catenin途径参与肝癌细胞的生物学习性的调控。而本研究着重研究PRRX1过表达对肝癌细胞株SMMC-7721体内致瘤性的影响,并联合Wnt/β-catenin通路抑制剂XAV939进行干预,探索Wnt/β-catenin信号通路在PRRX1介导的肝癌细胞致瘤性改变中的作用。
1 材料与方法
1.1材料 人肝癌细胞株SMMC-7721及HEK293细胞购自中国科学院上海细胞生物学研究所细胞库;RPMI1640培养基和胎牛血清(fetal bovine serum,FBS)购自Gibco公司;青霉素、链霉素购自上海拜力生物科技有限公司;LipofectamineTM2000购自Invitrogen公司;Wnt/β-catenin信号通路抑制剂XAV939购自美国Med Chem Express公司;全蛋白提取试剂盒、二喹啉甲酸(bicinchoninic acid,BCA)法蛋白定量测定试剂盒、二氨基联苯胺(diaminobenzidine,DAB)显色试剂盒及原位末端转移酶标记技术(terminal deoxynucleotidyl transferase biotin-dUTP nick end labeling,TUNEL)细胞凋亡检测试剂盒购自南京建成生物工程研究所;Ki-67细胞增殖检测试剂盒购自江苏凯基生物技术股份有限公司;超敏电化学发光(electrochemical lumines-cence,ECL)检测试剂盒购自上海碧云天生物技术研究所;山羊抗人PRRX1多克隆抗体、兔抗人β-连环蛋白(β-catenin)多克隆抗体、兔抗人原癌基因(c-Myc)单克隆抗体以及兔抗人β-actin多克隆抗体购自英国Abcam公司;辣根过氧化物酶(horseradish peroxidase,HRP)标记的兔抗山羊IgG和HRP标记的山羊抗兔IgG购自武汉博士德生物工程有限公司;5~6周龄雌性BALB/c裸鼠购自北京华阜康生物科技股份有限公司;光学显微镜为日本Olympus公司产品;轮转式切片机为杭州艾普仪器设备有限公司产品;全自动数码凝胶成像仪为上海天能科技有限公司产品。
1.2方法
1.2.1HEK293T细胞的培养及PRRX1重组慢病毒的制备 将HEK293T细胞置于含有100 ml/L FBS、100 U/ml青霉素、100 μg/ml链霉素的RPMI1640培养基中,在37℃、5%CO2的环境下培养。本实验中PRRX1重组慢病毒质粒pLV-PRRX1-IRES2-EGFP及空载重组质粒pLV-CON-IRES2-EGFP的构建及鉴定由上海吉凯基因化学技术有限公司完成;转染前,取生长状态良好的处于对数生长期的HEK293T细胞,提前2 d接种于培养皿中。取5 μg PRRX1重组慢病毒质粒、5 μg辅助质粒与相应体积的Opti-MEM混合均匀,总体积为2.5 ml,于室温下孵育5 min,以空载重组质粒作阴性对照。取100 μl LipofectamineTM2000与2.4 ml Opti-MEM混合,室温孵育5 min。再将两种Opti-MEM混合液混合形成转染复合物,共转染HEK293T细胞。转染12 h后,更换新鲜培养基继续培养48 h后,收集细胞上清液,离心、过滤。上清液于4℃、25 000 r/min条件下离心2 h,所获病毒分别命名为LV-PRRX1和LV-CON,-80℃保存备用。
1.2.2慢病毒滴度的测定 测定前一天,在24孔板中接种HEK293T细胞,每孔接种约5.0×104个细胞加入100 μl含10% FBS的RPMI1640培养液,于37℃,5%CO2培养箱中培养24 h。待细胞融合度达到30%左右时,吸弃24孔板中原有的培养液,将包装后收集的病毒上清液进行梯度稀释(10-1~10-7)后分别滴加到24孔板内,其中第一个EP管稀释10-1,即10 μl 病毒液+90 μl含10% FBS的RPMI1640培养液;第二个EP管所得病毒原液为第一个EP管的1/10;依次类推,第七个EP管所得病毒原液为第六个EP管的1/10。将每个EP管中溶液混匀后滴加到24孔板中,于37℃,5%CO2培养箱中培养24 h后加入100 μl含10%FBS的RPMI1640培养液,继续培养。72 h后,在显微镜下观察,计算最后两个孔GFP荧光阳性细胞数,其中第六孔荧光细胞数目记为A,第七孔荧光细胞数目记为B。按下式计算病毒滴度:病毒滴度(TU/L)=(A+B×10)×103/2/第六孔的病毒液的含量(μl)×103。所得结果为:LV-PRRX1(病毒滴度)=2.5×1010U/L;LV-CON(病毒滴度)=4×1010U/L。
1.2.3SMMC-7721细胞培养及慢病毒感染 将SMMC-7721细胞置于含有100 ml/L FBS、100 U/ml青霉素、100 μg/ml链霉素的RPMI1640培养基中,在37℃、5% CO2的环境下培养。取生长处于对数期的SMMC-7721细胞,制成单细胞悬液按每孔1.0×105个接种于24孔板中,待细胞融合达50%时,予以慢病毒LV-PRRX1和LV-CON均以感染复数(MOI)为100分别感染细胞(即两种慢病毒用量均为1.0×105×MOI=107TU,按上述1.2.2病毒滴度测定结果换算成体积为:VLV-PRRX1=107U/2.5×1010U/L=0.4 ml;VLV-CON=107U/4×1010U/L=0.25 ml),同时设置正常培养的细胞为空白对照组。病毒感染12 h后更换新鲜培养基继续培养,2~3 d传代1次。5 d后,在荧光显微镜下观察各组细胞GFP的表达情况,并采用Western blot检测各组细胞PRRX1的表达。
1.2.4裸鼠皮下移植瘤模型的构建及实验分组 分别取对数生长期的对照组、LV-CON组和LV-PRRX1组SMMC-7721细胞制备成细胞悬液,调整细胞数至2×106个/ml,后注射于裸鼠右侧背部皮下(剂量:0.2 ml/只);其中对照组、LV-CON组每组10只,LV-PRRX1组20只。约1周后,待实验裸鼠接种部位长出肉眼可见肿瘤(肿瘤直径约0.5 cm)时,选取对照组和LV-CON组裸鼠各5只,LV-PRRX1组10只进行干预治疗。其中LV-PRRX1组裸鼠又随机分为2组:LV-PRRX1组及LV-PRRX1+XAV939处理组(n=5)。治疗时,对照组、LV-CON组及LV-PRRX1组每只裸鼠均行0.2 ml生理盐水肿瘤处注射;而LV-PRRX1+XAV939处理组每只裸鼠行0.2 ml XAV939生理盐水注射液(XAV939浓度:0.25 mg/ml)肿瘤处注射,每周2次;连续治疗4周。治疗期间密切观察裸鼠的生存状态,从治疗当天起,每4 d测量1次瘤体,瘤体计算公式为:V=L×W2/2(L:瘤体长度;W:瘤体宽度)。末次测量后,裸鼠脱臼处死,切除肿瘤并拍照。后将每组一部分肿瘤保存在4%多聚甲醛中固定,另一部分-80℃冻存备用。
1.2.5HE染色观察瘤体组织病理变化 取固定了48 h的各组裸鼠瘤体标本,梯度乙醇脱水,二甲苯透明,石蜡包埋制作病理切片(厚度3 μm)。将石蜡切片依次再经脱蜡、苏木精染色、分化以及蓝化后伊红染色、洗涤脱水以及透明后封片。光镜下观察染色并采集图片。
1.2.6TUNEL染色检测瘤体组织细胞凋亡 将制作好的瘤体石蜡切片(厚度5 μm)依次进行TUNEL染色处理:烤片和脱蜡;水化;蛋白酶K工作液常温孵育15~30 min;滴加50 μl TUNEL反应混合液于样品上,在湿盒、暗室中37℃避光孵育60 min;用PBS冲洗3次;加入50 μl转化剂-POD于样品上,在湿盒中37℃避光孵育30 min;用PBS冲洗3次;加入100 μl DAB底物,于25℃孵育10 min;用PBS冲洗3次;苏木素复染、脱水、透明;封片,光镜下观察;阳性结果判断:阳性染色的细胞核染成棕褐色,为凋亡细胞。随机选择3个视野,观察凋亡细胞并计算凋亡率。
1.2.7免疫组化检测瘤体组织Ki-67表达 根据试剂盒操作,将制作好的瘤体石蜡切片(厚度5 μm)依次进行Ki-67染色处理:将制备的组织用柠檬酸缓冲液(pH=6)处理20 min进行抗原修复;然后,将组织置于3% H2O2中,常温加湿室中10 min,消除内源性过氧化物酶活性,再用PBS冲洗3次;加入兔抗人Ki-67一抗(稀释比1∶500)在4℃下,孵育过夜;然后滴加即用型HRP标记的羊抗兔IgG二抗(稀释比1∶500)室温孵育30 min;DAB显色后苏木精复染3 min。着色后,用梯度乙醇(75%、85%、95%、100%)和二甲苯脱水,用中性树脂固定、封片。光学显微镜下观察Ki-67阳性细胞并统计阳性率。
1.2.8Western blot检测瘤体组织蛋白表达 取-80℃冻存的各组细胞或瘤体组织,分别进行全蛋白提取,后进行浓度检测;取20 μg蛋白和4 μl 2×SDS上样缓冲液混合均匀,100℃变性10 min;上样,10% SDS-PAGE凝胶电泳分离后转至PVDF膜上;用5%脱脂牛奶封闭1 h;PBS洗膜;PBS洗膜后分别加入一抗(PRRX1,1∶1 000;β-catenin,1∶1 000;c-Myc,1∶800;β-actin,1∶1 500)在4℃下,孵育过夜;PBS洗膜;加入HRP标记的兔抗羊IgG二抗(1∶2 500)或羊抗兔IgG二抗(1∶2 500)室温孵育0.5 h;PBS洗膜;用ECL化学发光进行显色。以β-actin为内参蛋白,采用Quantity One图像处理软件对各指标灰度值进行半定量分析。

2 结果
2.1LV-PRRX1慢病毒感染促进了SMMC-7721细胞PRRX1蛋白表达 Western blot检测各感染组SMMC-7721细胞中PRRX1蛋白的表达情况。与正常对照组比较,LV-CON组细胞PRRX1蛋白水平无显著差异;与LV-CON组比较,LV-PRRX1组细胞PRRX1蛋白水平显著增加(P<0.05,图1)。说明PRRX1过表达的稳转SMMC-7721细胞株构建成功。
2.2PRRX1过表达抑制了SMMC-7721细胞裸鼠移植瘤的生长 采用生理盐水或XAV939对移植瘤进行干预并绘制移植瘤生长曲线。与正常对照组比较,LV-CON组裸鼠移植瘤生长速度无显著差异(图2);从治疗12 d起,与LV-CON组比较,LV-PRRX1组裸鼠移植瘤体积显著降低(P<0.05),肿瘤生长缓慢;从治疗20 d起,与LV-PRRX1组比较,LV-PRRX1联合XAV939组裸鼠移植瘤体积显著降低(P<0.05),肿瘤生长进一步减慢;治疗28 d取样结果显示,LV-PRRX1组裸鼠移植瘤体积显著低于LV-CON组,而与LV-PRRX1组比较,LV-PRRX1联合XAV939组裸鼠移植瘤体积更小。提示PRRX1过表达显著抑制SMMC-7721细胞裸鼠移植瘤的生长,且XAV939对这一效应具有一定的促进作用。

图1 Western blot检测各组细胞中PRRX1蛋白表达Fig.1 Protein expression of PRRX1 in each group was tested by Western blotNote:1.Control group;2.LV-CON group;3.LV-PRRX1 group.Com-pared with LV-CON group,*.P

图2 各组裸鼠移植瘤生长曲线Fig.2 Growth curve of transplanted tumor in each groupNote:A.Tumor growth curve;B.Transplanted tumor at 28th day.1.Control group;2.LV-CON group;3.LV-PRRX1group;4.LV-PRRX1+XAV939 group.Compared with LV-CON group,*.P P
2.3PRRX1过表达促进了SMMC-7721细胞裸鼠移植瘤组织坏死 采用HE染色观察各组裸鼠移植瘤的病理学变化(图3)。正常对照组与LV-CON组移植瘤组织中肿瘤细胞细胞核明显、分布密集,且着色较深,细胞相对完整;LV-PRRX1组肿瘤细胞细胞核固缩,细胞间隙变大,分布弥散,有淋巴细胞浸润现象;而LV-PRRX1联合XAV939组细胞核固缩、淋巴细胞浸润现象更加明显,部分细胞坏死。提示PRRX1过表达促进了SMMC-7721细胞裸鼠移植瘤组织坏死,而且XAV939能进一步促进这一作用。
2.4PRRX1过表达促进了SMMC-7721细胞裸鼠移植瘤肿瘤细胞凋亡 采用TUNEL染色观察各组裸鼠移植瘤肿瘤细胞凋亡状况(图4)。正常对照组与LV-CON组移植瘤组织中肿瘤细胞凋亡率无显著差异;与LV-CON组比较,LV-PRRX1组肿瘤细胞凋亡率显著增加(P<0.05);而与LV-PRRX1组比较,LV-PRRX1联合XAV939组肿瘤细胞凋亡率显著增加(P<0.05)。提示PRRX1过表达促进了SMMC-7721细胞裸鼠移植瘤肿瘤细胞凋亡,而且XAV939能进一步促进这一作用。

图3 HE染色观察移植瘤病理变化(×200)Fig.3 Pathological changes of transplanted tumor were observed by HE staining(×200)Note:1.Control group;2.LV-CON group;3.LV-PRRX1group;4.LV-PRRX1+XAV939 group.

图4 TUNEL染色检测各组移植瘤肿瘤细胞凋亡(×200)Fig.4 Apoptosis of tumor cells of transplanted tumors in each group was detected by TUNEL staining(×200)Note:A.TUNEL staining;B.Percentage of apoptotic cells.1.control group;2.LV-CON group;3.LV-PRRX1group;4.LV-PRRX1+XAV939 group.Compard with LV-CON group,*.P P

图5 免疫组化检测各组移植瘤中Ki-67的表达(×200)Fig.5 Expression of Ki-67 in transplanted tumor tissue was detected by immunohistochemical staining(×200)Note:A.Immunohistochemical staining;B.Percentage of positive cells.1.Control group;2.LV-CON group;3.LV-PRRX1 group;4.LV-PRRX1+XAV939 group.Compared with LV-CON group,*.P P
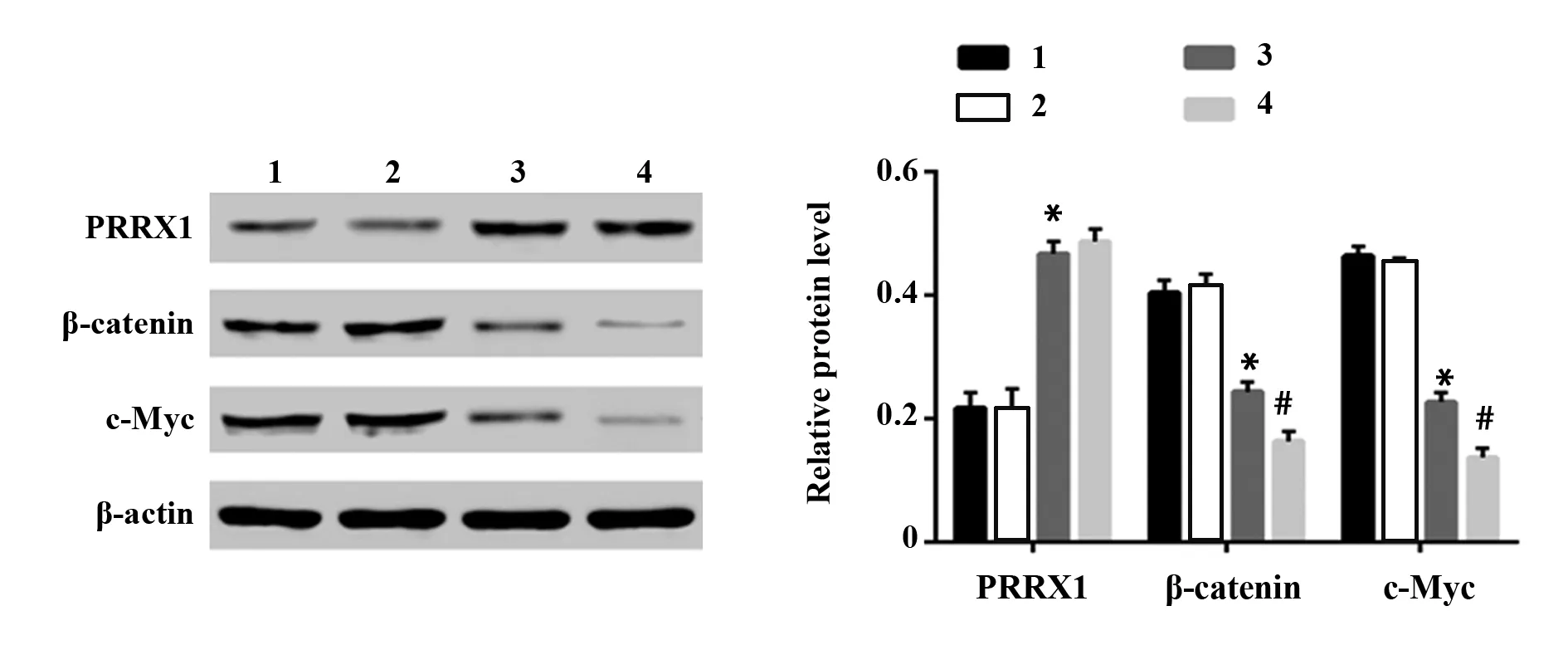
图6 Western blot检测各指标蛋白表达水平Fig.6 Protein expression levels of each indicator were tested by Western blotNote:1.Control group;2.LV-CON group;3.LV-PRRX1 group.4.LV-PRRX1+XAV939 group.Compared with LV-CON group,*.P P
2.5PRRX1过表达抑制了SMMC-7721细胞裸鼠移植瘤中Ki-67的表达 采用免疫组化观察各组裸鼠移植瘤中Ki-67的表达(图5)。正常对照组与LV-CON组Ki-67阳性细胞占比无显著差异;与LV-CON组比较,LV-PRRX1组Ki-67阳性细胞占比显著降低(P<0.05);而与LV-PRRX1组比较,LV-PRRX1联合XAV939组Ki-67阳性细胞占比显著降低(P<0.05)。提示PRRX1过表达抑制了SMMC-7721细胞裸鼠移植瘤中Ki-67的表达,而且XAV939能进一步促进这一作用。
2.6Wnt/β-catenin信号通路参与PRRX1过表达对SMMC-7721细胞体内致瘤性的调控 采用Western blot检测各组移植瘤中PRRX1蛋白及Wnt/β-catenin通路相关蛋白β-catenin、c-Myc的表达(图6)。与LV-CON组比较,LV-PRRX1组PRRX1蛋白水平显著升高(P<0.05),β-catenin、c-Myc蛋白水平显著降低(P<0.05);而与LV-PRRX1组比较,LV-PRRX1联合XAV939组PRRX1蛋白水平无显著变化,而β-catenin、c-Myc蛋白水平显著降低(P<0.05)。提示PRRX1过表达通过抑制Wnt/β-catenin信号通路进而发挥抗肿瘤作用。
3 讨论
已有研究表明,低表达的PRRX1是HCC患者拥有较差5年生存期的独立预后因素;下调PRRX1的表达能通过获取肿瘤干细胞样属性促进HCC患者的不良预后[18]。Wnt/β-catenin是一种在进化过程中高度保守的信号通路,且已被证明在包括HCC在内的多种多发性肿瘤中过度活跃[19,20]。本研究主要研究过表达PRRX1是否通过抑制Wnt/β-catenin信号通路降低肝癌细胞的体内致瘤性。
不同于一般的EMT诱导剂,PRRX1作为一种新的EMT诱导剂已被证明参与肿瘤干细胞特性的获取,且PRRX1的缺失促进了乳腺癌和HCC在体内的转移[14,18]。而本研究显示,过表达PRRX1显著抑制了肝癌细胞裸鼠移植瘤的生长。但过表达PRRX1被证明与结直肠癌的不良预后和转移密切相关[15]。在对于HCC细胞的生物学属性进行研究时发现,下调PRRX1的表达显著抑制了HCC细胞的凋亡,并促进了迁移和侵袭能力[17]。但在胃癌和肺癌的相关研究中发现,显著上调PRRX1的表达才能增加癌细胞的EMT属性,主要表现为细胞增殖、迁移和侵袭能力的增加[16,21]。这提示PRRX1作用在不同类型肿瘤中的存在异质性。此外,PRRX1同样参与肿瘤化学抗性的调控,例如在人肝癌细胞株(HuH7、Hep3B、HepG2和PLC/PRF/5)中,过表达PRRX1增加了对5-FU的药物敏感性[18]。同样在肝癌细胞株中,过表达PRRX1降低了放疗、化疗过程中的肿瘤干细胞阳性率[22]。结合本研究其他实验结果,过表达PRRX1促进了移植瘤的组织坏死,增加了瘤体组织的肿瘤细胞凋亡,下调了瘤体组织Ki-67的表达;我们证实过表达PRRX1能显著降低肝癌细胞的体内致瘤能力。
异常激活Wnt/β-catenin信号通路在许多类型的人类肿瘤中普遍存在,且它被认为能促进肿瘤的发展。抑制Wnt/β-catenin信号通路成为多种肿瘤靶向治疗的有效途径。例如,在食管鳞状细胞癌中,婆罗双树样基因4(SALL4)沉默被证明能通过抑制Wnt/β-catenin信号通路的活化来促进癌细胞EMT向MET转化,进而抑制癌细胞体外的生存、迁移、侵袭及抗药性,以及体内成瘤能力[23]。以siRNA干扰β-catenin的表达能通过抑制Wnt/β-catenin信号通路显著增加食管癌顺铂化疗的敏感性[24]。而在HCC中,Wnt/β-catenin信号通路被证明参与了miR-610介导的癌细胞生物学习性,下调miR-610的表达能激活Wnt/β-catenin信号通路促进癌细胞的增殖活性、周期进程及体内致瘤能力[25]。在乳腺癌中,miR-1299过表达通过激活Wnt/β-catenin信号通路促进癌细胞的增殖及成瘤能力[26]。在宫颈癌中,沉默孤核受体DAX1能显著抑制癌细胞的体外增殖、癌症干细胞属性以及体内成瘤能力,且这一效应同样被证明与抑制Wnt/β-catenin信号通路的活化有关[27]。在本研究中我们发现,PRRX1过表达能显著降低Wnt/β-catenin信号通路核心蛋白β-catenin以及其下游效应因子c-Myc的表达水平;Wnt/β-catenin通路抑制剂XAV939对PRRX1过表达抑制移植瘤的生长具有协同作用,提示Wnt/β-catenin通路参与了PRRX1介导的肝癌细胞体内致瘤能力的调控。
综上所述,PRRX1过表达能显著抑制肝癌细胞体内致瘤性,主要表现为促进瘤体组织坏死,促进肿瘤细胞凋亡,进而抑制移植瘤的恶性生长。这一机制可能与抑制Wnt/β-catenin信号通路密切相关,联合应用Wnt/β-catenin信号通路抑制剂和PRRX1过表达调控可能成为肝癌治疗十分具有潜力的方案。
