脂肪酶对油脂体外降解及消化的研究
2020-04-10张珍珍郑达文刘文秀黄小桃陈冰菲
张珍珍,郑达文,宁 冬,刘文秀,黄小桃,陈冰菲
(东莞泛亚太生物科技有限公司,广东 东莞 523808)
油脂是人和动物生存和生活所必需的重要成分。油脂不仅是一种食物资源,也是医药、化工、农业等行业的一种基本原料[1]。油脂的降解大部分会依托于生物体自身的脂肪代谢过程,对人和单胃动物而言,油脂的消化主要集中在十二指肠下部和空肠上部,经过肠道胆汁的乳化作用使得其表面积增加,然后在胰脂肪酶的作用下将游离脂肪酸从三酰甘油分子中水解[2-5]。
除了人体和动物体能自身分泌的内源脂肪酶外,外源脂肪酶也在食品烘焙、奶酪制备、动物饲料方面[6-8]作为添加剂被广泛使用,以提高产品品质。近年研究发现,脂肪酶在人造奶和废油脂降解等方面也同样具有很好的开发前景。Qin等[9]利用脂肪酶催化酸解猪板油与油茶籽油脂肪酸的反应从而制备富含OPO的婴幼儿人乳替代品;赵璞[10]通过对9种植物油添加脂肪酶进行酯交换反应模拟母乳化脂肪脂质的制备;彭元怀等[11]尝试通过添加脂肪酶优化水解地沟油工艺,提高其利用附加值等。
目前脂肪酶降解油脂的研究大多集中在对原始动物油脂和少部分植物油脂上,而脂肪酶的主要作用阶段是在小肠阶段,此时油脂经过口腔、胃和小肠前端的蠕动早已进入到乳化状态[12-13],其更有利于脂肪酶的后续作用。本文对猪油、鸭油、菜籽油、大豆油等油脂进行初步乳化,再测定添加脂肪酶后生成的脂肪酸含量。由于动物的饮食相对固定并更有规律,且猪的消化道结构及消化生理与人体的非常接近[14],本文采用与人消化道结构接近的猪模型,模拟猪的胃肠道消化过程,研究经过胃液处理阶段的脂肪酶是否仍有降解油脂的功效。这对于进一步了解脂肪酶在不同动植物油脂中的作用效果及在食品和饲料中的合适添加剂量都具有一定的指导意义。
1 材料与方法
1.1 试验材料
菜籽油、大豆油,购于农产品市场;猪油、鸭油、棕榈油,由东莞兴业饲料有限公司提供;脂肪酶,来源于东莞泛亚太生物科技有限公司,初始酶活为80 000 U/g。
聚乙烯醇(PVA),酚酞,胃蛋白酶(Sigma-7000),α-淀粉酶(Sigma A3306),胰蛋白酶(Amresco 0785),糜蛋白酶(Amresco 0164),氯霉素,磺基水杨酸。
分光光度计,高速匀浆机,电磁搅拌器,恒温振荡培养箱,抽滤装置,Whatman无氮滤纸,IKA200量热仪。
1.2 试验方法
1.2.1 乳化油脂的制备
乳化方法参考GB/T 23535—2009。称取聚乙烯醇(PVA)40 g,加水800 mL,在沸水浴中加热、搅拌直至全部溶解,冷却后定容至1 000 mL,用干净的双层纱布过滤,取滤液150 mL,加入50 mL待测油脂样品,用高速匀浆机处理6 min,得到乳白色PVA乳化油脂,现用现配。
1.2.2 乳化油脂酶解时间的确定
分别取4 mL大豆油、菜籽油、棕榈油、鸭油和猪油的乳化油脂,加入5 mL pH 7.5磷酸缓冲液,40℃、180 r/min恒温振荡箱预热5 min,加入10 U脂肪酶,充分摇匀,分别反应0、0.5、1、2、3、4、5、6 h,加入95%乙醇15 mL,终止反应。反应液中加入10 g/L酚酞指示剂2滴,用氢氧化钠标准溶液滴定,直至微红色并保持30 s不褪色为滴定终点,记录消耗氢氧化钠标准溶液的体积,计算脂肪酸含量,根据脂肪酸含量确定酶解时间。
1.2.3 乳化油脂酶解酶活剂量的确定
分别取4 mL大豆油、菜籽油、棕榈油、鸭油和猪油的乳化油脂,加入5 mL pH 7.5磷酸缓冲液,40℃、180 r/min恒温振荡箱预热5 min,分别加入0、5、10、20、40、80、170、200、230、260 U脂肪酶,充分摇匀,按照1.2.2确定的酶解时间及方法进行试验,最终确定最佳酶活剂量。
1.2.4 体外模拟胃肠道消化
1.2.4.1 试验日粮及组成
试验日粮以乳仔猪玉米、豆粕日粮为主要原料,参照NRC[15]推荐的营养需求标准。日粮配方见表1。
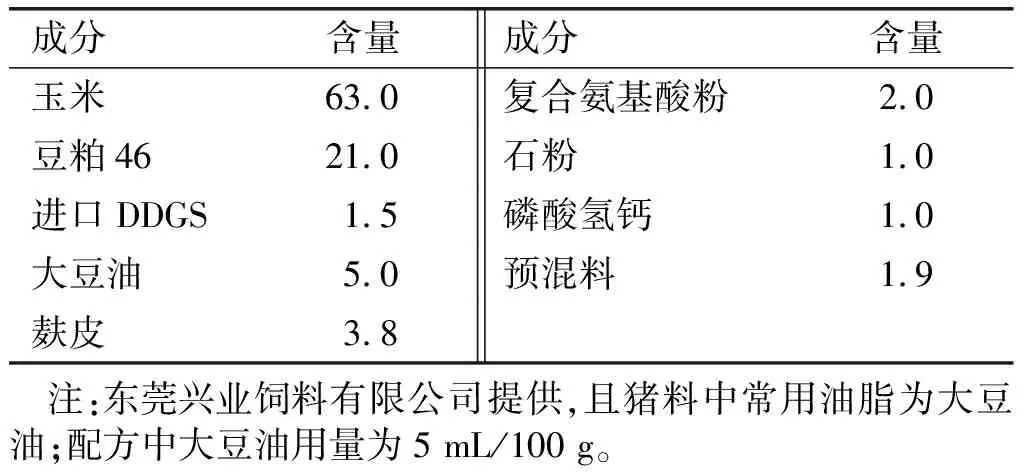
表1 试验日粮组成和营养水平 %
1.2.4.2 消化样品的制备
将饲料样品粉碎,过60目筛,置于干燥器内保存待测。
1.2.4.3 干物质含量测定
饲料样品水分测定参见GB/T 6435—2014《饲料中水分的测定》。干物质含量=1-水分含量。
1.2.4.4 胃肠道消化
小肠缓冲液、模拟猪胃液和模拟猪小肠液均按照赵峰等[16]的方法配制,因是高油脂原料,故体外消化过程参考何科林等[17]方法,并略作改动。
模拟猪胃液:称取184.375 kU胃蛋白酶于250 mL pH 2.0的盐酸溶液中(39℃下标定pH),缓慢搅拌直至溶解,临用前配制。
小肠缓冲液:称取8.32 g无水磷酸氢二钠,40.96 g无水磷酸二氢钠,11.55 g氯化钠和2.45 g氯化钾,氯霉素5 g,放入2 000 mL烧杯中,加入1 800 mL去离子水溶解,并用无水氢氧化钠在39℃下调节溶液的pH至6.44,再用去离子水定容至2 000 mL。
模拟猪小肠液:分别称取60.89 kUα-淀粉酶,19.00 kU胰蛋白酶,2.39 kU糜蛋白酶,溶解于25 mL去离子水中,并缓慢搅拌至溶解,临用前配制。
准确称取1 g过60目筛的饲料样品,根据1.2.3酶活剂量的结果加入稀释后指定酶活的脂肪酶,加入15 mL的模拟猪胃液和0.5 mL 0.5%氯霉素溶液,小心混合均匀后,具塞封口,于39℃、120 r/min消化1 h。
胃消化阶段结束后,向食糜中加入14 mL小肠缓冲液,并用1 mol/L HCl或1 mol/L NaOH调整食糜pH至6.44,加入2 mL模拟小肠液,39℃、120 r/min消化4 h。
待消化完毕,向消化残渣中加入5 mL 20%磺基水杨酸,室温放置30 min,将消化液真空抽滤,并用1%磺基水杨酸对消化瓶进行完全冲洗,随后将残渣连同已知质量的Whatman无氮滤纸取出,参考1.2.4.3方法测定残渣干物质含量,按下式计算样品的干物质消化率,随后用量热仪测定干燥残渣能值,按下式计算能量消化率。
干物质消化率=(M1-M2)/M1×100%
能量消化率=(E1-E2)/E1×100%
式中:M1为饲料样品干物质质量,g;M2为残渣干物质质量,g;E1为饲料样品总燃烧热值,J;E2为残渣总燃烧热值,J。
1.2.5 数据分析
试验数据先用Microsoft Excel进行初步整理后,再用SPSS 20.0软件进行统计分析。P<0.05表示差异显著。
2 结果与分析
2.1 酶解时间对乳化油脂酶解的影响
不同乳化油脂添加10 U脂肪酶后在不同酶解时间下生成的脂肪酸含量变化如表2所示。
表2 添加10 U脂肪酶时不同酶解时间乳化油脂生成的脂肪酸含量变化
由表2可知,酶解4 h时,不同乳化油脂生成的脂肪酸含量已经趋于稳定,故将脂肪酶酶解时间定为4 h。从表2中也可看出:棕榈油、猪油的乳化油脂中的初始脂肪酸含量较高,加酶后产生的脂肪酸的增长幅度也显著大于大豆油、鸭油和菜籽油的乳化油脂(P<0.05),这可能与大豆油、菜籽油和鸭油脂肪酸组成中中短链脂肪酸含量要远低于长链脂肪酸有关[18-19],且此类油脂中含量较高的不饱和脂肪酸大都分布于Sn-2位[20],不利于脂肪酶的消化分解,所以产生的脂肪酸量相对较低;而棕榈油和猪油中16碳原子的饱和棕榈酸含量较高,分别达到了43%和23%,且多分布于Sn-1,3位[21],说明当该脂肪酶不足时,可能更倾向于优先结合Sn-1,3位酯键发生水解反应。
2.2 酶活剂量对乳化油脂酶解的影响
添加不同酶活剂量的脂肪酶到乳化油脂中反应4 h后生成的脂肪酸含量变化如表3所示。
由表3可知,随着脂肪酶酶活剂量的增加,各乳化油脂的脂肪酸生成量也越大,脂肪酶酶活剂量达到200 U时,各乳化油脂生成的脂肪酸含量均已趋于饱和,故将200 U定为随后模拟动物试验的最终酶活剂量。由表3也可看出:在添加0~260 U脂肪酶时,棕榈油、猪油乳化油脂产生的脂肪酸量始终大于大豆油、鸭油和菜籽油乳化油脂(P<0.05),也更早达到其峰值(170 U);纵向分析加酶后产生的脂肪酸总增加量,大豆油、菜籽油、棕榈油、猪油、鸭油乳化油脂的脂肪酸总增加量分别为1.64、1.54、1.66、1.67、1.67 mmol/L,脂肪酸总增加率分别为546.7%、810.5%、325.5%、347.9%、596.4%,各组间脂肪酸总增加量差异并不大,以菜籽油的为略低,菜籽油脂肪酸组成中大于18碳原子的脂肪酸达到80%以上[22],这其实也与Pouton等[23]研究的中链脂肪酸比长链脂肪酸水溶解性更好的结论一致;另外,由于菜籽油乳化油脂膏的初始脂肪酸量基准较低(0.19 mmol/L),其脂肪酸总增加率反而达到了810.5%,远高于其他乳化油脂的。
表3 添加不同酶活剂量脂肪酶时乳化油脂生成的脂肪酸含量变化
2.3 脂肪酶对单胃动物消化吸收的影响(见表4)
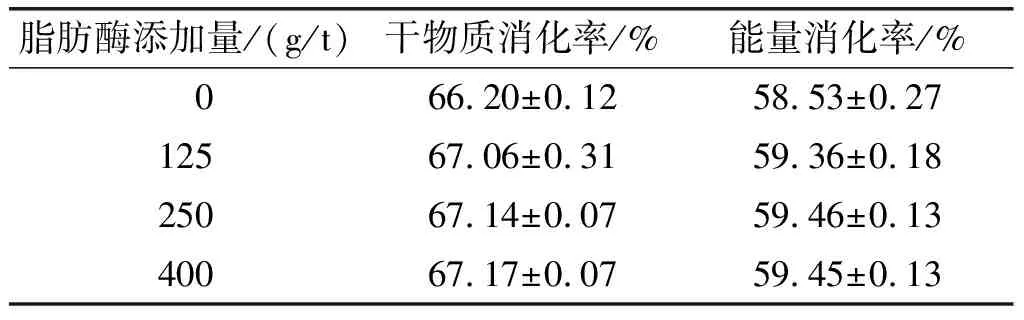
表4 脂肪酶对乳仔猪干物质消化率、能量消化率的影响
由表4可知:当脂肪酶添加量为125 g/t(以饲料质量计,下同)时,脂肪酶对大豆油的添加量等同于1 mL大豆油添加200 U脂肪酶,此时干物质消化率和能量消化率相比不加酶组分别增长0.86个百分点和0.83个百分点,这在仅添加单酶的基础上,对动物的营养消化吸收效果可谓非常明显,也从侧面说明该脂肪酶具有一定的抗胃液特性;当脂肪酶添加量为250 g/t时,消化率相比125 g/t组的略有提升,但并不明显,添加量继续增加则消化率基本不再变化。由于饲料配方原料结构的多样性,饲料中其他成分也会含有少量脂肪,故脂肪酶添加量略高于125 g/t或与其他酶,如淀粉酶、脂肪酶、纤维素酶和半纤维素酶结合使用,则对饲料降解的协同效应可能会更好[24]。
3 结 论
由于油脂必须先乳化成乳糜颗粒,然后才能在肠道中进一步降解吸收,而脂肪酶又主要是在小肠阶段与内源胰脂肪酶一起发挥作用的。故本文放弃采用原始油脂,而对油脂进行初步乳化后来测定脂肪酶对其降解效果。研究发现:①添加200 U脂肪酶到4 mL乳化油脂(即1 mL原始油脂)中反应4 h后,产生的脂肪酸量即可基本达到峰值;②添加不同剂量脂肪酶时,棕榈油和猪油乳化油脂生成的脂肪酸量始终大于大豆油和鸭油乳化油脂的,而菜籽油乳化油脂的最低,组间差异显著(P<0.05),相比不加酶组,加入260 U脂肪酶后,大豆油、菜籽油、棕榈油、猪油和鸭油乳化油脂的脂肪酸总增加量均大于1.50 mmol/L,但各油脂组间差异不大,脂肪酸总增加率均提高300%以上(脂肪酶加入260 U时),其中菜籽油提升率可达到810.5%,加酶后效果显著;③乳猪料中添加脂肪酶(脂肪酶酶活80 000 U/g)可提高干物质消化率和能量消化率,添加量以略高于125 g/t为佳。
本文仅采用1种微生物来源的脂肪酶进行试验,而不同脂肪酶的酶活、温度特性、酸度特性、底物特异性及抗胃蛋白酶特性等各有差别,故本文油脂中脂肪酶添加量仅可作为参考,不同来源脂肪酶剂量可能会有所浮动。另外,不同脂肪酶水解位点也会有不同,如母乳中胰脂酶和大部分商业脂肪酶会优先水解作用于甘油三酯的Sn-1位或Sn-3位酯键,而猪胰脂肪酶水解甘油三酯时却没有选择性,故脂肪酶的作用机理也是下一步探索的方向。
