iRhom2Uncv小鼠乳腺发育障碍的转录组分析*
2020-04-09尚艳姣周小军郭子潇
尚艳姣 周小军 郭子潇 袁 征
(军事科学院军事医学研究院实验动物中心,北京 100071)
乳腺在激素的刺激下可分泌乳汁,乳腺发育障碍影响泌乳功能。影响小鼠乳腺发育的原因主要有两方面,一方面是激素,包括雌激素、催乳素、孕激素和它们的下游旁分泌效应子[1],催乳素和雌激素协同促进导管延伸、分叉和小叶腺泡形成。激素分泌不足,直接影响乳腺管的生长发育及乳腺末端的分枝,从而使乳腺发育受到影响。另一方面,除了经典的激素调节乳腺发育,还有生长因子、受体酪氨酸激酶、细胞外基质分子和蛋白酶也参与这个重要过程[2]。双调蛋白(amphiregulin, Areg)是乳腺导管的延伸最重要的旁分泌介导者[3]。Areg 敲除小鼠在青春期乳腺导管发育受阻。
iRhom2Uncv小鼠是我单位培育的一种BALB/c遗传背景的突变小鼠[4]。该小鼠纯合子表型之一为毛囊分化障碍。前期研究工作表明iRhom2Uncv纯合子的雌鼠乳腺侧枝导管发育障碍,丧失泌乳功能,但相关机制尚不明确。本研究拟对iRhom2Uncv小鼠乳腺组织的进行转录组测序,对影响乳腺发育障碍相关的基因进行鉴定和功能分析,为深入研究iRhom2Uncv小鼠表型特征以及延展该小鼠模型在其他领域的应用研究奠定基础。
1 材料与方法
1.1 实验动物
SPF级iRhom2Uncv和野生型小鼠为本中心生产繁育。实验动物生产许可证号:SCXK(军)2017-0014。
1.2 样品采集
各取5只12周龄的野生型(WT)和iRhom2Uncv纯合雌鼠,弯头镊夹取小鼠眼球,EP管收集血液,用于ELISA分析。其中3只采用断颈法处死后迅速解剖,取新鲜乳腺组织进行whole-mounts染色分析。另一部分新鲜乳腺组织放入RNase-free的离心管中,在液氮中速冻后置于-80 ℃保存,用于转录组分析。
1.3 Whole-mounts染色
将上述新鲜乳腺组织铺在玻片上,用体积比1∶3的冰醋酸/100%乙醇混合物固定、水化,0.2%洋红(Sigma)和0.5%的AlK(SO4)2过夜染色,在梯度乙醇中脱水,用体积比1∶2的苯甲醇/苯甲酸苄酯(Sigma)透明,利用Olympus IX51显微镜下观察和拍照。
1.4 转录组测序和生物信息学分析
转录组测序由诺禾致源公司进行,具体步骤包括:利用RNeasy mini kit(Qiagen)提取野生型和iRhom2Uncv小鼠乳腺组织总RNA,用Oligo Magnetic Beads分离mRNA,随后将其打断成250~300 bp的短片段,以片段化的RNA为模板,随机寡核苷酸为引物合成cDNA第一条链。采用NEBNext Ultra TM RNA Library Prep Kit(New England Biolabs)构建文库,质检合格后,在Illumina Hiseq X ten平台进行PE150测序。下机原始数据经过数据过滤、测序错误率检查及GC含量分布检查,获得有效测序数据(clean reads)。采用Tophat2将有效测序数据比对到小鼠参考基因组上,利用Stringtie拼接转录本,并对其进行表达水平定量。最后用Cuffdiff软件分析表达差异的显著性,P<0.05为显著差异。
1.5 ELISA分析
采用美国Bio Vision的Prolactin(mouse/rat)ELISA Kit(cat. No K4688)和Estrogen(mouse)ELISA Kit 10/16(cat. No K4265-100)测定小鼠血清中的催乳素和雌激素水平。
2 结果
2.1 乳腺发育形态
Whole-mounts染色分析结果显示,相比于野生型小鼠(图 1A),出生12周iRhom2Uncv雌鼠的乳腺导管分叉较稀疏(图 1B),导管侧枝发育明显存在障碍。
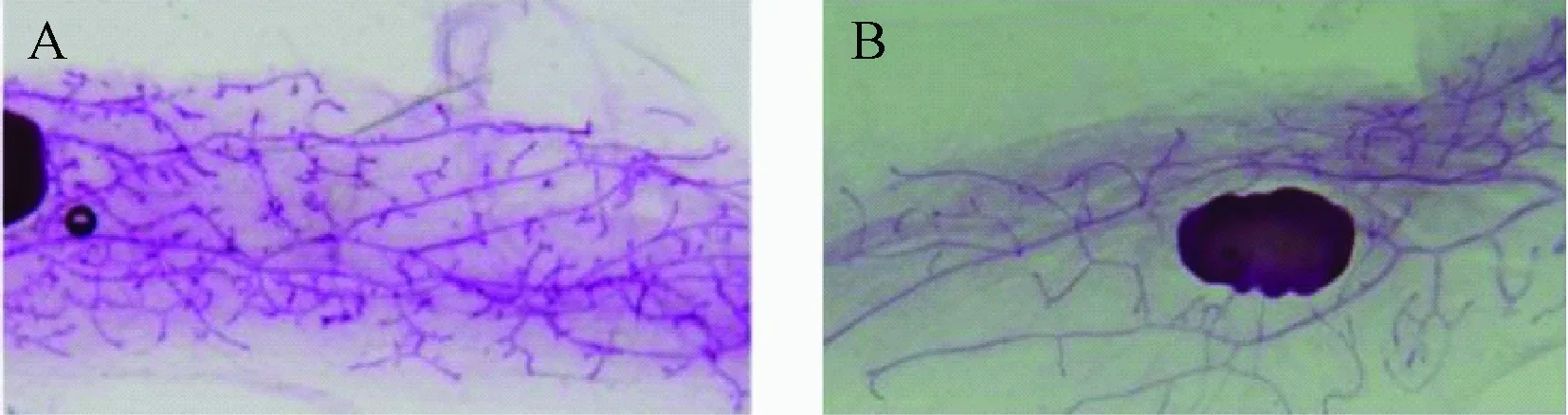
图1 小鼠乳腺形态注:A.野生型;B.iRhom2UncvFig.1 Mammary glands whole mounts of iRhom2Uncv and WTNote: A. wild type;B. iRhom2Uncv
2.2 差异基因的表达分析
计算FPKM的大小衡量基因表达水平的高低,用Cuffdiff软件分析差异表达情况,以表达差异倍数[log2(Fold Change)] >1,P<0.05作为筛选条件。iRhom2Uncv小鼠和野生型小鼠乳腺组织共得到725个差异表达的基因,476个基因表达下调,249个基因表达上调。以多重假设检验校正后的P值(padj)小于0.05 [即-log10(padj)>1.3]作为差异显著性标准,得到18个显著性表达差异的基因,其中6个在 iRhom2Uncv小鼠中表达显著上调(P<0.05),12个在iRhom2Uncv小鼠中表达显著下调(P<0.05)(图2)。Prl3b1、Prl2b1、Prl8a9基因属于催乳素家族,这3个基因在iRhom2Uncv小鼠中不表达,log2(Fold Change)分别为-12.02716、-11.47758 和-10.35361(表1)。Mfsd2a和Zfp281基因在iRhom2Uncv小鼠中表达量显著下调(P<0.05), 此外还有6个基因在iRhom2Uncv小鼠中也不表达。在表达上调的基因中,5个基因在野生型小鼠中不表达,而在iRhom2Uncv小鼠中表达量增加,且Mouse ENCODE transcriptome data显示Olfr365在睾丸中的FPKM为0.21,在其他组织中不表达。
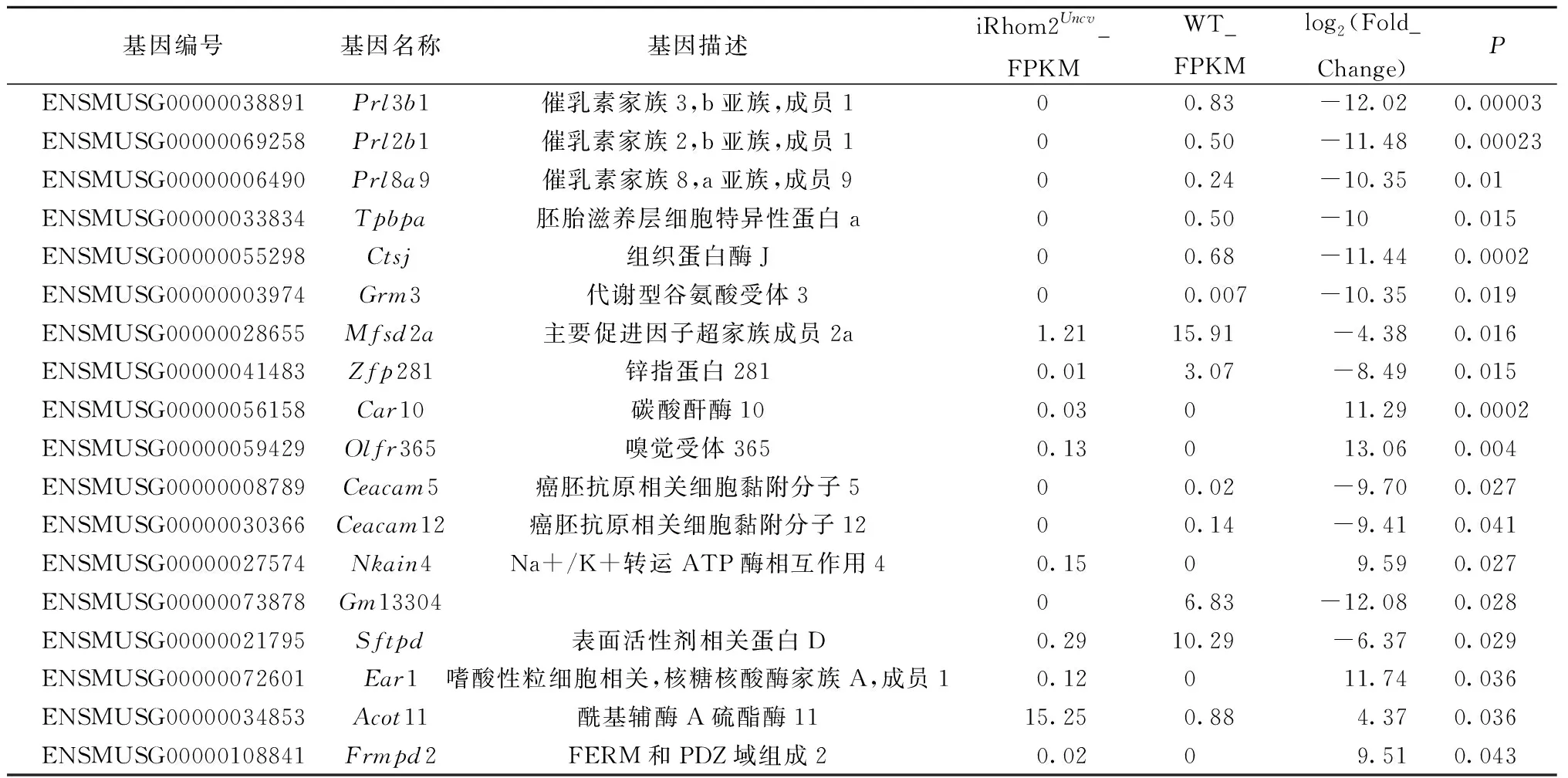
表1 差异基因列表Table 1 The list of different expression genes between iRhom2Uncv and WT
2.3 ELISA验证
血清中的催乳素和雌激素检测结果如图3所示,iRhom2Uncv小鼠几乎不产生催乳素,显著低于野生型小鼠(P=0.006),而雌激素水平高于野生型小鼠(P=0.037)。
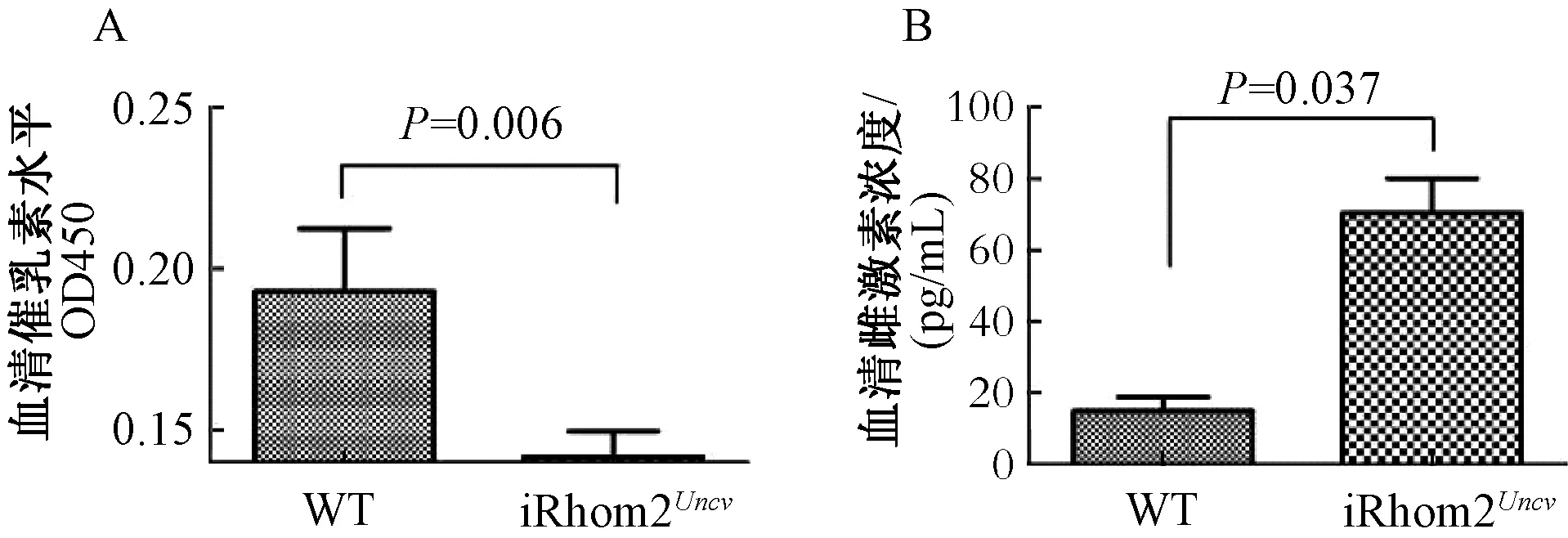
图3 野生型和iRhom2Uncv小鼠血清中的催乳素和雌激素水平Fig.3 Expression level of prolactin and estrogen in the serum of WT and iRhom2Uncvmice
3 讨论
Uncv小鼠是我单位培育出的一种BALB/c遗传背景的突变小鼠[5-6],该小鼠纯合子表型之一为毛囊分化障碍。通过基因定位、基因组扫描和克隆测序鉴定未知Uncv突变基因为iRhom2, 命名为iRhom2Uncv [6]。iRhom2Uncv突变为缺失非移码突变,缺失区域定位在iRhom2的N末端,长度为309 bp。缺失区域移码区域编码氨基酸在各物种间高度保守。过表达iRhom2转基因小鼠与iRhom2Uncv交配后挽救iRhom2Uncv的毛囊分化障碍表型,证实导致iRhom2Uncv小鼠表型是由于iRhom2 N末端缺失引起[6]。另外,iRhom2 N末端对内质网的TNFα 转化酶(TNFα-converting enzyme, TACE)成熟是必须的,iRhom2Uncv突变为功能丧失突变[6]。
进一步研究发现iRhom2Uncv雌鼠乳腺发育障碍,丧失泌乳功能,但其机制尚不明确。本研究通过转录组测序发现,在iRhom2Uncv小鼠中有3个催乳素家族的基因不表达,且血清中也几乎检测不到催乳素表达。催乳素可以通过内分泌和自分泌/旁分泌途径影响乳腺上皮细胞的发育,可直接作用于乳腺上皮细胞,或者通过信号转导与转录激活因子5b(Stat5b)的信号转导和转录激活间接作用于黄体,进而通过信号转导与转录激活因子5a(Stat5a)途径影响乳腺发育[7]。
iRhom2 与TACE相结合,促进 TACE 离开内质网到高尔基体上进行加工成熟[8-9]。双调蛋白是乳腺导管的延伸最重要的旁分泌介导者,TACE可在上皮细胞表面剪切Areg,激活基质细胞的表皮生长因子受体(EGFR)信号通路影响乳腺侧枝形态发生。前期的研究结果显示,野生型 iRhom2 能够促进 TACE 的成熟,然而过表达iRhom2Uncv却不能诱导TACE 的成熟。我们推测iRhom2Uncv小鼠乳腺发育障碍可能与不能诱导TACE 的成熟有关。
本研究通过比较iRhom2Uncv小鼠和野生型小鼠乳腺组织的转录组测序结果,共发现725个差异表达基因(P<0.05),包括476个下调基因和249个上调基因,为了更好地控制假阳性率,我们以padj<0.05作为差异显著的筛选条件,共筛选出18个差异显著的基因,包括6个上调基因和12个下调基因,同时对这些基因进行了文献调研和功能分析。在iRhom2Uncv小鼠中Zfp281基因显著下调,Zfp281基因编码的是锌指蛋白281。锌指蛋白没有固定的结构和作用,一般在转录及转录后调控,蛋白折叠与装配以及 DNA、RNA 识别等分子功能基础上,参与调节胚胎发育、机体免疫及肿瘤形成、发展等过程[10]。目前可见一些锌指蛋白与乳腺发育相关,如Zfp157、Zfp289和ZNF503。Zfp157是乳腺转录因子Stat 6的下游靶点,在外胚层中表达,青春期后,Zfp157主要在导管的基底上皮细胞和毛囊的皮脂腺中表达[10]。Zfp289可能是碱性螺旋环螺旋转录因子的显性负调控因子(Id-1)诱导乳腺上皮细胞增殖的重要介质[11]。ZNF503是GATA结合蛋白3(GATA3)表达和转录活性的转录抑制因子,可诱导乳腺上皮细胞增殖和乳腺癌的发生[12]。但目前未发现Zfp281与乳腺发育相关的研究,但在胚胎干细胞中,Zfp281可与胚胎干细胞核心转录因子Nanog启动区的位点结合直接激活Nanog的表达,并且Zfp281同时具有激活域和抑制域,对胚胎干细胞的增殖、更新和多能性的调控网络中起着双重作用[13]。我们推测iRhom2Uncv小鼠乳腺发育障碍可能与Zfp281下调有关。
此外,Zfp281可以调控X射线修复交叉互补分子2(XRCC2)和4(XRCC4)的转录激活,通过调控不同修复机制基因的表达参与DNA损伤修复[14]。骨髓细胞瘤癌基因(myelocytomatosis oncogene,c-Myc)诱导的上皮间质转化(epithelial-mesenchymal transition,EMT)依赖于Zfp281的表达,Zfp281的转录受SRY盒转录因子4(SRY-box transcription factor 4,SOX4)控制,SOX4在许多人类恶性肿瘤中表达,影响关键生长因子、发育途径和癌症进展。Zfp281的转录也受到miR34a通过p53依赖机制的抑制[14]。可见Zfp281在肿瘤中具有重要的生物学功能,iRhom2Uncv小鼠可能具有不同于野生型小鼠的肿瘤发生或发展表型。
Zfp281也是神经元分化的调控因子,在小鼠皮层神经元终末分化和维甲酸诱导的神经母细胞瘤(neuroblastoma,NB)细胞分化过程中,Zfp281的表达减少,而异位表达Zfp281,可以抑制小鼠皮层神经元和NB细胞的分化[15]。在iRhom2Uncv小鼠中Mfsd2a和Grm3显著下调,Mfsd2a(主要促进因子超家族成员2a)是跨膜蛋白和钠依赖性溶血磷脂酰胆碱转运体,是血脑屏障形成和维持完整性的关键组成部分[16-18]。Grm3是编码代谢型谷氨酸受体3的基因,谷氨酸是中枢神经系统中主要的兴奋性神经递质,可激活离子型和代谢型谷氨酸受体。谷氨酸能神经元是神经系统中最为重要的兴奋性神经元,谷氨酸能神经介质参与了正常大脑功能的大部分方面[19-21],在许多神经病理学条件下可能受到干扰。iRhom2Uncv小鼠中嗅觉受体365(Olfr365)和碳酸酐酶10(Car10)显著上调,嗅觉受体与鼻子中的气味分子相互作用,启动神经反应,从而触发嗅觉[22]。嗅觉受体通过7个跨膜结构与许多神经递质和激素受体结合,识别气味信号和G蛋白介导的转导。Car10可能在分泌途径中与神经突起形成复合物,促进神经突起的表面运输[23]。催乳素参与运动对慢性应激性记忆巩固障碍的保护调节[24]。这些差异表达的基因在神经系统中具有重要的作用,同时研究发现iRhom在果蝇中主要在神经组织表达。我们推测,iRhom2Uncv小鼠可能具有不同于野生型小鼠的神经发育表型,其是否能应用于肿瘤生物学或神经生物学动物模型的建立需要进一步研究。
