不同血清型腺相关病毒在大鼠DRG神经元转染效果的比较*
2020-04-09王晓亮
杨 帆 杨 艳 王晓亮 孙 薇 陈 军
(空军军医大学唐都医院疼痛生物医学研究所,西安 710038)
腺相关病毒(adeno-associated virus,AAV)是一类无包被,直径约为22 nm 的单链DNA 病毒。它是一种非致病病毒。由于,其自身的安全性和低免疫原性且可持续表达的特性已成为神经系统研究和基因治疗的重要工具之一[1-4]。目前,已发现100多种腺相关病毒,由于组成衣壳蛋白在空间构象及序列上的差异,导致其对不同的细胞或组织具有不同的转导效能[5]。已有研究发现[6],AAV8 基因型最显著的特点是转导肝脏组织,同时也可转导大脑神经元及背根神经节(DRG)。AAV4对肺的选择特异性高[7]。AAV1和AAV7在骨骼肌细胞转导快速且表达量很高,AAV1、AAV4和AAV5对中枢神经系统靶向性明显;AAV2对肾脏具有高的选择性;AAV8对心脏和胰腺转导效能优异[8]。在腺相关病毒载体对外周神经系统的研究中,Storek等[9]通过鞘内给药方式给予雄性SD大鼠携带抗伤害性疼痛基因的腺相关病毒(AAV1和AAV8)载体,发现AAV8在转染DRG神经元的效果最佳。Mason等[10]在雌性Wistar大鼠采用DRG直接注射的方式,比较了不同血清型腺相关病毒(AAV1、AAV2、AAV3、AAV4、AAV5、AAV6和AAV8)载体对初级感觉神经元的转染效果,发现AAV5的转染效果最佳。由此可见,由于不同实验动物品系以及给药方式的差异,腺相关病毒载体对DRG神经元的转导效能也存在着不同。因此,为了更加精确地了解腺相关病毒载体对雄性SD大鼠DRG神经元的转导效能,我们利用免疫荧光技术对4种不同血清型腺相关病毒(AAV5、AAV6、AAV8和AAV9)载体对DRG神经元的转导效能与表达进行了比较,发现AAV9对雄性SD大鼠DRG神经元的转导效能最佳。
1 材料与方法
1.1 实验材料
腺相关病毒(AAV5、AAV6、AAV8和AAV9)载体购自汉恒生物技术有限公司。24只雄性SD大鼠(180~200 g),购自空军军医大学实验动物中心,实验动物生产许可证号:SCXK(陕)2019-001。
1.2 实验方法
1.2.1分组:SD大鼠随机分为8组,每组3只,分别通过DRG直接注射的方式给予腺相关病毒(AAV5、AAV6、AAV8和AAV9)载体。饲养期间保持动物自由饮食和饮水,昼夜交替间隔12 h。
1.2.2DRG注射腺相关病毒载体:将实验动物用1%戊巴比妥钠(60 mg/kg)麻醉后,沿大鼠背部中线位置切开,用咬骨剪,剪去脊柱部分椎板,暴露左侧L3、L4、L5的 DRG,用微量注射器扎入DRG中心位置,等待3 min以便针尖部位组织恢复到封闭状态,然后注入AAV溶液10 μL,注射完毕等待1~2 min后再拔出微量注射器,防止腺相关病毒载体渗出,依次注射暴露的DRG,之后逐层缝合大鼠伤口。
1.2.3组织切片的荧光分析:将注射3周和4周后的大鼠用1%戊巴比妥钠(60 mg/kg)腹腔麻醉,预冷生理盐水和4%多聚甲醛依次行主动脉灌注,灌流结束后取出左侧L3、L4和L5的DRG,置于4%多聚甲醛中固定,随后经15%和30%蔗糖溶液梯度脱水直至组织完全沉糖,液氮速冻。用OCT包埋后冰冻切片机切片(12 μm),并逐一贴片于挂胶载玻片上,将玻片置于避光环境自然风干后,0.01%的PBS漂洗3次,10 min/次,再次避光自然风干使用抗荧光淬灭剂封片。在Olympus-FV1000共聚焦显微镜下进行拍片,选用Image J 图像分析系统计算荧光强度。每组3只大鼠,每只大鼠的L3、L4和L5 DRG分别取5~8张连续切片。
2 结果
2.1 4种不同血清型AAV病毒在大鼠DRG神经元转染结果比较
组织切片荧光结果显示:注射后3周,AAV5对DRG神经元几乎无转染,AAV6和AAV8对DRG神经元均略有转染, AAV9的转染效果最好(图1、表1)。注射后4周,AAV5、AAV6及AAV8对DRG神经元的转染效果相似,AAV9对DRG神经元的转染效果最佳,神经元和纤维束均清晰可见(图2、表1)。
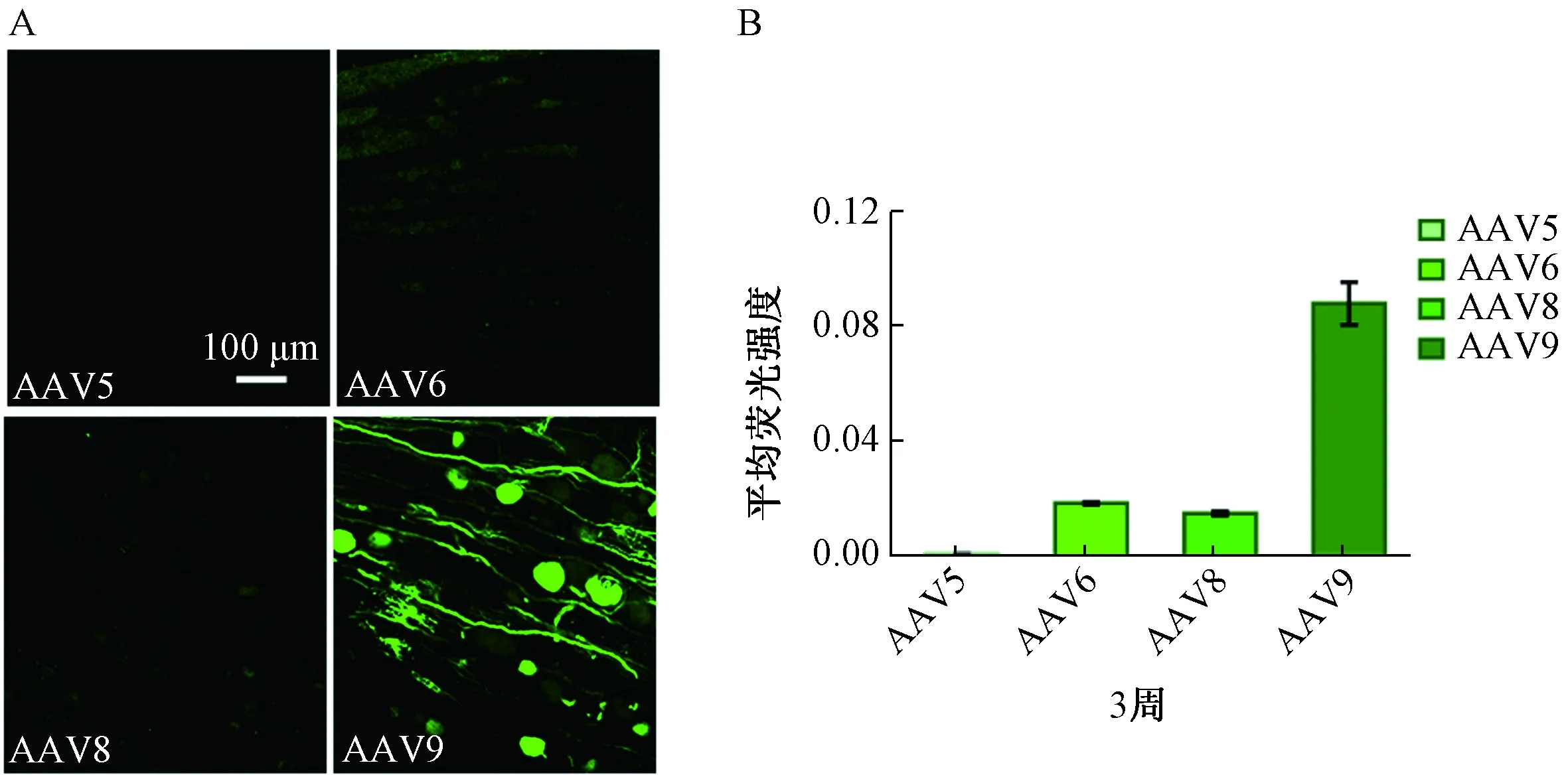
图1 DRG直接注射不同血清型的AAV病毒(AAV5、AAV6、AAV8和AAV9)3周后神经元绿色荧光蛋白的表达及定量注:A.DRG切片免疫荧光示例图表明AAV9对神经元的转染效率最高;B.平均兔疫荧光强度定量表明AAV9对神经元的转染强度最高Fig.1 GFP expression and quantification in sections of DRG 3 weeks after injected with vectors based on AAV serotypes 5,6,8 and 9Note:A.Representative immunofluorescence sections show that AAV9 has the highest transduction rate.B.Quantification of the mean immunofluorescent intensity shows that AAV9 has the highest transduction intensity
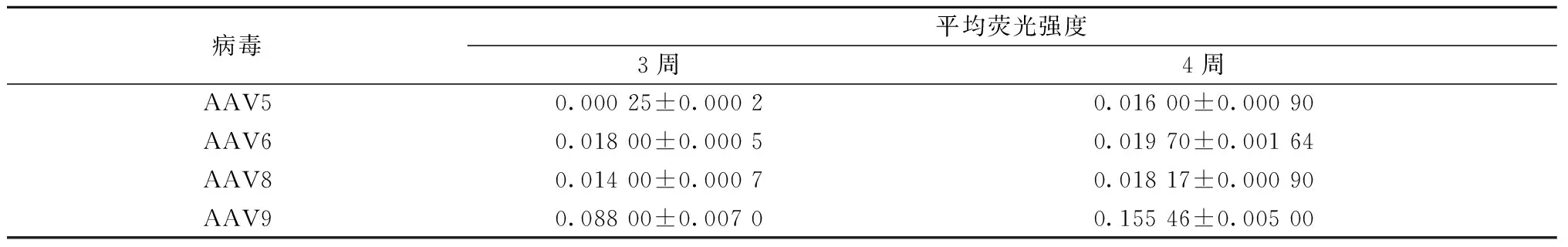
表1 不同血清型AAV病毒在大鼠DRG神经元转染效果Table 1 The transfection effect of different AAV serotypes in rat DRG neurons
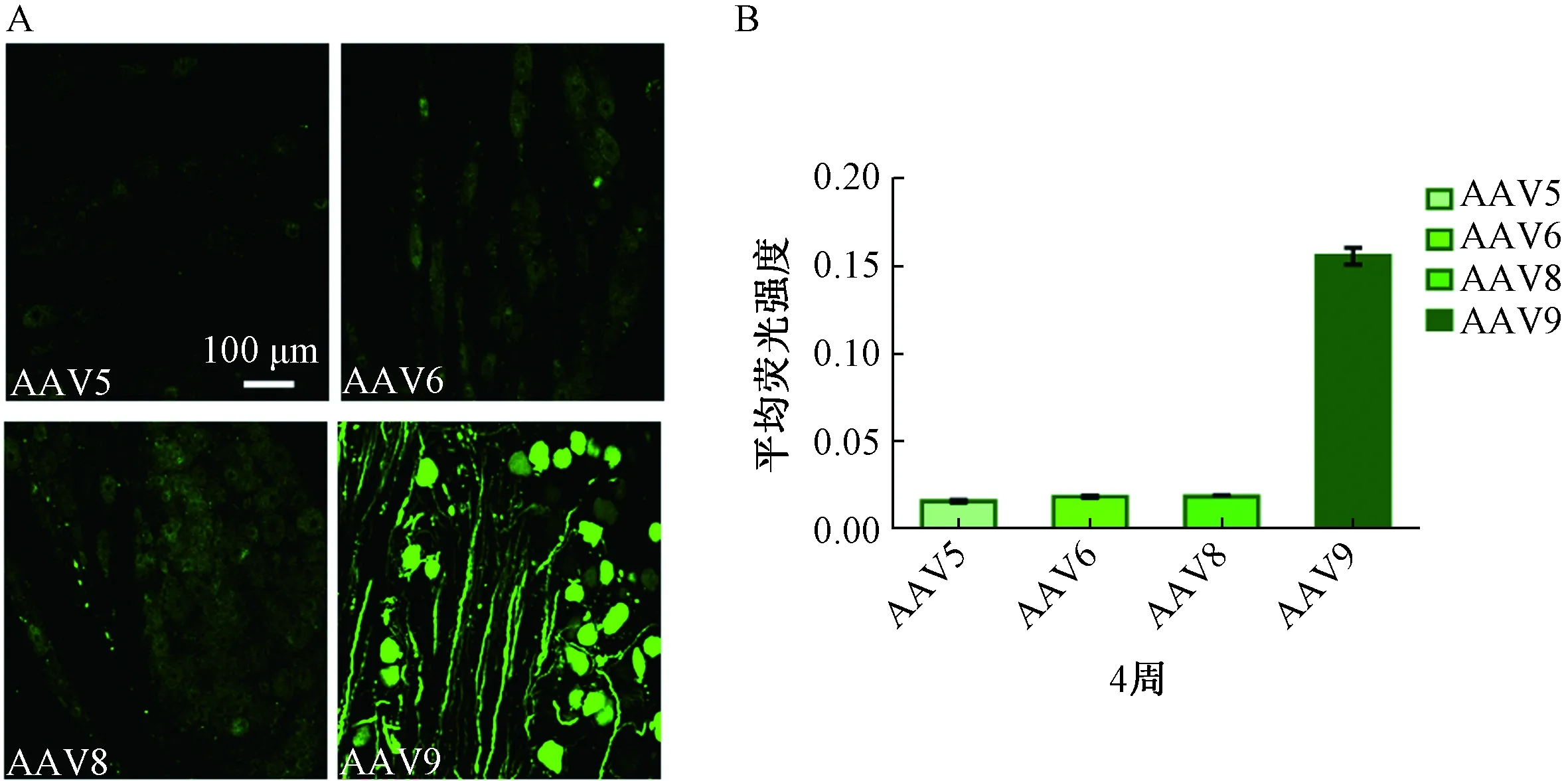
图2 DRG直接注射不同血清型的AAV病毒以(AAV5、AAV6、AAV8和AAV9)4周后神经元绿色荧光蛋白的表达及定量注:A.DRG切片免疫荧光示例图表明AAV9对神经元的转染效率最高;B.平均兔疫荧光强度定量表明AAV9对神经元的转染强度最高Fig.2 GFP expression and quantification in sections of DRG 4 weeks after injected with vectors based on AAV serotypes 5,6,8 and 9Note:A.Representative immunofluorescence sections show that AAV9 has the highest transduction rate.B.Quantification of the mean immunofluorescent intensity shows that AAV9 has the highest transduction intensity
2.2 同种血清型AAV病毒不同时间在大鼠DRG神经元转染结果比较
为了对比AAV病毒转染的时程与效果间的关系,本研究对同种血清型AAV病毒分别转染3 周和4 周的平均荧光强度进行分析比较。如图3所示:病毒注射第4周相较于注射第3周,AAV5的转染效果(平均荧光强度)明显增高,AAV6的转染效果未见明显变化,AAV8的转染效果明显增强,AAV9对DRG神经元的转染效率显著提高。

图3 DRG直接注射不同血清型的AAV病毒(AAV5、AAV6、AAV8和AAV9)3周和4周后神经元绿色荧光强度对比Fig.3 The comparison of the mean immunofluorescent intensity between 3 and 4 weeks in sections of DRG after inected with vectors based on AAV serotypes 5,6,8 and 9
综上所述,对雄性SD大鼠DRG直接注射不同血清型腺相关病毒(AAV5、AAV6、AAV8和AAV9)载体3 周和4 周后,AAV9对大鼠DRG神经元的转染效能最佳。
3 讨论
腺相关病毒载体具有较高的安全性、低免疫原性、可持续表达等特性,已成为神经系统研究以及基因治疗的重要工具之一。但由于衣壳蛋白在空间构象及蛋白序列存在差异,因此不同血清型腺相关病毒载体在不同生物种系的组织和细胞的转导效能上存在差异。Storek等[9]通过鞘内给药方式,给予雄性SD大鼠携带抗伤害性疼痛基因的腺相关病毒(AAV1和AAV8)载体,发现AAV8对DRG神经元的转导效能最佳;而Mason[10]实验室在雌性Wistar大鼠上用DRG直接注射的方式,比较了不同血清型的腺相关病毒(AAV1、AAV2、AAV3、AAV4、AAV5、AAV6和AAV8)载体对DRG初级感觉神经元的转导效能,发现AAV5的转导效能最佳。在本研究中,我们通过给雄性SD大鼠的DRG直接注射不同血清型腺相关病毒(AAV5、AAV6、AAV8和AAV9)载体,发现AAV9对DRG初级感觉神经元的转染效能最佳。
综上所述,我们发现AAV9对雄性SD大鼠DRG神经元的转导效能最佳,为后续外周神经系统的研究以及临床基因治疗提供了有力证据。
