HbA1c不适于小型猪血糖控制状态的监控*
2020-04-09贾云晓赵玉琼牛苗苗袁记方
贾云晓 赵玉琼 牛苗苗 袁记方 相 磊 戴 鑫 陈 华
(解放军总医院医学创新研究部实验动物中心,北京 100853)
糖化血红蛋白最早由Rahbar等[1]所发现,并称之为“糖尿病患者中的罕见血红蛋白”。在上世纪八十年代,HbA1c(糖化血红蛋白的主要成分)被广泛引入临床应用。HbA1c能反应之前2~3个月内的平均血浆葡萄糖水平,并且不受短期血糖波动的影响,成为糖尿病患者血糖控制水平监控的重要指标。其重要性得到两个长期临床试验(The Diabetes Control and Complications Trial, DCCT 和 UK Prospective Diabetes Study, UKPDS)的验证[2-3],并被美国的糖尿病控制指南所接受[4]。在2011年,WHO推荐HbA1c高于6.5%可作为诊断糖尿病的节点[5]。因此,HbA1c也是糖尿病动物实验研究经常应用的检测指标。
近年来,小型猪成为热门的的生物医学研究模型,这是由于它们与人类在解剖、代谢、生理和病理生理学方面十分相似,而且繁殖率高、伦理上可接受。小型猪应用于代谢性疾病和糖尿病的研究也受到广泛重视[6-7]。我们在巴马小型猪糖尿病模型研究中,对小型猪的血液HbA1c指标进行了测定,以期为糖尿病模型研究中对这一指标的应用提供参考。
1 材料与方法
1.1 实验动物与处理
5~6月龄雄性巴马小型猪14头,体质量12.6~15.2 kg。购自北京实创世纪巴马小型猪养殖基地,实验动物生产许可证号:SCXK(京)2018-0011。实验在军事科学院军事医学研究院动物中心完成,实验动物许可证号: SYXK(军)2017-0022。实验期间,动物饲养环境温度:20~26 ℃,相对湿度:40%~70%,明暗交替12 h/12 h,动物单笼饲养,自由饮水。将小型猪随机分为3组,分别为对照组(Control)、高脂饲喂+链脲佐菌素(HFD+STZ)组和高胆固醇高脂饲喂+链脲佐菌素(HCFD+STZ)组(表1)。对照组动物常规饲料饲喂,HFD+STZ组和HCFD+STZ组动物在分别饲喂高脂饲料或高胆固醇高脂饲料(饲料成分见表2)。饲料按照体质量的3%投喂,并根据每月的体质量变化进行调整。

表1 实验动物分组与处理Table 1 Grouping and treatment of experimental animals
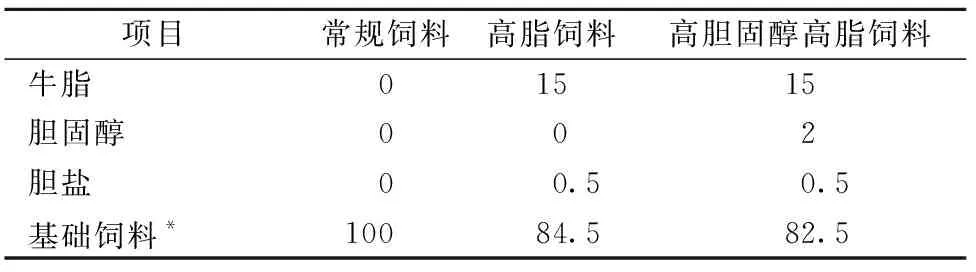
表2 实验应用饲料的主要成分比例Table 2 Proportion of main components of fodder In the experiment %
1.2 检测指标
1.2.1体质量:1次/月(上午8:30~10:30、空腹测体质量)。
1.2.2空腹血糖(GLU)、空腹血清胰岛素(INS)、肝和肾功能指标(ALT、AST、CRE、BUN):1次/月。检测委托北方生物技术研究所有限公司完成。胰岛素检测采用放射免疫法(西安核仪厂xh6080放免仪)。
1.2.3HbA1c:1次/月。检测委托北方生物技术研究所有限公司完成。血液置含有EDTA-K2抗凝剂的采血管中送检。以BIO-RAD 血红蛋白检测系统(D-10 Hemoglobin Testing System),应用离子交换高压液相法(HPLC)检测全血中的HbA1c。所用试剂为REF 220-0101,糖化血红蛋白A1c检测试剂盒。
2 结果
2.1 一般临床观察
实验期间对照组动物状态良好,饮食正常。实验组动物在实验的前3个月被毛比对照组更顺滑,并逐渐变得肥胖。在应用STZ后状态明显变差,表现为精神萎靡、食欲不振,3 d后动物的状态逐渐恢复正常,但是动物在此后的观察期内开始逐渐消瘦。其中,HCFD+STZ组有1只动物在应用STZ后5个月出现酸中毒迹象,给予胰岛素治疗直至实验结束。胰岛素应用剂量:0.44 U/kg,皮下注射(SC),1次/d(地特胰岛素注射液,丹麦诺和诺德公司,国药准字J20140107)。
HFD+STZ组和HCFD+STZ组在应用STZ后,各有1只动物未出现高血糖。由于此后的观察我们更关注高血糖的影响,因此,这2只未出现高血糖症状的动物在应用STZ后的数据不纳入统计分析。
2.2 体质量
对照组动物饲喂常规饲料,实验期间体质量逐渐增长。饲喂高脂/高胆固醇高脂饲料的动物,在实验的前3个月体质量增长快于对照组(P<0.01),注射STZ后体质量开始下降,在实验第4个月开始与对照组无明显差异,并持续至实验结束(图1)。
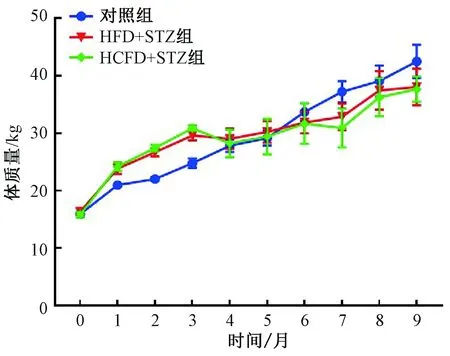
图1 实验期间动物体质量变化Fig.1 Changes of animal weight during the experiment
2.3 空腹血糖、空腹血清胰岛素和HOMA-IR指数
2.3.1空腹血糖(图2A):实验期间对照组动物空腹血糖值为3.2~4.2 mmol/L。实验组(HFD+STZ 组和HCFD+STZ组)动物中,每组各有1只动物的空腹血糖值在实验期间变化不大,分别为2.9~4.9 mmol/L 和3.4~7.8 mmol/L,其余动物在注射STZ后空腹血糖值较注射STZ前显著升高,与对照组相比差异极显著(P<0.01),并持续至实验结束,空腹血糖测定值分别在15.4~31.1 mmol/L 和10.3~29.4 mmol/L之间波动。
2.3.2空腹血清胰岛素(图2B):实验期间对照组动物空腹血清胰岛素值在8.36~17.64 μIU/mL范围内波动,检测值变异幅度较大。实验组(HFD+STZ 组和HCFD+STZ组)动物的空腹胰岛素值在前3个月与对照组差异不明显,在应用STZ后开始减低,并持续至实验结束(4个月,HCFD+STZ组较对照组差异显著,P<0.05;8个月、9个月,HFD+STZ 组和HCFD+STZ组较对照组均差异显著,P<0.05)。
2.3.3HOMA-IR(图2C):实验期间对照组动物的HOMA-IR值为1.56~2.67,变异幅度较大。实验组(HFD+STZ组和HCFD+STZ组)动物的HOMA-IR值在前3个月与对照组差异不明显,在注射STZ后明显升高,较对照组有显著差异(P<0.05 或P<0.01),并持续至实验结束。
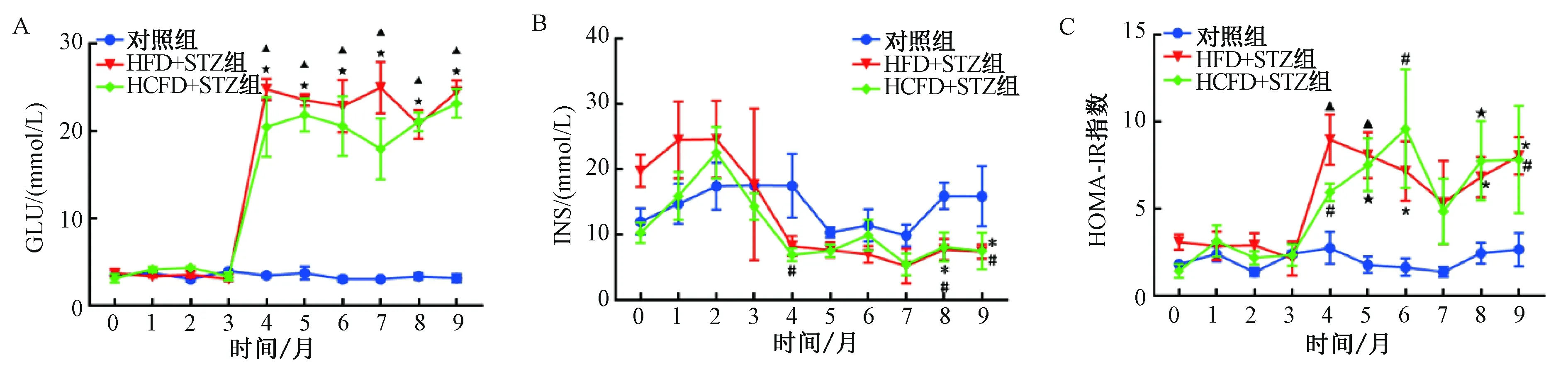
图2 实验期间动物空腹血糖、空腹胰岛素和HOMA-IR指数变化情况注:与对照组相比,▲P<0.01,*P<0.05;与对照组相比,★P<0.01, #P<0.05Fig.2 Changes of GLU,INS and HOMA-IR during the experimentNote: Compared with control group,▲P<0.01, *P<0.05;Compared with control group,★P<0.01, #P<0.05
2.4 HbA1c
对照组动物在实验期间HbA1c的测定值在2.9%~5.5%之间,各检测时间点平均值无明显差异。HFD+STZ组和HCFD+STZ组动物的测定值分别在1.7%~4.4%和2.5%~5.8%之间波动,各检测时间点平均值3组之间无明显差异(图3)。
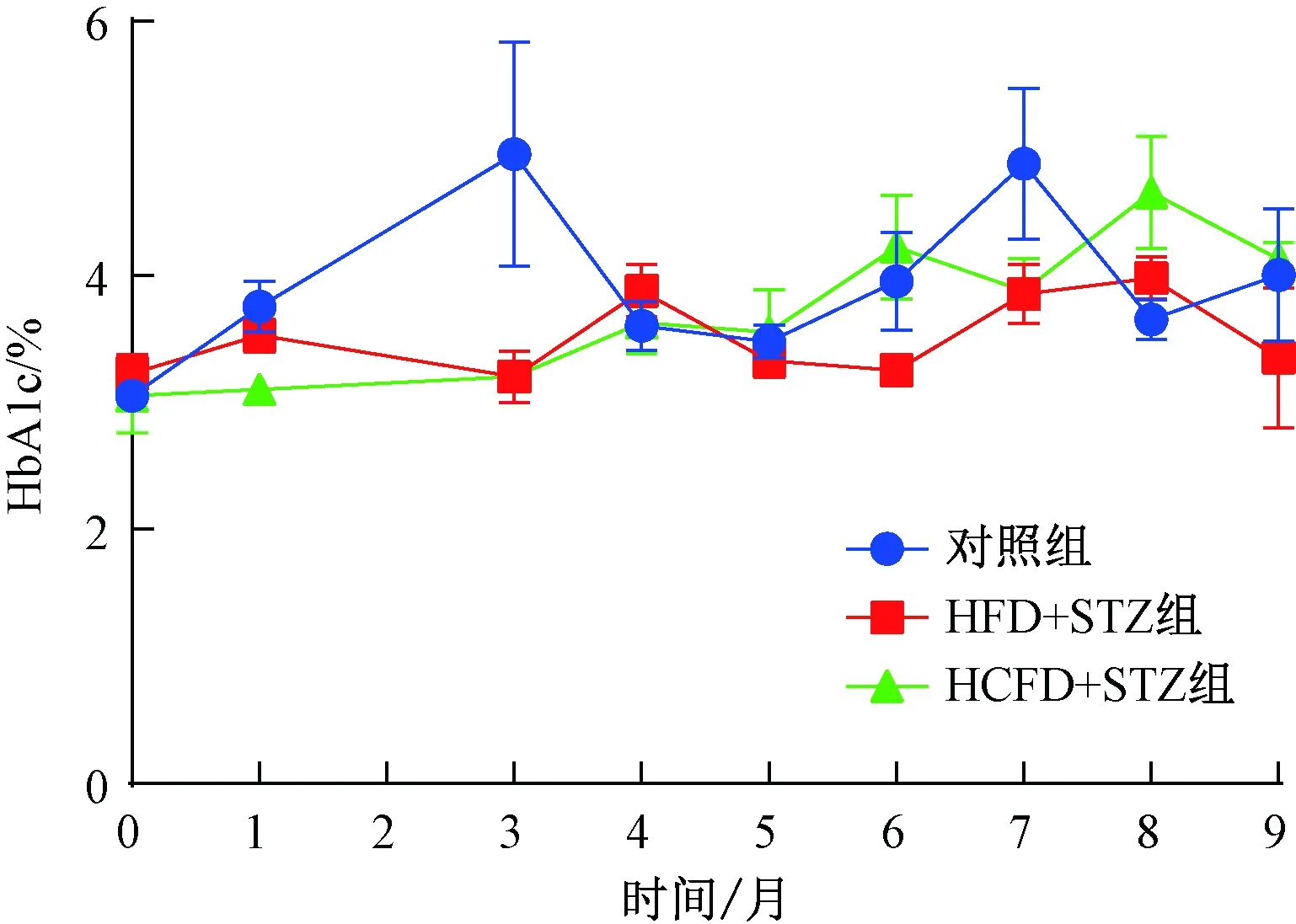
图3 实验期间动物HbA1c测定值Fig.3 Values of HbA1c during the experiment
2.5 肝功能和肾功能指标
对照组ALT的所有测定值在25.0~73.0 mmol/L之间波动,AST的所有测定值在14.0~67.0 mmol/L之间波动,CRE的所有测定值在46.0~164.0 mmol/L之间波动,BUN的所有测定值在1.3~5.8 mmol/L之间波动。两个实验组各时间点ALT、AST、CRE和BUN的测定值均与对照组差异不显著。
3 讨论
本实验应用高脂/高胆固醇高脂饲料饲喂诱导巴马小型猪3个月后,再注射90 mg/kg的STZ,继续诱导6个月,通过空腹血糖、空腹血清胰岛素、HOMA-IR等各项指标判定,我们成功地建立了小型猪糖尿病模型。HFD+STZ 组和HCFD+STZ组的8头小型猪在注射STZ后血糖浓度显著升高,空腹血糖测定值分别达到了15.4~31.1 mmol/L 和10.3~29.4 mmol/L,并持续至实验结束。然而,实验组动物的HbA1c测定值却没有发生明显变化,即使动物的高血糖持续了6个月,实验组动物的HbA1c测定值也没有明显升高,各检测时间点均表现与对照组差异不显著,说明HbA1c值并未准确反映出实验期间实验动物体内的血糖变化情况。
糖化血红蛋白是血红蛋白和糖类之间简单的化学反应的结果,是在血红蛋白合成完成后的翻译后修饰。糖化血红蛋白的形成包括两步非酶促的化学反应。第一步,葡萄糖与β球蛋白链N末端的缬氨酸残基结合形成一个醛亚胺化合物,这是一步可逆的反应。第二步,由Amadori反应介导的醛亚胺化合物的内部重排,产生一个稳定的氨基酮衍化物。糖化血红蛋白依据携带电荷的不同,可以应用离子交换树脂进行分离,按照洗脱顺序命名,分别为A0、A1a、A1b和A1c,A1c是糖化血红蛋白的主要组分[8]。
稳定的HbA1c一旦形成就一直存在于红细胞中,直到它们从循环中移出。新生红细胞增加(血红蛋白尚未修饰),会导致总的HbA1c浓度的明显减少。相反,一个相对短期的血糖升高,可迅速和不可逆地增加所有循环中红细胞的HbA1c浓度。亦即,HbA1c的浓度对新发高血糖敏感,而对以前的高血糖结果的修复不敏感。Graf等[9]最先指出,环境(血液)的葡萄糖浓度与HbA1c相关,通过红细胞的寿命和血红蛋白的糖化反应速度可预测HbA1c浓度。Beach[10]的研究表明,在实验条件下,能够实现这种预测。此后,HbA1c的检测逐步引入临床应用,成为一段时间内血糖控制程度的监测指标。
在动物实验研究中,已经有小鼠、大鼠、家兔、犬、猴和狒狒糖化血红蛋白的检测报道[11-16],尽管结果变异很大,但是和人类一样,也表现出在糖尿病动物体内出现升高。糖化血红蛋白水平在不同动物种类之间变异很大,因为其差别不仅与红细胞寿命有关,而且与红细胞对葡萄糖的通透性相关。Higgins等[17]利用血液样本,比较了人类、狒狒、恒河猴、犬、兔和猪的体内糖化血红蛋白情况。结果测得血浆血糖与红细胞内血糖的比例平均值分别为:67.1%、77%、70.8%、34.2%、19.2%和3.8%。这表明狒狒和恒河猴的红细胞的葡萄糖通过性与人类差异不显著,犬、兔和猪的红细胞的葡萄糖通过性明显低于人类。他们利用Bia-Rex 70色谱,以琼脂糖凝胶电泳分离HbA1c,结果测得6种动物血液的HbA1c平均值分别为4.9%、3.5%、3.3%、3.3%、1.4%和0。这也是我们检索到的唯一有关猪糖化血红蛋白检测的文献。我们的实验结果与之不同,即在巴马小型猪血液中检出HbA1c,所有动物的检测值在1.7%~5.8%范围内波动,但平均值明显低于人类的正常值,随着血糖的升高,变化不明显。
在糖化血红蛋白发现后的大约20年,色谱分析是糖化血红蛋白的唯一可用的检测方法。现在,检测方法已经发展了近40种,按照理化性质原理可以分为两大类,一类是依据电荷差异,即血红蛋白的糖化与非糖化2种形式所携带的电荷不同,如离子交换层析法、电泳法等;另一类是依据结构差异,即血红蛋白糖化与非糖化2种形式结构不同,如免疫法、亲和层析法等。Higgins等的研究发表于1982年[17],他们采用了离子交换层析法,利用的Bio-Rex 70离子交换树脂(Bio-Rad, Inc)。此方法检测结果易受HbA1c前体(Schiff碱)、胎儿血红蛋白(HbF)、衍生血红蛋白(甲酰化或乙酰化血红蛋白)及变异血红蛋白(HbS、HbS、HbS和HbS)等因素的干扰,对pH和温度敏感。1992年,美国病理学家学会发布了1份调查报告,指出HbA1c检测结果存在较大偏差,对于一些血液样本,HbA1c检测结果的报告变异范围达到4%~8.1%[18]。这一报告表明,为了改善糖尿病人的管理,需要引入标准化的HbA1c检测。我们的研究选用了高效液相色谱法(HPLC),克服了pH值、温度及其他一些影响因素,减少了对HbA1c峰的干扰,对HbA1c的分离可以达到临床需求的精密度和稳定性。因此,HPLC已经作为HbA1c标准化参考系统的参考方法[19]。综上所述,我们推测小型猪的红细胞对葡萄糖的通透性较低,其血液HbA1c检测无法准确反映血糖的变化情况,不适于小型猪糖尿病研究中对血糖控制水平的监测。
