南蛇藤醇介导的PTEN过表达增强顺铂对食管癌细胞的化学敏感性并抑制裸鼠成瘤能力*
2020-04-09高元喜王玉霞严佳丽刘新宇
高元喜 张 炜 王玉霞 严佳丽 刘新宇
(1. 宜昌市中医医院肿瘤科,宜昌 443000)(2. 武汉科技大学附属医学肿瘤科,武汉 430064)
食管癌发生于人消化道,是一种在世界范围内常见、恶性程度高、极具侵袭性、极难治疗的恶性肿瘤之一[1]。近年来在我国的发病率逐渐上升,2017年全国范围内其发病率及死亡率在所有癌症中位居前五[2]。由于食管癌患者早期症状不明显,不易被发现,因此大部分患者被确诊时已是中晚期。而且癌细胞易发生早期远处转移,且极易复发,即使通过手术切除原发肿瘤以及常规化疗方法治疗,预后效果仍然不佳,严重降低了患者生存质量[3-4]。因此筛选出高效且毒副作用小的抗食管癌药物意义重大。目前,食管癌的化疗通常以顺铂等铂类药物为基础药物,辅以5-氟尿嘧啶(5-FU)[5]、多西他赛[6]、紫杉醇[7]等。但由于癌细胞会对这些药物产生耐药性,使其治疗率和缓解率大幅下降。南蛇藤醇是从南蛇藤(CelastrusorbiculatusThunb.)中提取出来的一种甲醇提取物质,具有多种生物学特性,包括抗肿瘤,抗炎,镇痛,抗生育,抗菌和抗病毒特性[8]。有相关报道称,南蛇藤的某些成分可有效的抗肿瘤转移[9]、增殖[10]、侵袭[11]、抑制EMT[12]、诱导癌细胞发生凋亡[13]等。目前仍缺少关于南蛇藤醇对食管癌作用的研究报道,因此本研究通过南蛇藤醇联合顺铂处理食管癌细胞EC109,探索南蛇藤醇介导的PTEN过表达对食管癌肿瘤生长、癌细胞存活、侵袭、EMT以及凋亡的影响。
1 材料与方法
1.1 实验动物
选用36只4周龄SPF级BALB/c雌性裸鼠,体质量18~22 g,购自北京维通利华实验动物有限公司,实验动物生产许可证号:SCXK(京)2019-0009。
1.2 主要仪器
Olympus BX53 M显微镜 (日本Olympus公司),高速低温离心机 (美国Beckman公司),OLYMPLUSIX73荧光显微镜 (日本 Olympus公司),AMA440 N高压灭菌锅 (英国Astell公司),电泳槽、电转仪 (美国Bio-Rad公司),凝胶成像系统GDS-800 UVP (美国UVP公司)。
1.3 药品与试剂
食管癌EC109细胞、人食管上皮细胞系HET-1 A(中国科学院上海细胞库),RPMI-1640培养基(HyClone),南蛇藤醇(广州军区药品仪器检验所),顺铂(Sigma),PTEN、Ki67、PCNA、E-cadherin、N-cadherin、Vimentin、cleaved PARP、cleaved caspase 3抗体(美国NEB 公司),HRP标记的山羊抗小鼠二抗 (美国Santa Cruz 公司);蛋白Marker、Fermentas、EDTA 缓冲液(pH 8.0)(美国Sigma 公司),PVDF膜(美国BD公司),Hoechst染色试剂盒、RIPA强裂解液(上海碧云天生物技术有限公司)。
1.4 实验方法
1.4.1细胞培养:EC109、DDP细胞在补充有10%胎牛血清的DMEM培养基中生长。所有细胞均在含有5%CO2的培养箱中37 ℃培养。细胞汇合率达到85%以上时用0.25%胰酶进行消化传代。
1.4.2动物模型建立与药物干预:将食管癌细胞EC109/DDP(5×109/L)于裸鼠一侧腹股沟部皮下注射到小鼠体内。腹腔注射PBS或南蛇藤醇或顺铂(5 mg/kg)至荷瘤小鼠体内。将其分为四组:EC109/DDP+PBS,EC109/DDP+顺铂, EC109/DDP+顺铂+南蛇藤醇组(1 mg/kg),EC109/DDP+顺铂+南蛇藤醇组(5 mg/kg)。每组9只。每隔5 d测量肿瘤体积,30 d后处死裸鼠,剥离移植瘤,测量其质量并计算肿瘤生长抑制率。肿瘤生长抑制率(%)=(EC109/DDP+PBS组平均瘤质量-药物组平均瘤质量)/(EC109/DDP+PBS组平均瘤质量)×100%。
1.4.3免疫组化:采用链霉亲和素-生物素-复合过氧化物酶试剂盒对肿瘤组织中Ki67、caspase-3、VEGE进行免疫组织化学染色。Image-Pro Plus 图像分析系统上对异种移植物的免疫染色进行分析。
1.4.4CCK8分析检测细胞存活率:将对数生长期的EC109、HET-1 A细胞传代培养于96孔板中,培养24 h后用不同剂量的南蛇藤醇(0.5、1、2.5、5、10、20、50、80和100 μmol/L)处理人食管上皮细胞系(HET-1 A)24 h,根据试剂盒说明书每孔加入10 μL CCK8试剂并于培养箱中继续孵育2 h,用酶标仪检测各组吸光度,绘制折线图并计算细胞生长速度 (增殖倍数=细胞吸光度/0 h 细胞吸光度)。选取对正常细胞影响不大的南蛇藤醇浓度 (1、2.5和5 μmol/L) 用作后续实验。顺铂(4 μg/mL)预处理EC109/DDP细胞后分别用不同剂量的南蛇藤醇处理EC109/DDP细胞,对照组用PBS代替顺铂,将其分为五组:对照组,顺铂(4 μg/mL)组,顺铂+南蛇藤醇(1 μmol/L)组,顺铂+南蛇藤醇(2.5 μmol/L)组,顺铂+南蛇藤醇(5 μmol/L)组,CCK8试剂盒检测细胞存活率。
1.4.5免疫印迹法:使用裂解缓冲液裂解细胞样品。然后,使用BCA蛋白质测定试剂盒定量蛋白质浓度。含有20 mg蛋白质的样品在10%SDS-PAGE中分离,然后转移到聚偏二氟乙烯膜上。用5% 脱脂牛奶室温封闭蛋白2 h,随后加入一抗于4 ℃封闭过夜,第二天加入对应二抗室温封闭1 h,最后滴加ECL,设置曝光参数,检测目的条带对应化学发光强弱。
1.4.6Transwell:顺铂(4 μg/mL)预处理EC109/DDP细胞后,分别用不同剂量的南蛇藤醇处理EC109/DDP细胞,对照组用PBS代替顺铂。将处理过的细胞消化离心,无血清培养基重悬细胞,以 1×104孔的细胞数量种入上室,下室加入有血清的培养基。48 h后用无菌棉签擦去小室上层细胞,将 transwell 小室倒置风干,并放入含有 500 μL 染色液(0.1%结晶紫)的12孔板中,染色 20 min,取出后在 PBS 中清洗3次,并风干。在transwell小室直径上取5个视野,在显微镜下拍照计数。
1.4.7Hoechst染色检测调亡:按1.4.6使用药物处理细胞,将处理后的细胞用预冷的PBS洗涤2次,每次5 min。细胞在4 ℃下于 4%多聚甲醛中固定1 h。然后每孔加入1 mL Hoechst 33258荧光染料,然后弃去染色液,在暗处用PBS洗涤2次,每次5 min。用荧光显微镜观察细胞并拍照。细胞的核浓缩和分裂被用作细胞凋亡的指标。
1.5 统计方法
2 结果
2.1 南蛇藤醇增强顺铂对体内肿瘤形成的抑制作用
如图1A所示,与EC109/DDP+PBS组比较,EC109/DDP+顺铂+南蛇藤醇(1 mg/kg)和EC109/DDP+顺铂+南蛇藤醇(5 mg/kg)组肿瘤质量均显著降低(P<0.05)。顺铂(5 mg/kg)组的肿瘤生长抑制率为3.84%,EC109/DDP+顺铂+南蛇藤醇(1 mg/kg)的肿瘤生长抑制率为25.64%,EC109/DDP+顺铂+南蛇藤醇(5 mg/kg)组的肿瘤生长抑制率为53.84%;如图1B所示,与EC109/DDP+PBS组比较,在南蛇藤醇处理后25~30 d,EC109/DDP+顺铂+南蛇藤醇(1 mg/kg)和EC109/DDP+顺铂+南蛇藤醇(5 mg/kg)组肿瘤体积显著减小(P<0.05)。如图1C所示,与EC109/DDP+PBS组比较,EC109/DDP+顺铂+南蛇藤醇(1 mg/kg)和EC109/DDP+顺铂+南蛇藤醇(5 mg/kg)组PTEN蛋白表达水平显著升高(P<0.05)。如图1D所示,与EC109/DDP+PBS组比较,EC109/DDP+顺铂+南蛇藤醇(1 mg/kg)和EC109/DDP+顺铂+南蛇藤醇(5 mg/kg)组Ki67,VEGF和Caspase 3阳性细胞数均显著减少(P<0.05)。
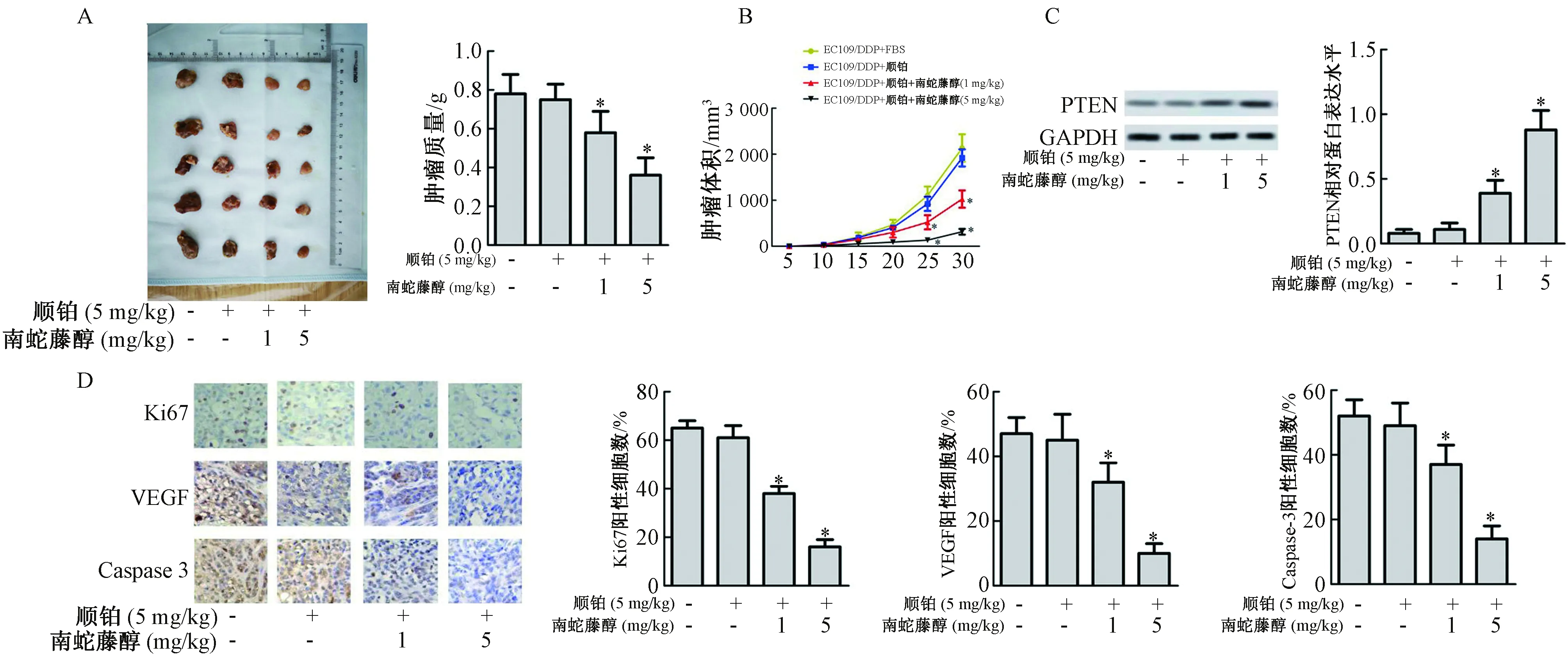
图1 南蛇藤醇对体内肿瘤形成的作用注: 与EC109/DDP+PBS组比较,*P<0.05,**P<0.01Fig.1 Effect of methanol extract of Cel.orbiculatus on tumor formation in vivoNote: Compared with the EC109/DDP+PBS group,*P<0.05,**P<0.01
2.2 南蛇藤醇增强顺铂对食管癌细胞EC109生长的抑制作用
如图2A 所示,HET-1A细胞存活率以南蛇藤醇浓度依赖的方式降低,当MIL浓度超过20 μmol/L时,HET-1A细胞存活率显著降低(P<0.05)。与对照组比较,顺铂+南蛇藤醇(1 μmol/L)组、顺铂+南蛇藤醇(2.5 μmol/L)组和顺铂+南蛇藤醇(5 μmol/L)组EC109细胞存活率均显著降低(P<0.05)。如图2B所示,与对照组比较,顺铂+南蛇藤醇(1 μmol/L)组、顺铂+南蛇藤醇(2.5 μmol/L)组和顺铂+南蛇藤醇(5 μmol/L)组Ki67和PCNA蛋白表达水平显著降低(P<0.05)。
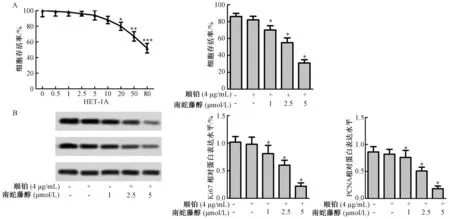
图2 南蛇藤醇增强顺铂对食管癌细胞EC109生长的抑制作用注:与对照组比较,*P<0.05Fig.2 Methanol extract of Cel. orbiculatus enhanced the inhibitory effect of cisplatin on EC109 growth of esophageal carcinoma cellsNote: Compared with the control group,*P<0.05
2.3 南蛇藤醇增强顺铂对食管癌细胞EC109侵袭和EMT的抑制作用
如图3A所示,与对照组比较,顺铂+南蛇藤醇(1 μmol/L)组、顺铂+南蛇藤醇(2.5 μmol/L)组和顺铂+南蛇藤醇(5 μmol/L)组的侵袭细胞数均显著减少(P<0.05)。如图3B所示,与对照组比较,顺铂+南蛇藤醇(1 μmol/L)组、顺铂+南蛇藤醇(2.5 μmol/L)组和顺铂+南蛇藤醇(5 μmol/L)组E-cadherin蛋白表达水平均显著升高(P<0.05),N-cadherin和Vimentin蛋白表达水平均显著降低(P<0.05)。
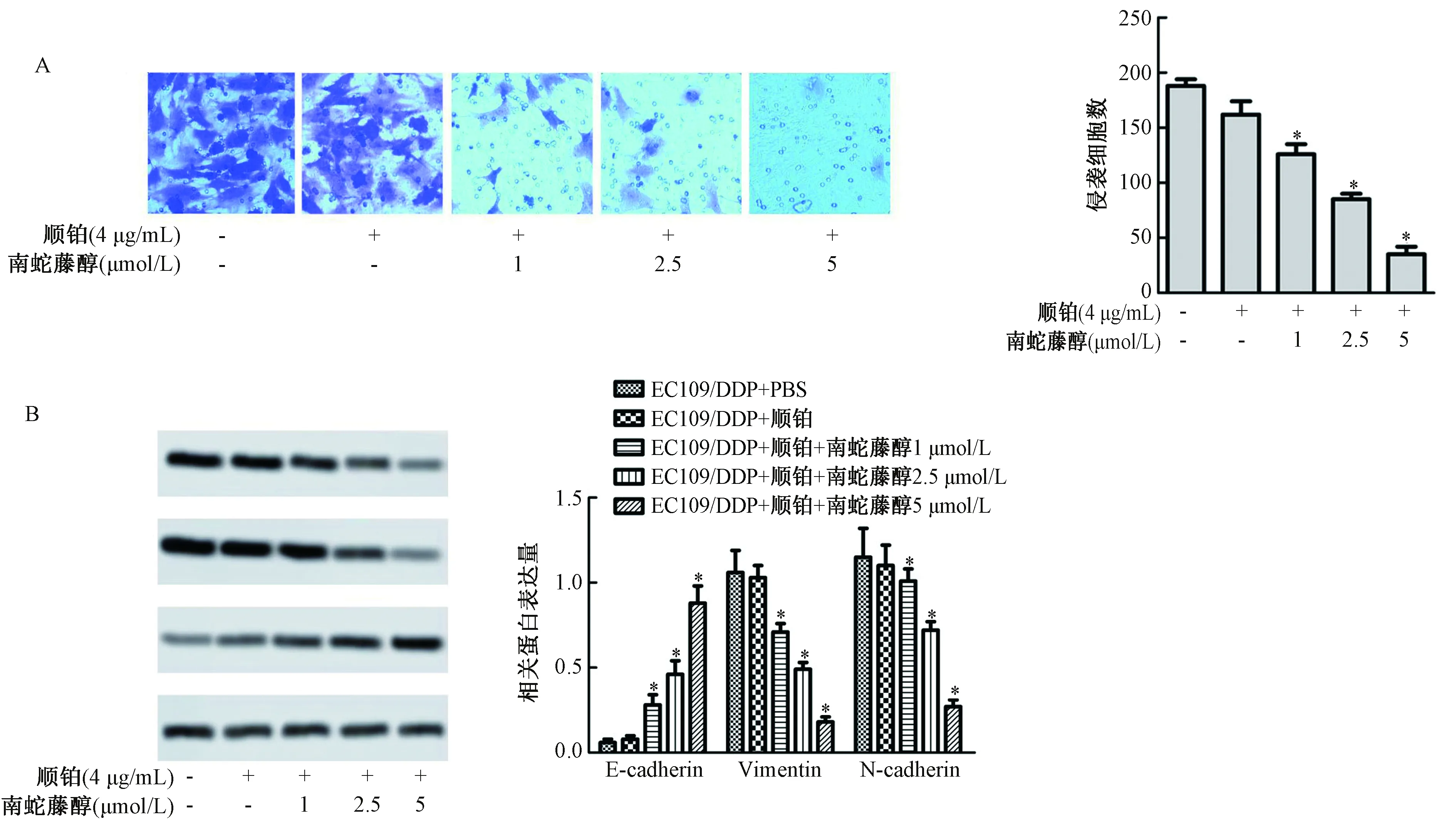
图3 南蛇藤醇增强顺铂对食管癌细胞EC109侵袭和EMT的抑制作用注:与对照组比较,*P<0.05Fig.3 Methanol extract of Cel. orbiculatus enhanced the inhibitory effect of cisplatin on EC109 invasion and EMT of esophageal carcinoma cellsNote: Compared with the control group,*P<0.05
2.4 南蛇藤醇促进顺铂诱导的食管癌细胞EC109凋亡
如图4A所示,与对照组比较,顺铂+南蛇藤醇(1 μmol/L)组、顺铂+南蛇藤醇(2.5 μmol/L)组和顺铂+南蛇藤醇(5 μmol/L)组凋亡细胞数均显著增加(P<0.05)。如图4B所示,与对照组比较,顺铂+南蛇藤醇(1 μmol/L)组、顺铂+南蛇藤醇(2.5 μmol/L)组和顺铂+南蛇藤醇(5 μmol/L)组cleaved PARP和cleaved caspase 3蛋白表达水平均显著升高(P<0.05)。
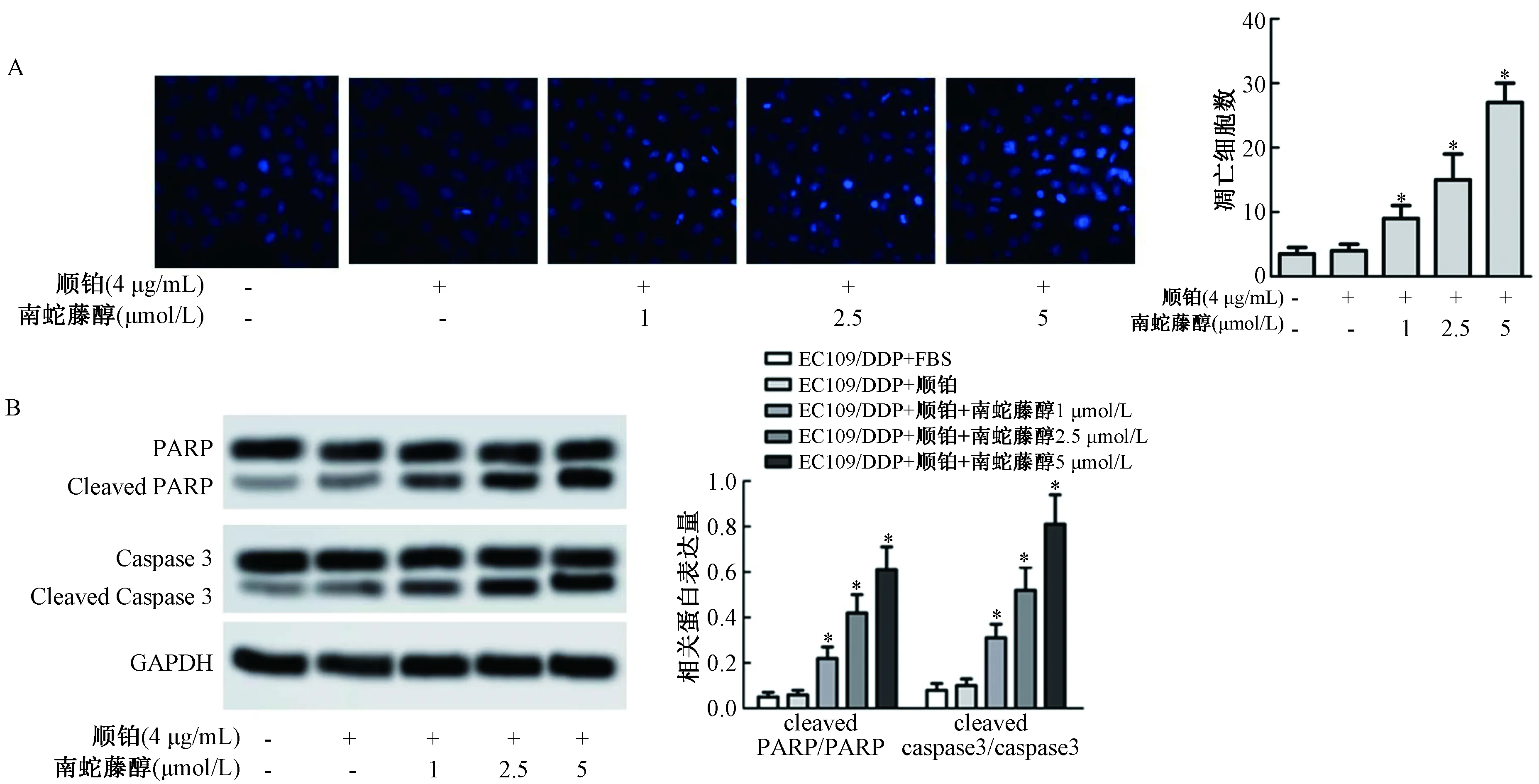
图4 南蛇藤醇对顺铂诱导的食管癌细胞EC109凋亡的影响注:与对照组比较,*P<0.05Fig.4 Methanol extract of Cel.orbiculatus enhanced the inhibitory effect of cisplatin on EC109 invasion and EMT of esophageal carcinoma cellsNote: Compared with the control group, *P<0.05
2.5 干扰PTEN促进食管癌细胞生长和侵袭
如图5A所示,与对照组比较,顺铂+南蛇藤醇(1 μmol/L)组、顺铂+南蛇藤醇(2.5 μmol/L)组和顺铂+南蛇藤醇(5 μmol/L)组PTEN蛋白表达水平均显著增加(P<0.05)。如图5B所示,与南蛇藤醇(5 μmol/L)组比较,南蛇藤醇+sh-PTEN组PTEN蛋白表达水平均显著降低(P<0.05);南蛇藤醇+sh-PTEN组细胞存活率和侵袭细胞数均显著升高(P<0.05),凋亡细胞数显著减少(P<0.05)。
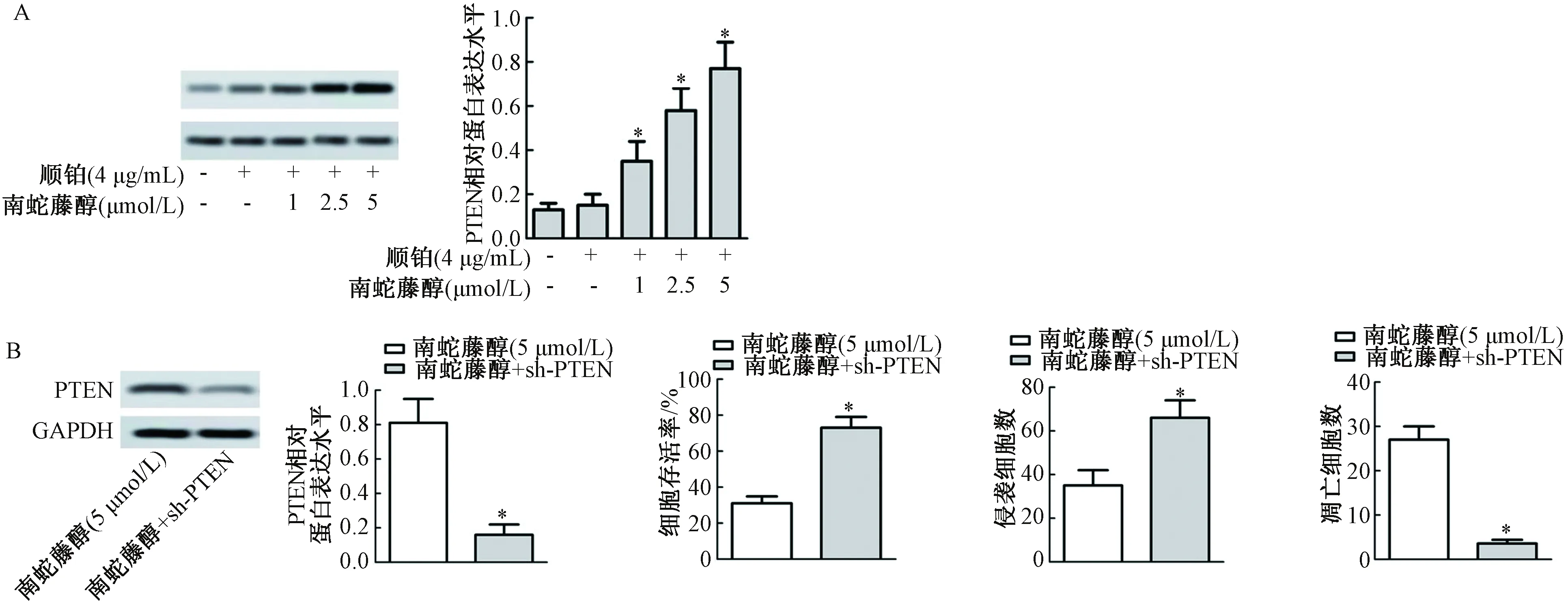
图5 干扰PTEN对食管癌细胞存活率、侵袭力以及凋亡的影响注: 与对照组比较,*P<0.05Fig.5 Effect of interfering pten on survival rate, invasiveness and apoptosis of esophageal carcinoma cellsNote: Compared with the control group,*P<0.05
3 讨论
食管癌在我国的致死率逐年上升,对人类健康造成严重影响[14-15]。由于食管癌患者早期症状不明显,患者确诊时多是癌症中晚期,所以临床上一般对其采用手术治疗以及放抗癌药物和化疗结合的方式进行治疗。但仍存在后期易复发、易转移、易产生耐药性、化疗药物的毒副作用大等问题[16]。因此,许多研究开始探索药物联合治疗来解决这些问题。目前,研究报道称南蛇藤提取物在胃腺癌[9]、肝癌[13]、胶质母细胞瘤[11]等治疗方面有很好的功效。目前关于南蛇藤醇对食管癌的功效还缺少报道,因此,本研究探索南蛇藤醇介导的PTEN过表达对食管癌的作用。
癌细胞无限增殖是癌症发生发展的重要机制。研究发现在体内,南蛇藤醇可明显降低实体瘤的体积和重量,且不良反应低,抑制Hepa1-6细胞的增殖,并在mRNA和蛋白水平上抑制VEGF的表达,降低了肿瘤血管生成[17]。同样,Jin等[18]研究发现南蛇藤醇以时间和剂量依赖性方式降低食管鳞癌细胞的存活率,并且通过PI3K/Akt/mTOR信号通路抑制增殖。与前人研究结果一致,本研究发现南蛇藤醇处理后的食管癌肿瘤模型小鼠体内肿瘤重量和体积均降低,Ki67、VEGF和Caspase 3阳性细胞数均减少,EC109细胞存活率降低以及Ki67和PCNA蛋白表达水平降低,PTEN蛋白表达水平升高,而当干扰PTEN后,PTEN蛋白表达水平降低,细胞存活率降低,表明南蛇藤醇介导的PTEN的过表达可增强顺铂对体内肿瘤形成和食管癌细胞EC109生长的抑制作用。
上皮细胞-间充质转化在癌症转移中有重要作用,是上皮细胞极性丧失、恶性肿瘤细胞获得迁移和侵袭能力的一个重要生物学过程[19]。研究发现南蛇藤醇可明显抑制AGS细胞的侵袭,南蛇藤醇处理后E-cadherin蛋白表达升高, N-cadherin和Vimentin蛋白表达降低,从而抑制上皮间质转化过程[20]。目前在胶质母细胞瘤的研究中发现南蛇藤醇处理增加E-cadherin的表达,降低N-cadherin和vimentin的表达,抑制EMT的过程和胶质母细胞瘤细胞的侵袭[21]。本研究发现南蛇藤醇处理后侵袭细胞数明显减少,E-cadherin蛋白表达水平升高,N-cadherin和Vimentin蛋白表达水平均降低,然而干扰PTEN后,PTEN蛋白表达水平下调,侵袭力降低,表明南蛇藤醇介导的PTEN的过表达可增强顺铂对食管癌细胞EC109侵袭和EMT的抑制作用。
诱导细胞凋亡是抑制肿瘤生长的主要手段之一。南蛇藤醇触发线粒体介导的凋亡途径并激活caspase-3,抑制Bcl-2和Bcl-xL蛋白的表达水平,并上调了Bax和caspase-3的表达水平,从而促进细胞凋亡[10]。研究发现南蛇藤醇处理后Bcl-2与Bax表达比值的降低,线粒体膜电位升高,南蛇藤醇可促进食管鳞癌细胞EC109凋亡。本研究发现南蛇藤醇处理后凋亡细胞数明显增加,以及凋亡相关蛋白cleaved PARP和cleaved caspase 3蛋白表达水平升高,而干扰PTEN后,PTEN蛋白表达水平降低,凋亡率明显下降,表明南蛇藤醇介导的PTEN过表达可促进顺铂诱导的食管癌细胞EC109凋亡。
综上所述,南蛇藤醇介导的PTEN过表达可有效的抑制肿瘤生长、降低肿瘤细胞存活率、促进食管癌细胞凋亡、降低侵袭能力、抑制EMT过程的发生,增强顺铂对食管癌细胞的化学敏感性,表明南蛇藤醇治疗可有效抑制食管癌的发展,且毒副作用较小,为南蛇藤醇应用于食管癌防治提供实验依据。
