猕猴从幼年到老年的卵巢组织学变化*
2020-04-09杨再玲朱向情吕冠柯王金祥蔡学敏潘兴华
田 川 杨再玲 朱向情 李 晔 吕冠柯 王金祥 赵 晶 蔡学敏 潘兴华
(1. 贵州医科大学,组织工程与干细胞实验中心,贵阳 550004)(2. 解放军联勤保障部队第920医院基础医学实验室,云南省细胞治疗技术转化医学重点实验室,干细胞与免疫细胞生物医药技术国家地方联合工程实验室,昆明 650032)
卵巢衰老是一个多因素相互作用,逐渐累积的复杂生物学过程,主要表现为卵母细胞数量和质量下降[1]。女性的生育能力随着年龄的增长而自然下降,30~35岁妇女的生育力下降速度缓慢而稳定,35岁以后,由于卵巢储备和卵母细胞质量和数量的下降,女性的生育力下降速度将加速[2]。目前,卵巢衰老的治疗方法主要有激素替代[3]和细胞因子治疗[4]等,但都存在各自的缺点,如引发心血管疾病等,不能从根本上解决卵巢衰老导致的不孕不育等问题。主要是因为卵巢衰老和女性与年龄相关的生育力下降的分子机制仍不清楚[5]。非人类灵长类动物是揭示年龄如何塑造卵巢的理想模型,因为它们的生物组成与人类高度相似,并且不易受混杂因素影响[6]。猕猴与人类的生理性及衰老特征相似,基因相似度90%以上,可作为一种特别有希望用于衰老研究的模型生物。有研究发现猕猴和人类之间存在广泛共享的免疫衰老的mRNA表达和DNA甲基化修饰[7]。因此,用猕猴作为卵巢衰老的研究对象,观察猕猴的卵巢组织从幼年到老年的变化规律,可为卵巢衰老的临床研究提供更充足的理论依据。
1 材料与方法
1.1 实验材料
实验动物:所用实验动物为健康雌性猕猴,由中国科学院昆明动物研究所提供幼年雌猴3只,平均年龄3岁,体质量2~3 kg;青年猕猴3只,年龄7~9岁,体质量4.5~7 kg;老年雌猴3只,年龄23~27岁,体质量4~7 kg。所有猕猴均饲养于中国科学院昆明动物研究所,饲养期间环境清洁卫生,动物笼具清洁干燥,达到动物饲养标准,实验动物生产许可证号SYXK(军)2012-0039,所有动物研究经依托单位实验动物伦理委员会批准,批件号为伦审2019-032(科)-01。
1.2 主要实验试剂与器材
通用型中性组织固定液、HE染液、Masson 染液(Servicebio);Tunel 试剂盒(Vazyme);鼠抗人CD34(美国BD公司);无水乙醇(天津市风船化学试剂科技有限公司);DAPI(Servicebio);中性树胶购自国药集团化学试剂有限公司;脱水机、包埋机、冻台均购自武汉俊杰电子有限公司;病理切片机和组织摊片机购自浙江省金华市科迪仪器设备有限公司;烤箱购自上海慧泰仪器制造有限公司;脱色摇床购自谷歌生物;IX70-121倒置相差显微镜购自Olympus公司;冰冻切片机购自Thermo公司;离心机购自上海安停仪器厂。
1.3 实验方法
1.3.1动物分组与分离卵巢:筛选的幼年猕猴、青年猕猴与老年猕猴各3只在实验室常规饲养2周,观察各组猕猴无异样变化后,用过量3%戊巴比妥钠(1 kg/mL)麻醉猕猴使其安乐死,首先暴露腹腔,找到卵巢位置,卵巢随阴道、输卵管一起取出,用镊子和手术剪剥离卵巢,无菌纱布拭干卵巢周围血迹,电子天平称质量(g)并拍照,再用镊子和手术剪把卵巢横向等比分成4份,约1 mm3左右,最后把卵巢放至4%多聚甲醛溶液中固定24 h。
1.3.2卵巢组织HE染色:取卵巢组织进行常规石蜡切片制作,HE染色,显微镜下观察卵巢组织结构变化。
1.3.3卵巢组织Masson染色:首先,石蜡切片脱蜡至水:依次将切片放入二甲苯Ⅰ 20 min、二甲苯Ⅱ 20 min、无水乙醇Ⅰ 5 min、无水乙醇Ⅱ 5 min、75%酒精 5 min,自来水洗3次。再将切片浸至 Masson A 液中浸泡过夜,次日用自来水洗3次。 同时,配制Masson B液与Masson C液等比混合液,切片浸染1 min后,用自来水洗3次,随后1%盐酸酒精分化,自来水洗3次。再将切片置于Masson D液中,浸染6 min,自来水漂洗3次,Masson E液浸染1 min,Masson F液染20~30 s。然后,切片用1%冰醋酸漂洗分化,两缸无水乙醇脱水。接着透明封片:切片放入第3缸无水乙醇5 min,二甲苯透明5 min,中性树胶封片。最后显微镜镜检,图像采集分析。
1.3.4卵巢组织Tunel染色:冰冻切片固定:将冰冻切片水平置于37 ℃烘箱烘烤15 min,4%多聚甲醛中固定 30 min,随后脱色摇床上用 PBS(pH 7.4)洗涤 3 次,5 min/次。修复:用组化笔在组织周围画圈,以防止液体流走,在圈内滴加蛋白酶K工作液覆盖组织,37 ℃温箱孵育25 min。再在脱色摇床上用PBS洗涤 3 次,5 min/次。破膜:向在圈内滴加破膜工作液以覆盖组织,室温孵育20 min,再用PBS洗涤3次,5 min/次。标记:用去离子按1∶4的比例水稀释试剂盒内5×Equilibration Buffer,滴加1×Equilibration Buffer使其全部覆盖待检测样本区域,室温孵育 10 min。加反应液:参照说明书,将Recombinant TDT Enzyme、BrightRed Labeling Mix、5×Equilibration Buffer和去离子水按1∶5∶10∶34混合,混合液缓慢滴加到圈内以覆盖组织为止,随后将切片平放于湿盒内,37 ℃恒温箱孵育2 h。DAPI 复染细胞核:切片用 PBS洗涤3次,5 min/次。充分吸去PBS后,在圈内滴加 DAPI 染液,室温避光孵育10 min。封片:切片用PBS洗涤3次,5 min次。随后滴加抗荧光淬灭封片剂封片。镜检拍照:切片于荧光显微镜下观察并采集图像。
1.3.5卵巢免疫组织化学染色: 石蜡切片脱蜡至水:依次将切片放入二甲苯Ⅰ 20 min、二甲苯Ⅱ 20 min、无水乙醇Ⅰ 5 min、无水乙醇Ⅱ 5 min、75%酒精5 min,双蒸水洗3次。抗原修复:组织切片放在EDTA抗原修复液中,然后在微波炉内中火8 min,停火8 min,转至中低火7 min进行抗原修复,在室温冷却后,玻片用PBS中洗涤3次,5 min/次。画圈与血清封闭:用组织笔在组织周围画圈,然后滴加BSA孵育30 min。加一、二抗:吸去封闭液,加一抗(1∶3 000),孵育过夜,PBS中洗涤3次后, 5 min/次。加入二抗室温避光孵育50 min。自发荧光淬灭:向圈中央滴加抗荧光淬灭封片剂封片。DAPI复染细胞核:在圈内滴加DAPI染液,室温避光孵育10 min。封片:切片用PBS洗涤3次,5 min/次,再滴加抗荧光淬灭封片剂进行封片,最后镜检送扫描。血管计数:参照Weidner 等校对计数方法,先在低倍镜下扫查整个切片,寻找3个血管高密度区,即“热点”;然后在×200下计数染色呈阳性的血管数,对于微血管的识别不需具备完整的管腔和红细胞,只要有明显的血管内皮细胞染色、并且能与相邻的血管、肿瘤细胞以及间质成分相分隔的,就可视为一个独立的血管,分辨不清以及具有较厚肌层的血管不纳入计数内;计数3个视野下血管数目平均值作为 MVD 值(个/HP),然后以Graphpad prism 5.0统计分析软件对所得数据进行分析(P<0.05)。
2 实验结果
2.1 幼年、青年、老年猕猴的卵巢脏器指数
卵巢脏器指数为卵巢质量与猕猴体质量的比值,其大小可以反映卵巢的萎缩及其他退行性改变。幼年猕猴的卵巢脏器指数与青年猕猴的无显著差异,都显著高于老年猕猴的卵巢脏器指数(图1)。
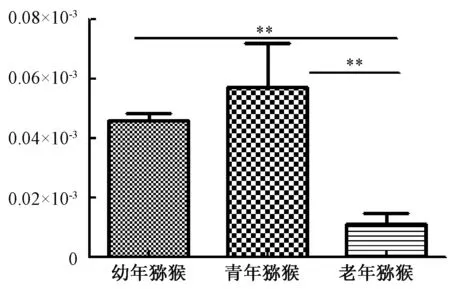
图1 猕猴卵巢脏器指数统计图注:**P<0.01Fig.1 Statistics of ovarian index of macaquesNote:**P<0.01
2.2 卵巢组织HE染色
由图2可知,幼年猕猴卵巢可见原始卵泡(黑色箭头)、初级卵泡(蓝色箭头)、次级卵泡(红色箭头)、成熟卵泡(绿色箭头)、闭锁卵泡(紫色箭头),青年猕猴卵巢可见原始、初级、次级、成熟卵泡,老年猕猴卵巢局部只见闭锁卵泡,被大量脂肪组织填充(黄色箭头)。幼年与青年猕猴卵巢实质比例显著高于老年猕猴。
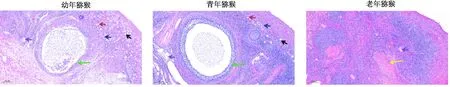
图2 卵巢组织HE染色(200 μm)Fig.2 HE staining of ovarian tissue(200 μm)
2.3 卵巢组织Masson染色
由图3可知,Masson染色可以反映卵巢组织的纤维化,图中蓝色为胶原纤维,红色为肌纤维、纤维素与红细胞。幼年猕猴卵巢在皮质区有少量胶原纤维沉积,大量纤维素与红细胞。青年猕猴在髓质与皮质区有少量胶原纤维沉积,排列稀疏,不规律。老年对照组胶原纤维在髓质和间质中都沉积有大量胶原纤维,沉积面积大,排列缜密且紊乱,局部可见少量肌纤维、纤维素与红细胞。对胶原纤维所占面积比进行分析,结果显示老年猕猴最高(P<0.01),青年猕猴低于幼年猕猴(P<0.05)。
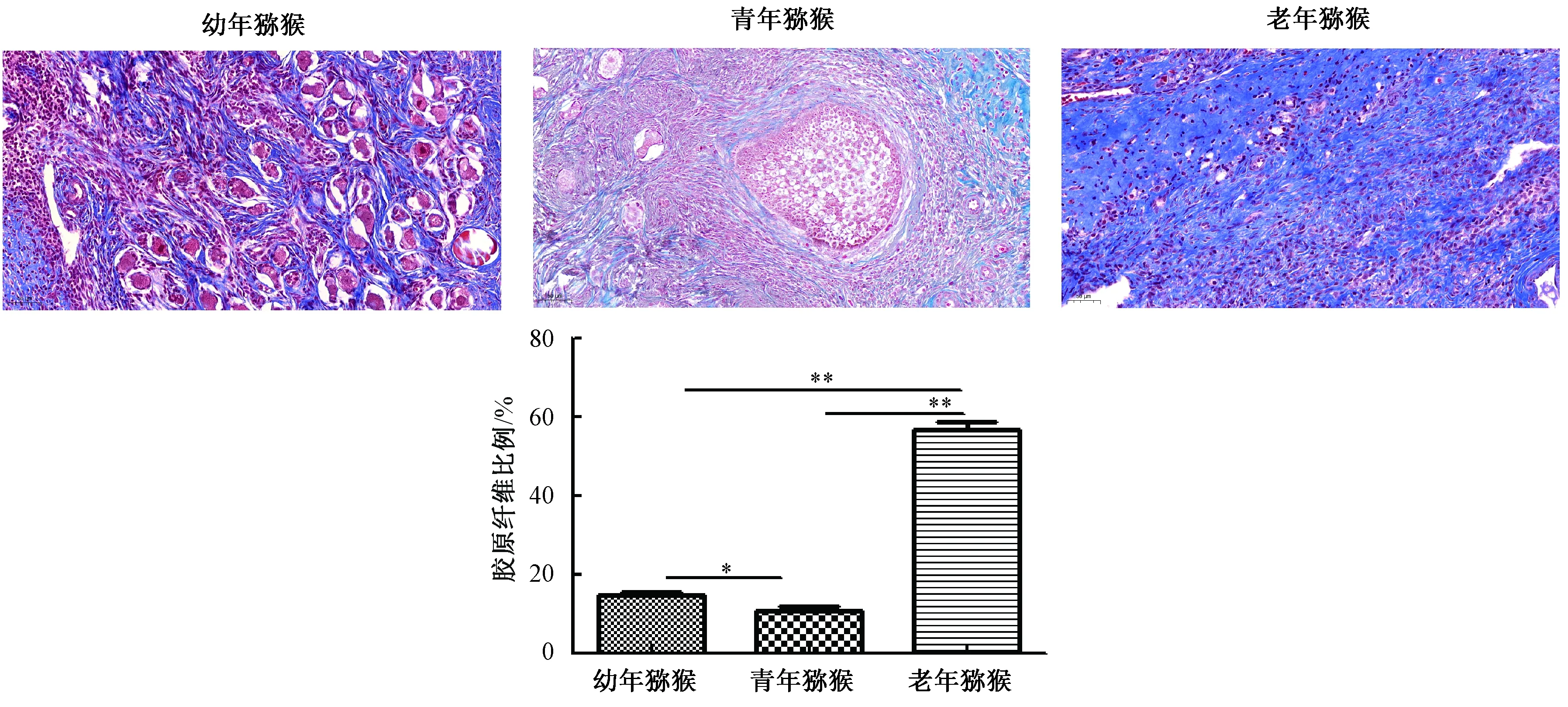
图3 卵巢组织Masson染色(50 μm)注:*P<0.05,**P<0.01Fig.3 Masson staining of ovarian tissue (50 μm)Note:*P<0.05,**P<0.01
2.4 卵巢组织Tunel染色
由图4可知,Tunel染色中凋亡细胞被染成红色,细胞核为蓝色。幼年猕猴卵巢与青年猕猴卵巢中几乎没有细胞凋亡;老年猕猴的卵巢大部分细胞染成红色。对凋亡细胞占比进行分析,结果显示幼年猕猴卵巢的细胞凋亡率与青年猕猴的无显著差异,老年猕猴卵巢的细胞凋亡率最高(P<0.01)。
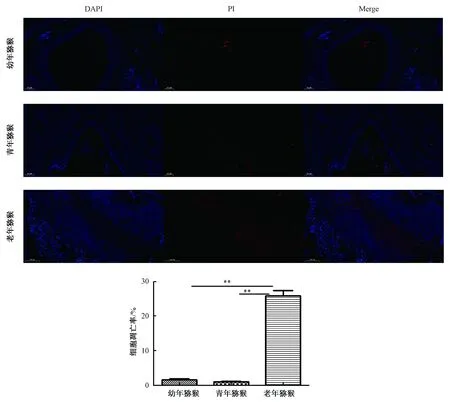
图4 卵巢组织Tunel染色(100 μm)注:**P<0.01Fig.4 Tunel staining of ovarian tissue(100 μm)Note:**P<0.01
2.5 卵巢组织免疫组织化学染色
利用免疫组织化学染色法来标记CD34以分析卵巢组织中的血管个数,CD34表达于血管内皮细胞,被标记后染成红色。对CD34阳性颗粒及血管个数进行统计分析,结果显示幼年猕猴卵巢血管个数为160,青年猕猴卵巢血管个数为109,老年猕猴血管个数76(图5)。
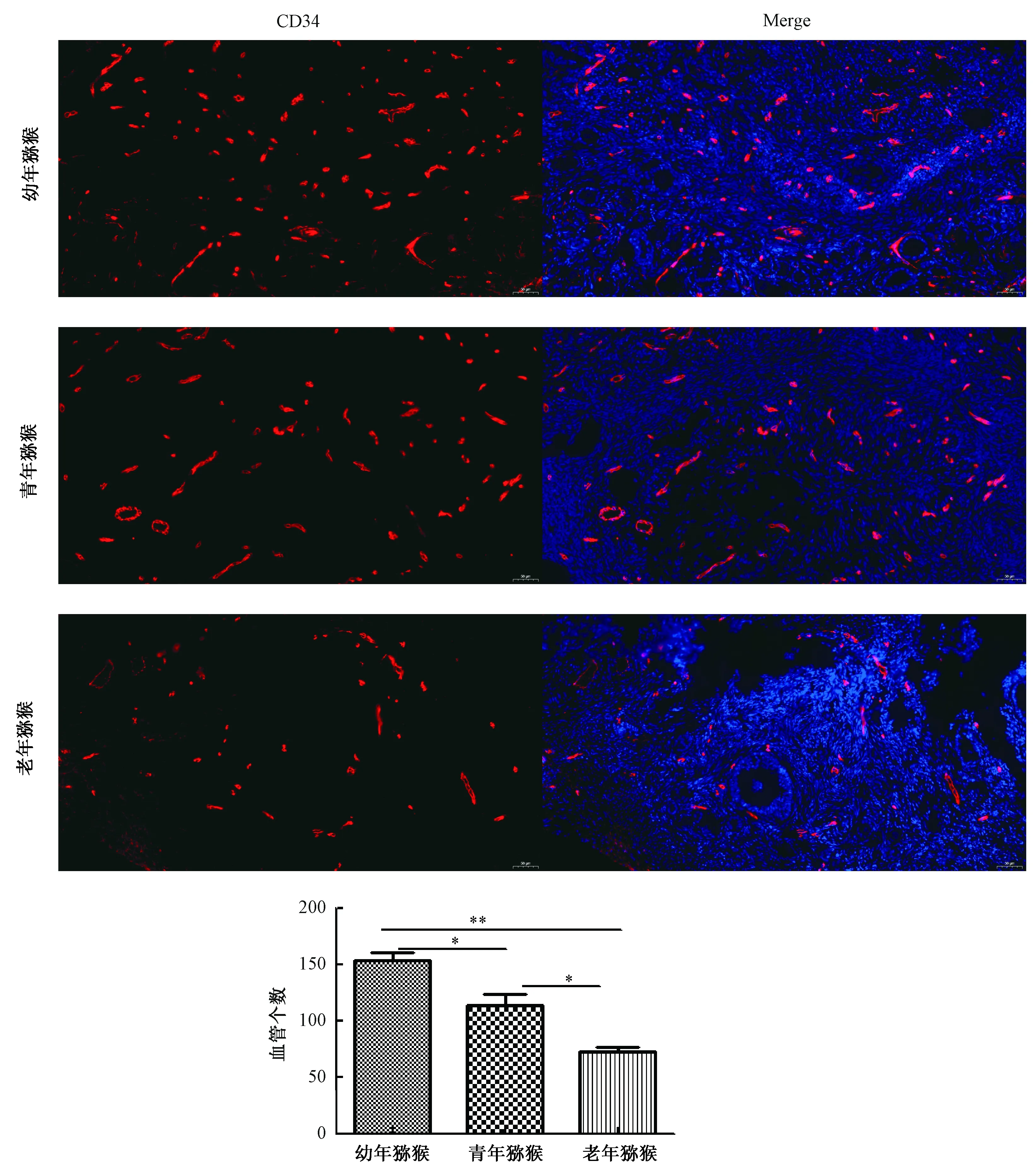
图5 卵巢组织免疫组织化学染色(50 μm)注:*P<0.05,**P<0.01Fig.5 Immunohistochemical staining of ovarian tissue(50 μm)Note:*P<0.05,**P<0.01
3 讨论
随着社会和经济的发展,晚婚晚育现象越来越普遍,各种诱因导致高龄女性卵巢衰老不孕不育的人数越来越多。目前针对卵巢衰老的治疗多为性激素替代,细胞因子治疗和中医治疗等,但都治标不治本,其原因主要是卵巢衰老的关键调控机制不完全清楚,探索新的治疗方法依然是需要研究的重点。猕猴属于非人类灵长类动物,其衰老特征和卵巢组成与人类相似,以猕猴为卵巢衰老研究对象,观察猕猴的卵巢从幼年到老年的组织结构变化,实验结果将更接近于对女性卵巢衰老的研究。
幼年猕猴的卵巢脏器指数与青年猕猴的无显著差异,都显著高于老年猕猴的卵巢脏器指数,提示猕猴到了老年后卵巢体积逐渐萎缩。女性生殖(卵巢)衰老的特征是由于卵泡和卵母细胞的质量和数量显着下降,生殖功能明显降低[8]。随着卵巢衰老,卵泡池逐渐减少,卵母细胞质量下降[9]。本实验HE结果显示,幼年猕猴卵巢组织中有大量的原始与初级卵泡,青年猕猴卵巢中的初级卵泡与次级卵泡数量下降,出现较多的次级卵泡,部分卵泡发育成熟,老年猕猴卵泡闭锁,出现闭锁卵泡,有大量脂肪组织填充。说明随着年龄的增长,猕猴卵巢卵泡逐渐被消耗,最后发生闭锁。
纤维化过度积累会破坏组织结构和功能,包括心脏,肺和肾脏在内的多个器官均表现出与年龄相关的纤维化[10]。Masson 染色结果显示,幼年猕猴卵巢皮质区有少量胶原纤维沉积,大量纤维素与红细胞。青年猕猴髓质与皮质区有少量胶原纤维沉积,排列稀疏,不规律。老年猕猴髓质和间质中都沉积有大量胶原纤维,沉积面积大,排列缜密且紊乱,局部可见少量肌纤维、纤维素与红细胞。可见,猕猴从幼年到青年阶段纤维化程度逐渐减弱,而后从青年到老年阶段纤维化程度逐渐增加。有研究发现卵巢纤维化具有增加CD206+∶CD68+的细胞比例,CD8+T细胞浸润和纤维化DPP4+αSMA+成纤维细胞[11]。有研究证明纤维化是卵巢间质衰老的早期标志,这种微环境的改变可能导致与年龄相关的配子质量下降[10]。卵巢纤维化是卵巢成纤维细胞过度增殖和细胞外基质沉积导致,许多细胞因子,如MMPs、TGF-β1与VEGF都参与了卵巢纤维化[12]。在幼年和老年人的非人类灵长类动物卵巢的单细胞转录组学研究中,鉴定了卵巢中7种具有不同基因表达特征的卵巢细胞,包括卵母细胞和7种类型的卵巢体细胞[13]。可见,幼年猕猴卵巢的纤维化程度高于青年猕猴卵巢的纤维化,可能是由于猕猴在幼年期卵巢,胸腺等器官未完全发育成熟,抗炎症、氧化应激与免疫调控等能力不足,不能及时修复卵巢损伤,导致局部发生纤维化。随着年龄增长,到了青年阶段,猕猴各个器官发育完全,免疫调控与抗炎等能力逐渐增强,使得纤维化减弱。到了老年阶段,猕猴整体器官功能发生退变,卵巢纤维化增加导致猕猴卵巢功能下降,结构被破坏。
卵泡闭锁是哺乳动物卵巢中颗粒细胞和卵母细胞丢失以及卵巢早衰的主要过程,研究表明,颗粒细胞凋亡会导致卵泡闭锁[14]。本研究中,Tunnel 染色结果显示幼年猕猴卵巢的细胞凋亡率与青年猕猴的凋亡率无显著差异,老年猕猴卵巢的细胞凋亡率最高。也有结果表明,衰老的卵泡间质细胞产生的与衰老相关的分泌表型相关的细胞分泌趋化因子配体可能通过促进颗粒细胞凋亡而在卵巢衰老过程中损害卵泡的发育和成熟[15]。可见,老年猕猴的卵巢大量卵泡发生闭锁,可能是由于卵巢细胞凋亡增加引起的。
血管随着年龄的增长而丢失,与年龄有关的血管丢失是特定于区域的,并且可以至少部分地通过对毛细血管堵塞的区域敏感性来解释[16]。本研究的实验结果显示幼年猕猴卵巢血管个数为160,青年猕猴卵巢血管个数为109,老年猕猴血管个数76,提示猕猴卵巢血管个数在幼年时最多,然后逐渐退化甚至丢失。有研究发现小血管疾病的危险因素可通过削弱毛细血管功能来减少组织氧合,衰老和血管危险因素会损害白质过高灌注和毛细血管功能,从而造成缺氧组织损伤,继而影响其消耗的白质束的功能和代谢需求[17]。推测猕猴卵巢血管个数增龄性减少,可能会导致卵巢供血及营养因子不足,从而发生卵巢组织损伤,结构被破坏。
综上所述,猕猴从幼年到老年,卵泡逐渐被消耗,间质区排列散乱,髓质区被脂肪组织填充。卵巢纤维化程度从幼年到青年阶段减弱,青年以后纤维化程度逐渐增强。卵巢细胞凋亡率从幼年到青年阶段无显著差异,青年到老年阶段细胞凋亡率上升。卵巢组织中的血管从幼年开始以后逐渐退化甚至丢失。推测猕猴卵巢组织结构和卵泡从幼年到老年的变化趋势,可能是通过纤维化与卵巢细胞凋亡率增加,血管个数减少来调控的,但是具体的调控机制还需要进一步的研究。
