卵巢切除小鼠冠状动脉封堵诱导心肌梗塞模型的建立与评估*
2020-04-09王晓武师长宏刘宏斌
王 菲 胡 威 张 鹏 王晓武 师长宏 刘宏斌
(1. 中国人民解放军联勤保障部队第九四○医院心血管内科,兰州 730050)(2. 空军军医大学西京医院心血管外科,西安 710032)(3. 空军军医大学实验动物中心,西安 710032)(4. 中国人民解放军联勤保障部队第九四○医院普通外科,兰州 730050)
心肌梗塞(myocardial infarction,MI)是一种常见的心血管疾病。流行病学调查显示,绝经后女性MI的发病率显著上升,且与同龄男性相比,绝经后女性在缺血性心脏病中的纤维化更为严重[1]。绝经后妇女体内雌激素的大量减少导致心脏保护功能的降低,心血管疾病风险的增加,但在这种情况下单纯雌激素治疗无效,提示可能与雌激素变化有关,但具体机制不明确[2]。因此,建立相应的动物模型对于绝经期妇女的心脏保护研究具有重要意义[3]。
MI引起的炎症反应和细胞凋亡在疾病进程的发展和预后中起重要作用。已证实炎症和细胞凋亡对于MI后心室重构至关重要[4]。因此,在本研究中,我们将雌性C57BL/6 J小鼠卵巢切除后,封堵小鼠的左冠状动脉前降支,制备绝经后女性MI的动物模型。通过观察其心脏功能、心肌梗塞面积和心肌纤维化程度,检测凋亡率、TNF-α和IL-10水平的变化,用于评估切除卵巢的雌性小鼠发生MI的特征。
1 材料和方法
1.1 试剂和动物
TUNEL测定试剂盒和DAPI均购自Roche公司,BCA蛋白定量试剂盒购自Merck Millipore公司,TGF-β购自Abcam公司,肿瘤坏死因子-α(TNF-α)和白介素10(IL-10)检测试剂盒均购自武汉Elabscience公司。7~8周龄雌性C57BL/6 J小鼠购自第四军医大学实验动物中心,实验动物生产许可证号:SCXK(陕)2019-001。将小鼠随机分为3个实验组,每组20只,分别为对照组、卵巢切除(OVX)组和卵巢切除联合心肌梗塞(OVX+MI)组。
1.2 卵巢切除术和心肌梗死
用3%戊巴比妥钠腹腔注射麻醉小鼠后,进行双侧卵巢切除术获得OVX模型小鼠[3]。在双侧卵巢切除后2 周,使用6-0丝线缝合法将小鼠的左冠状动脉主降支封堵,在小鼠中诱发MI[5],获得OVX+MI小鼠。具体方法是用6-0丝线在距左冠状动脉主降支2~3 mm处绕活结,然后将心脏迅速放回胸腔,手动排空空气并关闭皮肤。活结缝合线的内部头端应尽可能短,缝合线的另一端约0.8 cm长,并留在胸腔外侧。缺血30 min后,平滑轻柔地拉动活结缝合线的长端来释放活结,直到感觉到释放的感觉,这时心肌开始重新灌注。对照组动物在不结扎冠状动脉的情况下进行了相同的手术。
1.3 超声心动图测量和血液动力学监测
在MI手术前3 d(基线)和术后4 周,使用Vevo 770超声成像系统对心脏功能进行无创监测。超声心动图评估是在吸入异氟烷(1%~2%)麻醉下进行,同时监测心率(≥500次/min)和体温(37 ℃±1 ℃)。使用高分辨率体内成像系统进行二维超声心动图测量,记录舒张期和收缩期的心内膜体积,计算左心室射血分数(LVEF)和左心室短轴缩短率(LVFS)[6]。
在心肌梗塞后第4周通过微型化的压力容积导管术进行了血流动力学分析。将带尖头的导管插入小鼠右颈动脉,并在麻醉小鼠中逆行至左心室。观察波形-体积环的形态,记录左心室内压最大上升速率(dp/dtmax)[7]。所有分析均使用Lab Chart 7软件进行。
1.4 形态分析
小鼠心肌梗塞后,取出心脏,使用30 mmol/L KCl将其停在舒张期,然后用10%福尔马林缓冲液灌注固定,使用Masson的三色染色切片测量梗死面积[8](即梗塞疤痕占左心室周长的百分比)。使用心肌中部计算梗塞厚度,取沿梗塞壁的3个等距测量结果的平均值。分别用Masson 三色染色和HE染色横截面(4 μm厚),使用BIOQUANT图像分析软件测量纤维化程度,并计算出左心室壁区域瘢痕组织大小的比例[3]。
1.5 免疫细胞化学和TUNEL测定
使用标准程序进行福尔马林固定和石蜡包埋的心脏切片的免疫组织化学染色(IHC)。将固定的成纤维细胞与一抗TGF-β1(1∶200)在4 ℃下孵育过夜,然后与封闭溶液中与Cy3偶联的山羊抗兔IgG(1∶100稀释液)孵育。将TUNEL检测溶液添加到切片中,并将切片在37 ℃下孵育2 h,用DAPI进行核染色。在激光扫描共聚焦显微镜下观察切片,并从随机选择的10个视野中计数细胞以确定细胞凋亡指数,通过TUNEL法分析心肌细胞凋亡率。
1.6 促炎细胞因子TNF-α和IL-10的测定
参照文献[9]的方法,使用夹心ELISA试剂盒评估不同实验组小鼠血清中TNF-α和IL-10的水平。
1.7 统计分析
所有实验均重复3次,所有数值均以平均值±标准误差表示。通过ANOVA和Bonferroni校正对差异进行t检验。所有统计测试均使用GraphPad Prism 5.0软件进行,P<0.05有统计学意义。
2 结果
2.1 卵巢切除术对MI雌性小鼠心脏功能的影响
将小鼠切除卵巢后2 周进行MI手术,此后4 周进行M型超声检查和血流动力学测试,结果见图1。OVX组的LVEF值显著低于对照组(P<0.05),而OVX + MI组的LVEF值比OVX组更低(P<0.05;图1B)。不同组间的LVFS值也有相似的趋势(图1C)。血流动力学分析显示OVX组或OVX+MI组降低了dP/dt最大值(P<0.01;图1D)。上述结果表明OVX可以降低小鼠的心脏功能,而OVX+MI可以进一步加重心脏功能受损。
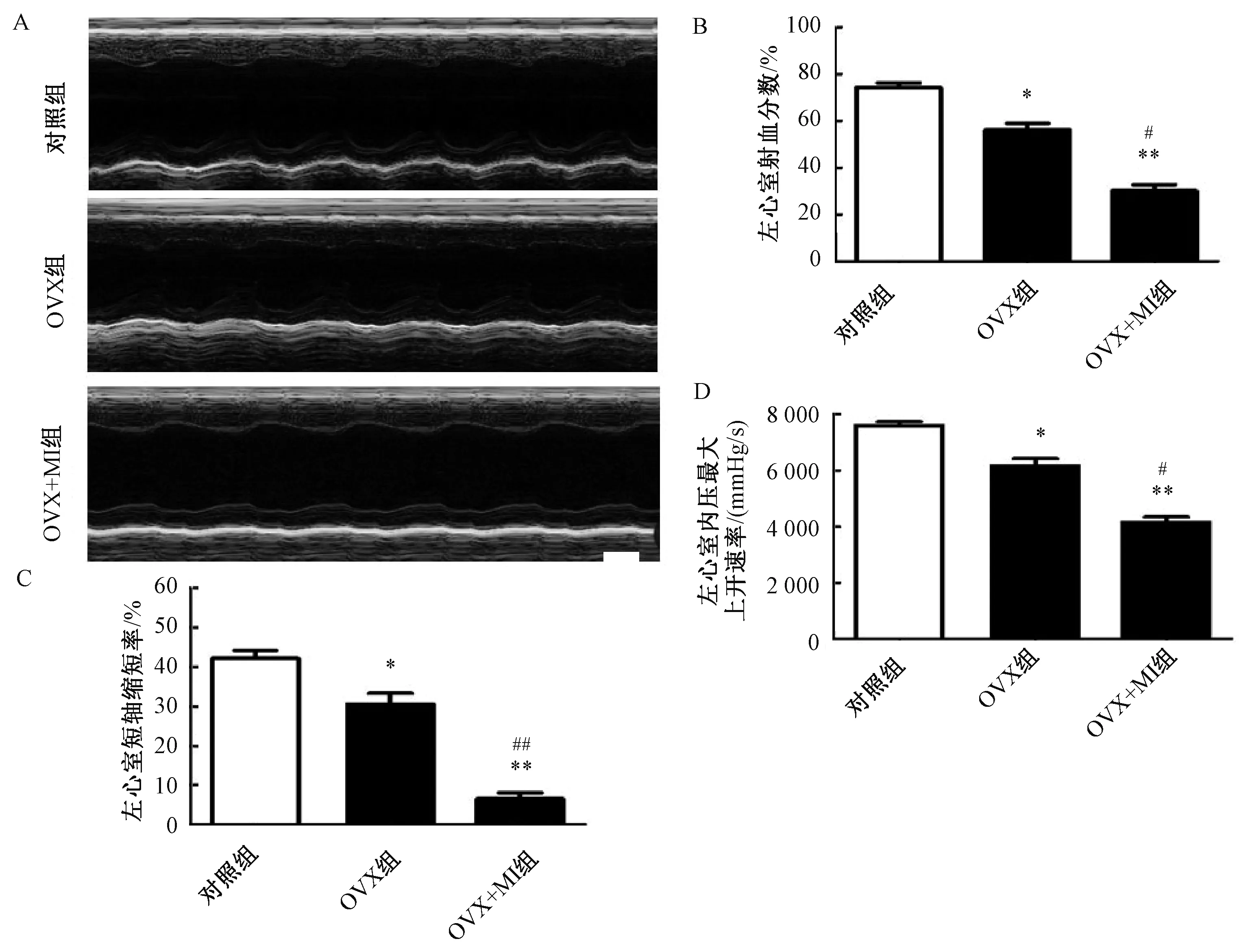
图1 卵巢切除术对MI雌性小鼠心脏功能的影响注:与对照组相比,*P <0.05和**P <0.01;与OVX组相比,#P <0.05和##P<0.01Fig.1 Effect of ovariectomy on heart function of female mice with MI treatmentNote:Compared with the control group, *P<0.05 and **P <0.01; Compared with OVX group, #P <0.05 and ##P<0.01
2.2 卵巢切除术对MI雌性小鼠心脏形态和纤维化的影响
与对照组相比,OVX组的心脏组织和心室壁较薄,心肌纤维化程度较高;Masson的三色染色显示OVX+MI可显着减少心脏组织和心室壁的厚度,增加心肌纤维化程度(与OVX组相比,P<0.01)。
心肌组织梗塞边界区的形态结构通过HE染色进行了分析,OVX组心肌组织显著松散,少数细胞排列紊乱,而OVX + MI组的心肌梗塞边界区的组织明显松弛,且细胞排列紊乱加剧(图2A),梗塞区的心室壁较薄,纤维化程度较高(图2B、C)。与OVX组相比,OVX + MI组可引起心肌组织疏松和紊乱,水肿更明显。
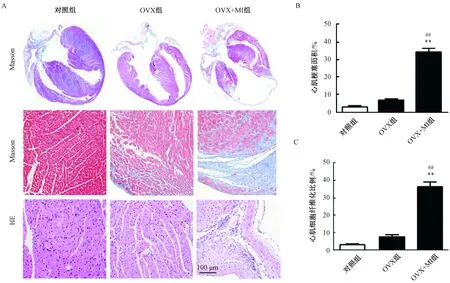
图2 卵巢切除的雌性小鼠心肌梗塞的心脏纤维化和形态变化注:与对照组相比,**P <0.01;与OVX组相比,##P<0.01Fig.2 Cardiac fibrosis and morphological changes of ovariectomized female mice with myocardial infarctionNote: Compared with the control group, **P<0.01; Compared with OVX group, ##P<0.01
2.3 免疫荧光和TUNEL的结果
免疫荧光(IFC)染色结果如图3所示,通过TUNEL染色原位检测凋亡性心肌细胞的代表性照片,红色荧光显示TGF-β1表达,绿色荧光显示TUNEL阳性细胞核,蓝色荧光显示总的心肌细胞核。由图4可知,OVX组可诱导心肌细胞凋亡率增加和TGF-β1表达,与对照组相比有显著差别(P<0.05 和P<0.01);OVX+MI组可进一步增加心肌组织梗塞边界区的凋亡率和TGF-β1表达,与OVX组相比,P<0.05有显著差别。
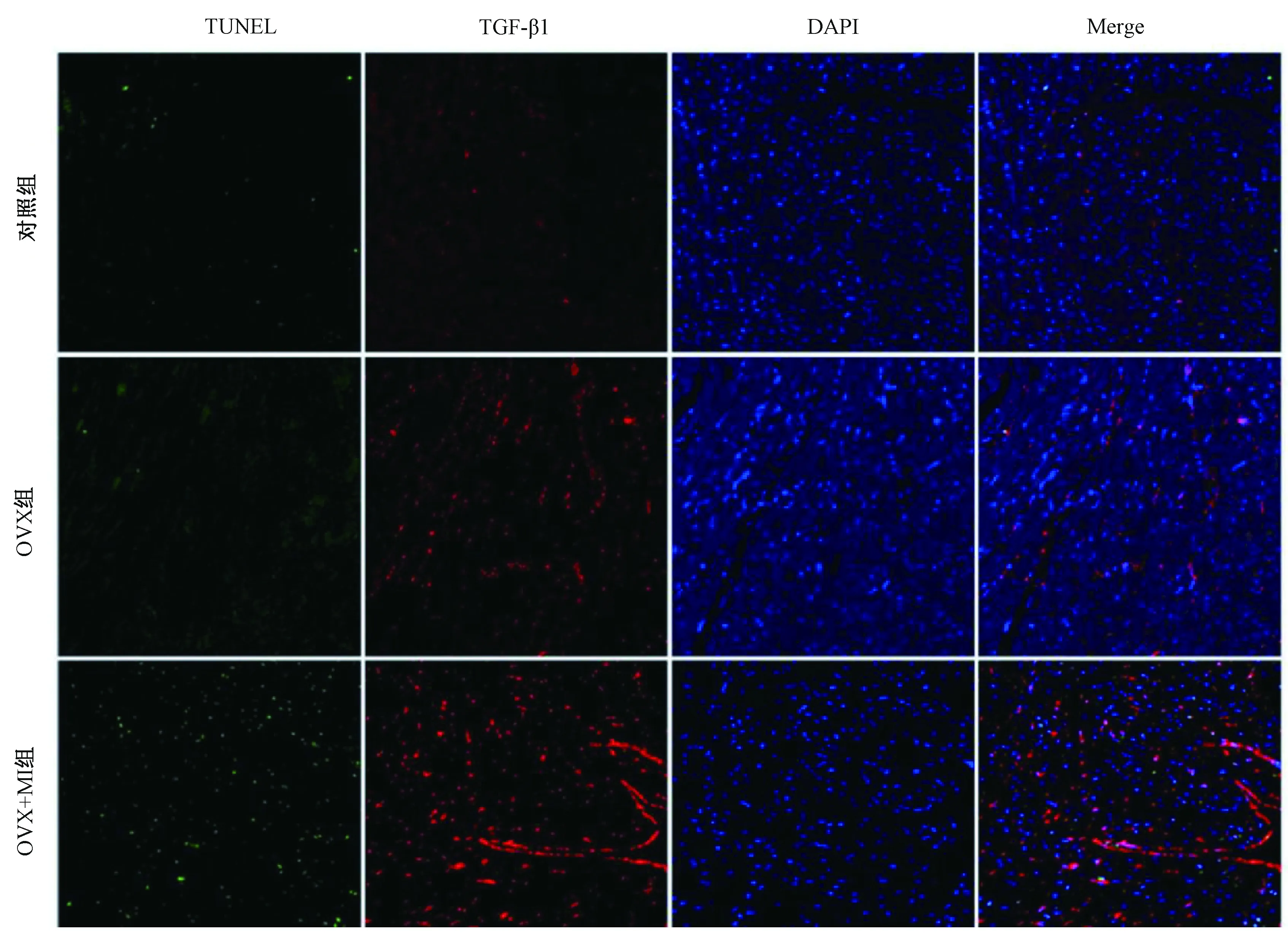
图3 卵巢切除的雌性心肌梗死小鼠心肌细胞TUNEL染色和TGF-β1表达(Bar=100 μm)Fig.3 TUNEL staining and TGF-β1 expression in cardiomyocytes of ovariectomized female mice with myocardial infarction(Bar=100 μm)
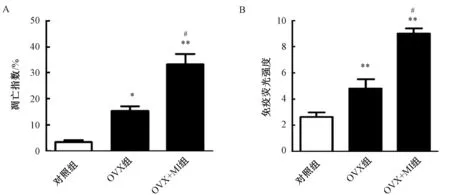
图4 卵巢切除的雌性心肌梗塞小鼠心肌细胞凋亡比例和TGF-β1荧光强度注:对照组相比,*P <0.05和**P<0.01;与OVX组相比,#P <0.05Fig.4 Apoptosis ratio and TGF-β1 fluorescence intensity of ovariectomized female mice with myocardial infarctionNote: A. Compared with the control group, *P<0.05 and **P<0.01; Compared with OVX group, #P <0.05
2.4 血清TNF-α和IL-10水平
ELISA检测结果表明,与对照组相比,OVX+MI组小鼠血清中促炎细胞因子TNF-α和IL-10水平显著增加(图5)。
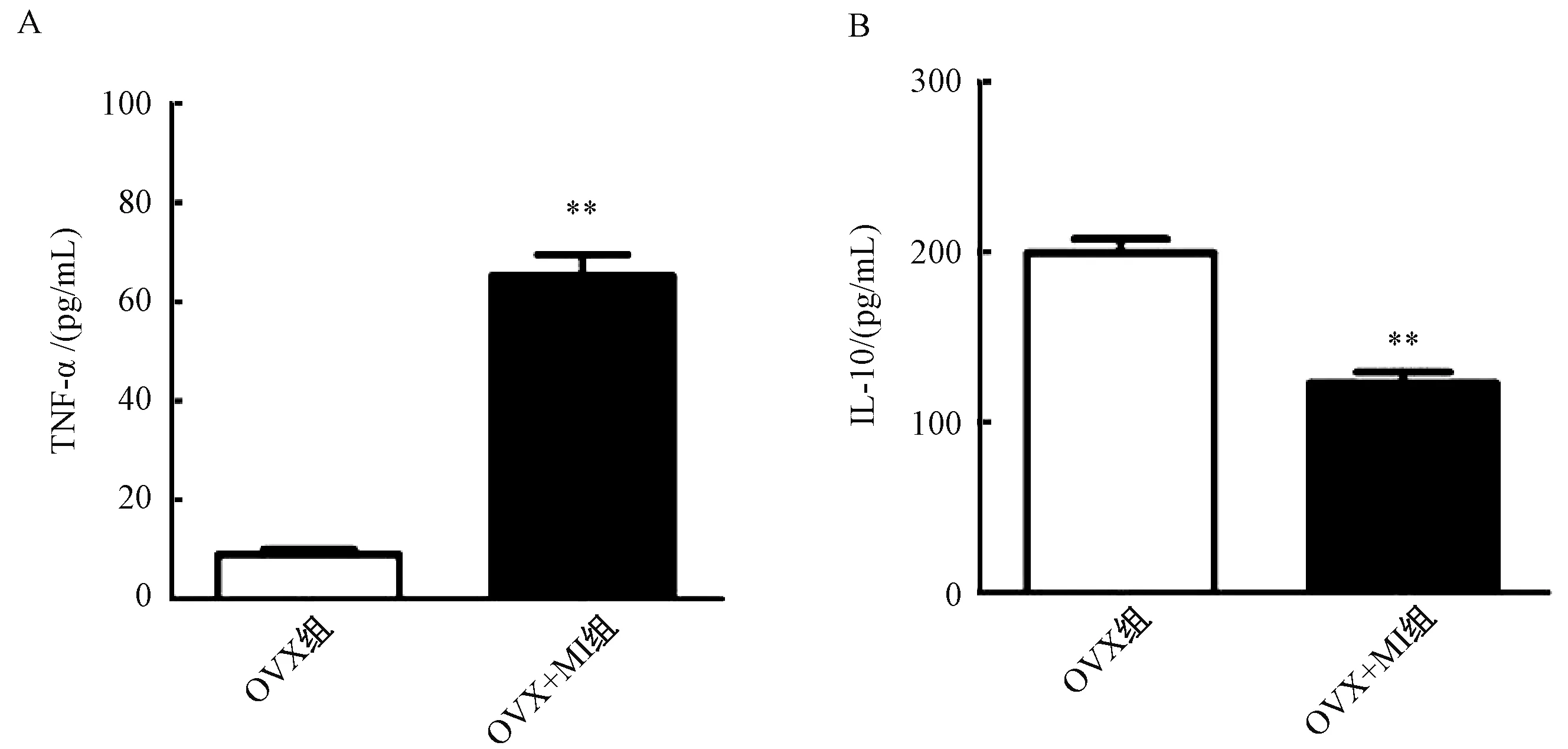
图5 卵巢切除的雌性心肌梗塞小鼠血清中炎症相关因子水平的变化注: 与OVX组相比,**P <0.01Fig.5 The inflammatory cytokines levels in serum of ovariectomized female mice with myocardial infarctionNote:Compared with OVX group,**P<0.01
3 讨论
绝经后妇女发生MI的主要特征包括心脏功能受损、心肌纤维化和炎症的发生,单纯使用雌鼠去卵巢诱导的相关变化非常有限[3]。心肌纤维化是导致MI后心脏功能障碍的主要组织学标志物。MI后的心室重构包括心肌细胞凋亡、炎症、肥大以及心肌基质胶原纤维的合成和降解[10]。Roy等[11]利用芯片技术分析了心肌梗塞后第2天和第7天,发现大鼠心脏组织的功能基因改变主要与炎症,细胞凋亡和细胞外基质有关。Kajstura等[12]发现,心肌细胞凋亡在MI的发生中起重要作用。凋亡是心肌梗塞大小的决定因素,并且在梗塞边界区域的心肌细胞凋亡与梗塞大小有关。心肌细胞的凋亡会增加梗塞面积,引起心肌的进行性缺失,扩大梗塞面积,使心室壁变薄,使心室扩张,并导致心脏逐渐重塑,发展为心力衰竭。本研究使用超声心动图和压力容积导管测量显示,切除卵巢的雌性小鼠的心脏功能显著降低,IFC显示这些小鼠的心肌纤维化和心肌细胞凋亡显著增加,这些结果表明,雌激素缺乏会加重MI小鼠的心脏损伤。
心肌梗塞治疗后,坏死细胞诱导炎性细胞因子触发炎症反应,引起心肌纤维化,心室重构,心脏功能障碍,最终导致心力衰竭。炎症可以通过信号途径(如通过TNF-α发生的信号途径)调节细胞凋亡。细胞凋亡的反馈会影响炎症的严重程度,这两个因素共同影响梗塞面积和心功能恢复[13]。因此,炎症反应和细胞凋亡应该是心梗后心室重构和心脏功能障碍的重要原因。本研究中,卵巢切除的小鼠可以观察到明显的凋亡和炎症,而卵巢切除的MI小鼠则显示出相对较高的凋亡率和炎症反应,炎症相关细胞因子如TNF-α和IL-10的呈现出高水平表达,上述特征与绝经期妇女发生MI后炎症相关因子的变化相一致。
综上所述,本研究将雌性小鼠卵巢切除后进行左冠状动脉前降支封堵诱导MI的发生,成功制备了模拟绝经后女性发生MI的动物模型。超声心动图和血流动力学检查表明卵巢切除联合心肌梗塞可加重心脏功能受损,形态学检查发现该模型小鼠心室壁变薄,心室扩张和心脏重塑,TNF-α和IL-10表达升高,与绝经期妇女发生MI后症状相一致,从而为绝经期妇女的心脏保护研究提供了良好的动物模型。
