光电结合检测大鼠原代神经元胞内钙离子浓度方法的建立*
2020-04-09刘丽娜薛奋勤
刘丽娜 许 晴 魏 华 李 华 薛奋勤 薛 冰
(首都医科大学中心实验室,北京 100069)
神经元内钙离子的作用贯穿了其生命周期的整个生命过程,如转录、分化、信号的传导及递质的释放和凋亡等等。体内钙离子发生变化会导致很多疾病,而很多应激也会首先导致钙相关蛋白发生改变[1]。显微成像技术已经广泛的应用在科学研究中,神经荧光染料结合成像技术已经广泛应用到检测各种活细胞胞内的钙离子的变化[2-3]。在神经元中,钙离子通过电压和配体门控通道产生的胞内钙离子变化最明显。另外,细胞内储存的钙释放也会导致胞内钙离子升高。神经元处于静息状态时,胞内钙离子浓度为100~200 nmol/L,在神经元受到刺激后,膜去极化,钙离子通道打开,钙离子内流,胞内钙离子迅速升高到原来的10~100倍。我们通过搭建转盘共聚焦系统结合电刺激,并对神经元细胞中的钙离子进行成像。采用孵育染料使其进入细胞。先观察细胞内自发的钙离子变化,然后对细胞进行电刺激并记录到了胞内钙离子刺激前后的变化。电刺激是神经元功能研究中常见的刺激方式,可以通过改变刺激强度和刺激频率来模拟生理和病理状况。所以,结合成像系统来记录神经元胞内钙离子浓度意义重大并为进一步研究神经元的功能和神经环路奠定了基础。
1 材料与方法
1.1 主要试剂
Neurobasal培养基、B27、青链霉素购自美国Gibco公司; D-Hanks液购自美国HyClone公司;L-glutamic acid、L-glutamine、β-mercaptoethanol、Sodium pyruvate、多聚赖氨酸购自美国Sigma公司;fluo-4 AM购自美国Thermo Fisher Scientific。
1.2 原代神经元的制备
新生24 h以内的SD大鼠, 低温麻醉,75%酒精浸泡消毒5 min后断头,移入放有无菌滤纸的培养皿中(滤纸用于吸去多余血水)。无菌条件下,将全脑取出,放入盛有冰浴预冷的D-Hanks(不含钙、镁离子和酚红)的培养皿中。小心取出大脑皮层,体视显微镜下剥离脑膜。将皮层组织剪成0.5~1 mm3的组织块,用尖头抛光的Pasteur滴管轻轻吹打,40 μm细胞筛过滤除去组织碎片,细胞悬液1 000 r/min离心5~10 min,加神经元培养液重悬细胞, 以(1.5~2.5)×105个/mL接种于处理过的培养皿(接种前一天,用12.5 μg/mL Ploy-D-lysine处理细胞培养皿,室温过夜后吸出液体,用无菌三蒸水洗三遍后,置超净台中晾干备用)中,置37 ℃、5%CO2培养箱培养。每天观察细胞生长情况,每隔3 d换一次神经元培养液,7~10 d后可用于实验。
1.3 刺激电极的制作
准备2根1 m左右的导线(长度取决于刺激器到显微镜镜头的距离),5 cm钨丝1根,绝缘胶布,绝缘塑料底。根据培养皿的直径和深度,把钨丝弯成2个几字形,用绝缘胶布把钨丝固定在绝缘塑料底上。把钨丝的两端和导线的两端连接在一起,导线另外两端连接到刺激器的隔离器的正负极上。
1.4 转盘共聚焦显微镜系统的配置
该系统由高速双转盘共聚焦扫描单元、激光器、超高灵敏度EMCCD、全自动倒置荧光显微镜、X-Y闭环控制电动载物台、压电陶瓷Z轴、精确同步控制器、图像工作站和相关软件组成。快速共聚焦成像是通过将共聚焦双转盘系统安装到倒置显微镜的荧光端口上获得的。转盘是由两个同轴排列的圆盘组成,每个圆盘有大约20 000个针孔,在上方圆盘的针孔上装有微透镜,与下方圆盘的针孔一一对应,使得入射光直接聚焦到下圆盘的针孔。固体激光器提供激发光,二向色镜通过旋转盘中的针孔阵列(直径50 μm)投射激发光,该旋转盘以1 kHz的速度旋转通过物镜(60×/1.35)到样品上。图像传感器为电子倍增电荷耦合装置(electron-multiplying charged-coupled device,EMCCD)相机,像素为512×512,钙离子荧光指示剂fluo-4激发波长为488 nm。曝光时间为200 ms,频率为1 Hz时获取图像。
1.5 钙离子浓度的检测
Fluo-4 AM用Cytobuffer稀释1000倍,终浓度为1 μmol/L,用37 ℃ Hanks液润洗神经元2次,加入稀释后的fluo-4AM,37 ℃孵育30 min,室温下再孵育30 min。然后,将细胞培养皿放在XY-Piezo Z Stages 显微镜用电动载物台上,采用EMCCD相机,通过复消色差物镜(1.35NA)60×油浸镜头成像。488 nm激光,在大于510 nm波长处检测发射荧光。
1.6 钙离子分析
使用图像分析软件ImageJ分析细胞内的荧光强度。在ImageJ中打开图像文件(.tiff文件),单击选择工具,选择感兴趣区域(ROI)。先选择背景,再选择细胞。打开“analyze>tools> ROI manager”,单击“add”。可以在单个图像上选择多个ROI以进行测量。重复前面的步骤,直到所有ROI已添加到ROI Manager。单击“more>multi measure”,选择“measure all slices”,然后单击“ok”以获取fluo-4的平均荧光强度表,然后保存文件。
2 结果
2.1 原代神经元胞内自发钙离子变化
显微镜下的神经元形态清晰,结果见图1。下图是神经元图像按空间重建后,选取神经元胞内钙离子随着空间的变化。不同的神经元自发钙离子变化的出现不同,在8~10 min内,约10%的神经元出现自发性钙离子升高。自发性钙离子升高可能跟一种电压型钾离子通道相关[4]。

图1 原代神经元胞内自发钙离子变化注:A.神经元(白色箭头处)荧光图像;B.神经元胞内钙离子的变化Fig.1 Spontaneous intracellular calciumchanges in primary neuronsNote:A. Fluorescent image of neurons (white arrows);B. Intracellular calcium changes in neurons
2.2 原代神经元电刺激后细胞胞质内钙离子变化
原代神经元受到电刺激后胞内钙离子变化见图2,电刺激诱发神经元,胞内钙震荡。一般情况下,神经元胞内钙离子会随着电刺激开始迅速上升,但也有个别神经元如神经元2(图2B、C),神经元胞内钙离子出现在电刺激的后期。从图2C还可以看出不同的神经元钙离子升高的频率和振幅也均有不同,可能跟神经元的类型不同有关[5]。刺激结束后,胞内钙离子还是有周期性升高,但升高的幅度减小。
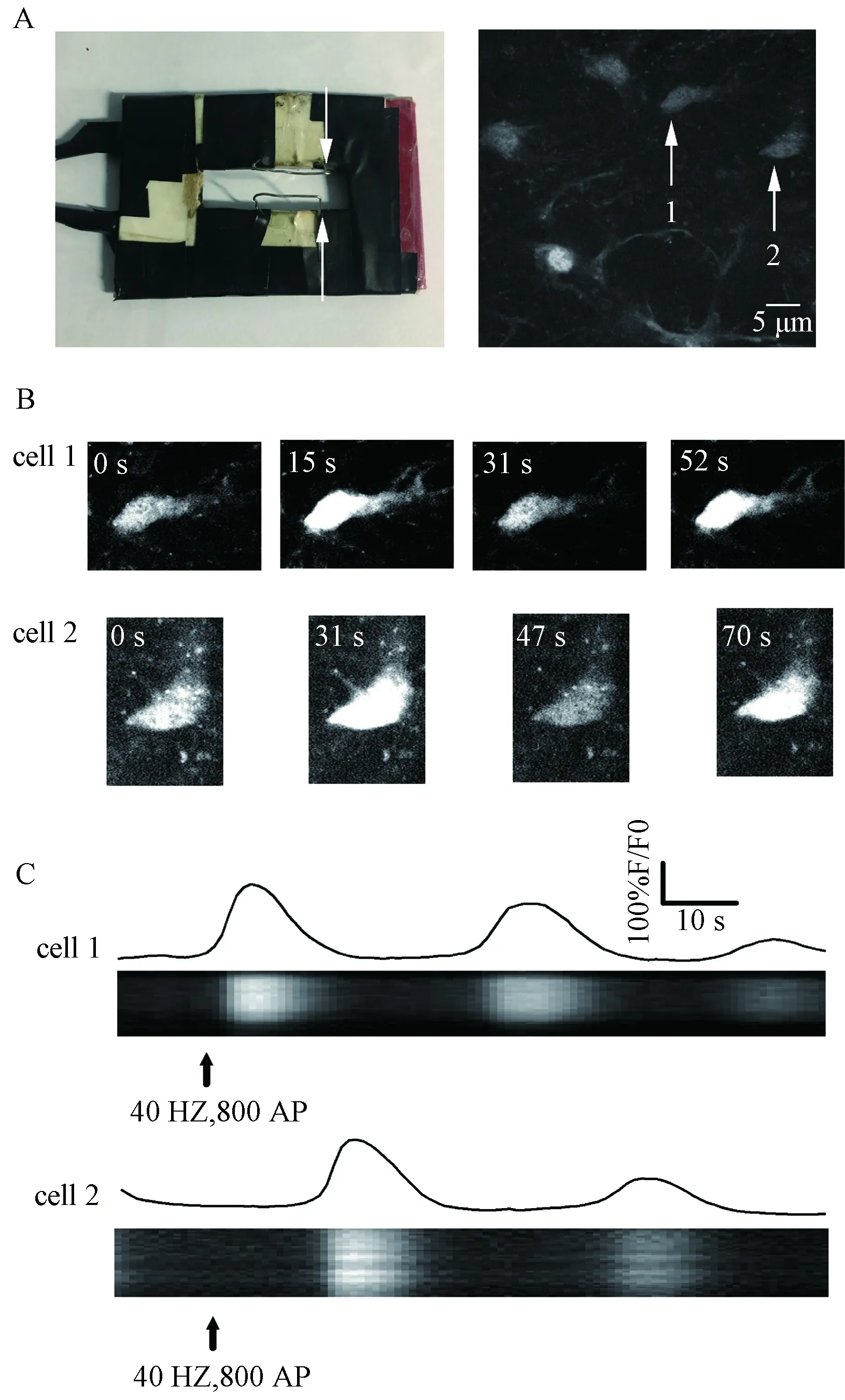
图2 原代神经元受到电刺激后胞内钙离子变化注:A.实验用电刺激电极(白色箭头所指为几字形的刺激电极)和分析所选的两个神经元;B.给予电刺激前后,神经元1和2在不同的时间点所得荧光图像;C.神经元受到电刺激后胞内钙离子随着时间的变化图Fig.2 Changes in intracellular calcium after theneurons were electrically stimulatedNote:A.The stimulus electrodes (white arrows refer to the stimulus electrodes) and the two selected neurons for analysis;B. Fluorescent images obtain for neurons 1 and 2 at different points in time, before and after triggering;C. Intracellular calcium of neurons changes after stimulated with time
3 讨论
普通共聚焦显微镜因分辨率低和光毒性,不适合快速的活细胞成像[6-7],而转盘共聚焦显微镜有1 000个小孔同时扫描样本,速度远远高于单点扫描的普通共聚焦显微镜,超高速、高分辨率成像使其成为研究细胞动态过程的极佳工具。在神经元的研究中,转盘共聚焦已用于监测受体的运动和作用以及细胞的迁移[8-9]。
研究神经元内的钙离子变化需要良好的空间分辨率和高帧速率(10~100帧/s)和高信噪比的成像系统。尽可能降低染料浓度进而减小或消除染料的副作用[10],激光的激发强度也应保持最小,以确保神经元保持健康并显示出与生理相关的行为[11-12]。
系统配备的图像传感器为EMCCD,像元尺寸为16 μm×16 μm, 有效感光面积大,背照式感光使其量子效率达到90%以上,因此适合弱光信号的采集。制冷温度为-80 ℃,因此暗电流几乎可以忽略不计,噪声低,信噪比高,可以减少曝光时间或激光强度,使得光漂白性低,适合长时间采集。全幅512×512采集速度为56帧/s,采集速度可以达到ms级。综上所述,EMCCD适合长时间快速的弱光信号的采集。在本次实验中记录到的神经元结构清晰可见,给予电刺激后电刺激后会导致细胞胞体钙离子的可逆增加。
灵敏度除了受到相机的影响,还受到显微镜光学、机械或电子噪声的限制。本研究使用奥林巴斯研究性倒置活细胞显微镜,其高性能二向色镜、复眼透镜系统能够提供均匀亮度的荧光图像,以及匹配的复消色差物镜等光学器件,并配备有Z轴补偿系统,连续自动对焦模式使观察平面保持不变,还能避免由于温度改变或添加试剂导致焦点漂移,使其能够在长时间的成像过程中保持连续的聚焦,非常适合测量对焦点要求高的活细胞成像。
现在的研究中,使神经元兴奋的除了特异的激动剂之外主要方式有高钾溶液和电刺激等[13],它们的最终作用都是使神经元去极化,从而使钙离子通道打开,钙离子内流,胞内钙离子增加。我们使用电刺激器master-8产生脉冲刺激,它的优点是8个通道可以各自独立运行,也可以灵活、同步的产生复杂的脉冲模式,可通过改变脉冲的频率、强度等来模拟生理和病理的状况,是体外研究神经元兴奋性理想的刺激方式。另外,在神经元的突触可塑性研究中,电刺激也是必不可少的刺激方式。
本次研究表明,高灵敏度的EMCCD图像检测器,高度稳定、高效的激光传输系统,及精确同步控制器和易于使用的系统控制软件,这些组成使得系统无论是灵敏度还是速度都非常高,可成功用于观察神经元内电刺激引起的钙离子变化。许多其他可兴奋性活细胞,如心肌细胞和腺体细胞也可使用此刺激方式。此外,还可以通过添加有针对性的激光光漂白、活化等工具,分离或破坏细胞过程以提取有关这些过程的定量信息。
