阿帕替尼二线治疗晚期胃癌的疗效和安全性研究
2020-04-07朱益平彭玉珍吉兆宁
何 杨,朱益平,彭玉珍,吉兆宁
(皖南医学院第一附属医院 弋矶山医院 肿瘤内科,安徽 芜湖 241001)
胃癌作为常见恶性肿瘤之一,在我国的发病率和病死率居高不下。据流行病学报道[1],我国胃癌每年新发病例超42万例,早期胃癌仅占10%,化疗是进展期胃癌的主要治疗手段,但目前尚不能获得满意的临床疗效,在治疗过程中常会出现病情进展恶化,一线化疗效果欠佳。甲磺酸阿帕替尼(Apatinib)是我国自主研制的靶向治疗胃癌的新药,属于小分子血管内皮生长因子酪氨酸激酶抑制剂,临床应用中无需进行相关基因检测,也是晚期胃癌一线标准化治疗失败后,被临床验证有效的分子靶向药物。现将自2016年6月~2018年1月在弋矶山医院使用的病例情况与同期二线方案化疗对比分析报道如下。
1 资料与方法
1.1 病例资料 选取我院2016年6月~2018年1月经一线治疗失败的晚期胃癌患者46例,入选标准:均经病理学确诊为胃癌,至少存在一个可评价病灶,影像学等辅助检查证实为无法手术切除或者术后复发转移;血常规、肝肾功能及心电图基本正常;预计生存期≥3个月;ECOG评分≤2分。实验组排除难以控制的高血压及出血倾向的患者。实验组(阿帕替尼组)24例,对照组(化疗组)22例。两组的一般资料比较具有可比性,差异无统计学意义(P>0.05),见表1。
表1 两组患者临床特征
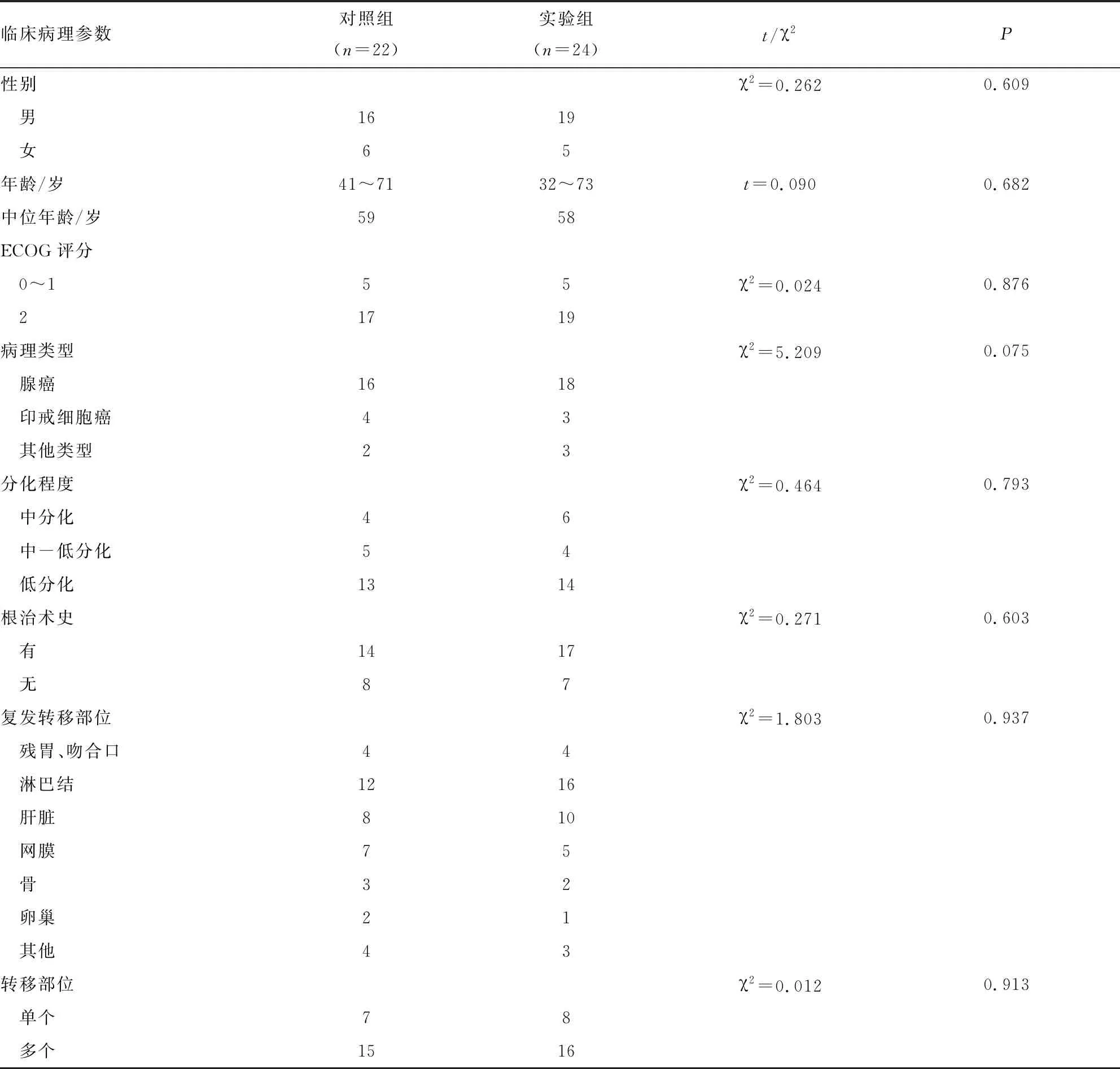
临床病理参数对照组(n=22)实验组(n=24)t/χ2P性别χ2=0.2620.609 男1619 女65年龄/岁41~7132~73t=0.0900.682中位年龄/岁5958ECOG评分 0~155χ2=0.0240.876 21719病理类型χ2=5.2090.075 腺癌1618 印戒细胞癌43 其他类型23分化程度χ2=0.4640.793 中分化46 中-低分化54 低分化1314根治术史χ2=0.2710.603 有1417 无87复发转移部位χ2=1.8030.937 残胃、吻合口44 淋巴结1216 肝脏810 网膜75 骨32 卵巢21 其他43转移部位χ2=0.0120.913 单个78 多个1516
1.2 方法 化疗组根据患者的ECOG评分采用含紫杉类、氟尿嘧啶类、铂类或伊立替康的单药或双药联合方案,具体用法用量参照NCCN指南。甲磺酸阿帕替尼片(商品名:艾坦,江苏恒瑞医药股份有限公司)850 mg(如出现3~4级不良反应,减量至750 mg/次后再次出现3~4级不良反应,减量至500 mg/次,如不能耐受则终止治疗),每日1次口服,维持至疾病进展或难以耐受毒副作用;28 d为1周期。每治疗2周期后评价疗效。
1.3 评价标准 疗效评价采用RECIST1.1标准分为完全缓解(CR)、部分缓解(PR)、稳定(SD)和疾病进展(PD)。以CR+PR计为有效率(response rate,RR),CR+PR+SD计为疾病控制率(disease control rate,DCR);无进展生存期(PFS)指从对肿瘤进行二线治疗始至肿瘤出现继发进展的时间跨度;总生存期(overall survival,OS)指二线治疗开始到患者死亡或末次随访时间。不良反应按照NCI-CTC 2.0标准分为0~4级。
1.4 随访 采取门诊复查及电话方式随访。随访内容包括血常规、肝肾功能、肿瘤标志物、B超、胸片、CT、MRI等。随访日期截止到2019年4月30日,尚生存或失访的病例列为截尾数据。
1.5 统计学分析 用SPSS 25.0软件作统计分析,临床资料采用χ2检验和t检验,不良反应采用秩和检验,PFS及OS分析采用Kaplan-Meier法。P<0.05为差异有统计学意义。
2 结果
2.1 近期疗效 46例患者均完成至少2周期治疗。对照组RR 22.7%,DCR 45.4%;实验组RR 25.0%,DCR 58.3%;两组的RR(χ2=0.033,P=0.875)和DCR(χ2=0.763,P=0.382)比较差异无统计学意义(表2)。
表2 两组患者有效率和疾病控制率比较

组别nCRPRSDPDRR(%)DCR(%)化疗组220551222.745.4阿帕替尼组240681025.058.3
2.2 远期疗效 随访截止时间为2019年4月30日,对照组无存活病例,实验组尚有1例存活。对照组中位PFS 5.8个月(95%CI:3.502~8.098个月),实验组中位PFS 7.0个月(95%CI:5.440~8.560个月),两组中位PFS(χ2=4.165,P=0.041)比较有统计学意义(图1)。
对照组中位OS 10.3个月(95%CI:8.308~12.292个月),实验组中位OS 11.6个月(95%CI:8.863~17.481个月),两组中位OS(χ2=0.791,P=0.374)比较差异无统计学意义(图2)。
2.3 毒副反应 两组方案的不良反应表现为骨髓抑制,神经毒性,高血压、蛋白尿、手足综合征,脱发等等。对照组白细胞减少、外周神经毒性、呕吐、脱发的发生率高于实验组(P<0.05),见表3。
图1 两组患者无进展生存时间比较
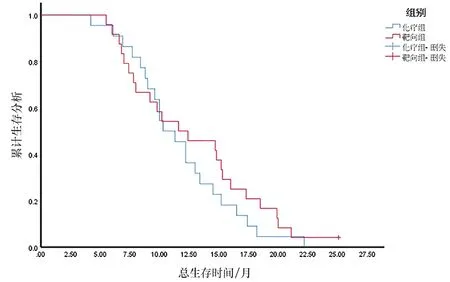
图2 两组患者总生存时间比较
表3 两组患者不良反应比较

毒副反应对照组01234实验组01234ZP白细胞减少348521644004.0670.000血红蛋白减少1084001193100.0240.981血小板减少98410677311.6880.091肝功能异常1642001653000.4620.644手足综合征8103101046310.7280.466神经毒性1183002220003.1540.002心脏毒性1651001572000.7620.446高血压1273001184100.7210.471蛋白尿1930001572001.8960.058口腔炎1732001652100.7930.428呕吐8104001680002.3630.018腹泻1255001842001.5380.124脱发1417002220005.9880.000
3 讨论
根据CSCO指南推荐,根治术后出现复发转移,以及就诊时已丧失手术机会的局部晚期或伴转移病灶的胃癌患者应采取化疗为主的综合治疗,一般选择氟尿嘧啶类、铂类、紫杉类等药物[2]。但是相当一部分上述患者,常常在经过一线化疗后仍然出现病情进展。考虑到晚期胃癌患者的一般体力状况相对欠佳以及对化疗药物敏感性降低,故在再次选择化疗药物的时候要兼顾疗效和安全性。研究表明,二线化疗方案的有效率只有20%左右,效果不甚理想,分子靶向药物作为一种新的治疗手段,在晚期胃癌的治疗方面显示出新的前景[3]。
甲磺酸阿帕替尼是我国自主研制的用于治疗晚期胃癌的小分子靶向药物,于2014年12月13日经国家食品药品监管局批准上市,它属于小分子血管内皮生长因子酪氨酸激酶抑制剂,它可通过高度选择性竞争细胞内VEGFR-2的ATP结合位点,阻断下游信号转导,干扰酪氨酸激酶的合成,抑制肿瘤组织新血管的生成,达到治疗肿瘤的目的[4-5]。
本研究收集了我院收治的46例经一线化疗方案治疗失败的晚期胃癌患者,其中36例ECOG评分=2,二线化疗不良反应耐受性相对较差。经与患者及家属沟通后,其中24例二线治疗予以口服阿帕替尼,对比22例常规二线化疗的具有相似临床资料患者,研究结果显示实验组的RR和DCR分别是25.0%和58.3%,DCR高于一项阿帕替尼Ⅲ期临床研究结果报道[6](DCR=42.05%),可能由于该Ⅲ期临床研究选用的都是经二线及以上治疗失败的患者,病情相对较晚,疗效欠佳。安徽省立医院姚艺玮等[7]以阿帕替尼治疗经二线及以上化疗失败的30例晚期胃癌患者,疗效评价无完全缓解,3例部分缓解,14例病情稳定,13例进展。疾病缓解率10.0%,DCR为56.7%,与本研究相近。本研究中对照组RR 22.7%,DCR 45.4%,和近年来国内其他研究结果相似[8-9]。结论为实验组和对照组的两组的RR(χ2=0.033,P=0.875)和DCR(χ2=0.763,P=0.382)比较无统计学意义。
国内王博等[10]研究阿帕替尼治疗晚期胃癌患者的中位PFS为3.76个月,但其中二线以上治疗失败患者占研究人数的68.3%。李淼等[11]以阿帕替尼联合SOX方案对比SOX方案二线治疗晚期胃癌,观察到联合组mPFS显著长于化疗组(7.2个月vs4.4个月,P<0.05),联合组中位OS为14.4个月,化疗组OS为10.5个月,差异有统计学意义(P<0.05)。另一项研究纳入一线化疗失败的晚期胃癌患者60例,分为观察组与对照组各30例。对照组采用多西他赛联合顺铂方案治疗,观察组口服阿帕替尼治疗。结果为观察组ORR 76.67%,高于对照组ORR 40.00%;观察组患者3个月生存率为73.33%(22/30)高于对照组的46.67%(14/30);12个月生存率46.67%(14/30)亦高于对照组的16.67%(5/30),观察组生存时间(20.86±5.34)个月较对照组的(12.65±3.19)个月延长,以上差异均具有统计学意义(P<0.05)[12]。本研究入组病例均为一线失败的患者,实验组mPFS 7.0个月,较对照组mPFS 5.8个月延长(P=0.041)。对照组mOS对比实验组mOS(10.3个月vs11.6个月,P=0.374),两组mOS比较差异无统计学意义,但截至随访时间结束,阿帕替尼组尚有1例患者存活,且行为能力尚佳。
在不良反应方面,阿帕替尼常见的不良反应包括血压升高、蛋白尿、手足综合征以及出血等。在本研究中,对照组呕吐、手足综合征、白细胞减少、神经毒性及脱发的发生率高于实验组(P<0.05),以上均为常见化疗副反应。骨髓抑制方面阿帕替尼对白细胞及血红蛋白的影响不大,但值得注意的是,两组患者治疗后血小板减少虽然无统计学差异,但研究组发生率较高,达75.0%,有4例患者出现Ⅲ~Ⅳ度血小板减少,其中3例均合并Ⅱ~Ⅲ度口腔炎,提示口腔炎的发生可能与血小板减少发生率有一定关联性,具体原因及机制有待进一步研究。以上患者经药物减量以及治疗后均可缓解耐受。提示患者在口服阿帕替尼治疗时需定期复查血常规,关注血小板情况,及时给予对症处理。
综上所述,本研究中患者接受阿帕替尼治疗的临床疗效和安全性较好,无需对应靶点基因检测,现已进入多省市医保目录,一般家庭经济均可承受,故对于一线化疗失败的晚期胃癌患者,可考虑予以甲磺酸阿帕替尼治疗。
